文档内容
毫州二中 2024-2025 学年度高二上学期第二次月考
化学试卷
满分:100分:考试时间:75分钟
可能用到的相对原子质量:H:1 C:12 O:16 Fe:56
第I卷(选择题)
一、单选题(每小题3分,共42分)
1. 下列关于化学反应热效应的描述中,正确的是
A. 已知中和热 为 ,则
B. 甲醇燃烧热的热化学方程式可表示为
C. 已知 ,则生成物分子的化学键形成时所释
放的总能量大于反应物分子的化学键断裂时所吸收的总能量
D. 一定条件下,将 和 置于密闭的容器中充分反应生成 ,放出热量
,用热化学方程式可表示为
【答案】C
【解析】
【详解】A.弱酸醋酸在溶液中的电离是吸热过程,则醋酸溶液与氢氧化钠溶液反应生成1mol水放出的
热量小于 ,反应的反应热 H大于-57.3kJ/mol,故A错误;
B.甲醇的燃烧热为1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量,故B错误;
△
C.由热化学方程式可知,氢气与氯气反应生成氯化氢的反应是反应物总能量大于生成物总能量的放热反
应,所以形成化学键时释放的总能量大于断裂化学键时吸收的总能量,故C正确;
D.合成氨反应为可逆反应,可逆反应不可能完全反应,1mol氮气和3mol氢气在密闭容器中不能完全反
应,由反应放出的热量为38.6kJ可知,反应的焓变 H小于-38.6kJ/mol,故D错误;
故选C。
△
2. 下列有关仪器使用方法或实验操作正确的是
A. 用 试纸测定氯水溶液的
B. 用强酸溶液滴定弱碱溶液,可以用甲基橙作指示剂
C. 酸碱中和滴定实验中,装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D. 在进行滴定操作中,眼睛应注视上端滴定管中液面变化
【答案】B
【解析】
【详解】A.氯水含有的次氯酸具有漂白性,不能用 试纸测定氯水溶液的 ,A错误;
B.用强酸溶液滴定弱碱溶液,滴定终点时溶液呈酸性,可以用甲基橙作指示剂,B正确;
C.酸碱中和滴定实验中锥形瓶不用待测液润洗,否则会消耗更多的标准液,C错误;D.在进行滴定操作中,眼睛应注视锥形瓶中溶液颜色变化,D错误;
故选B。
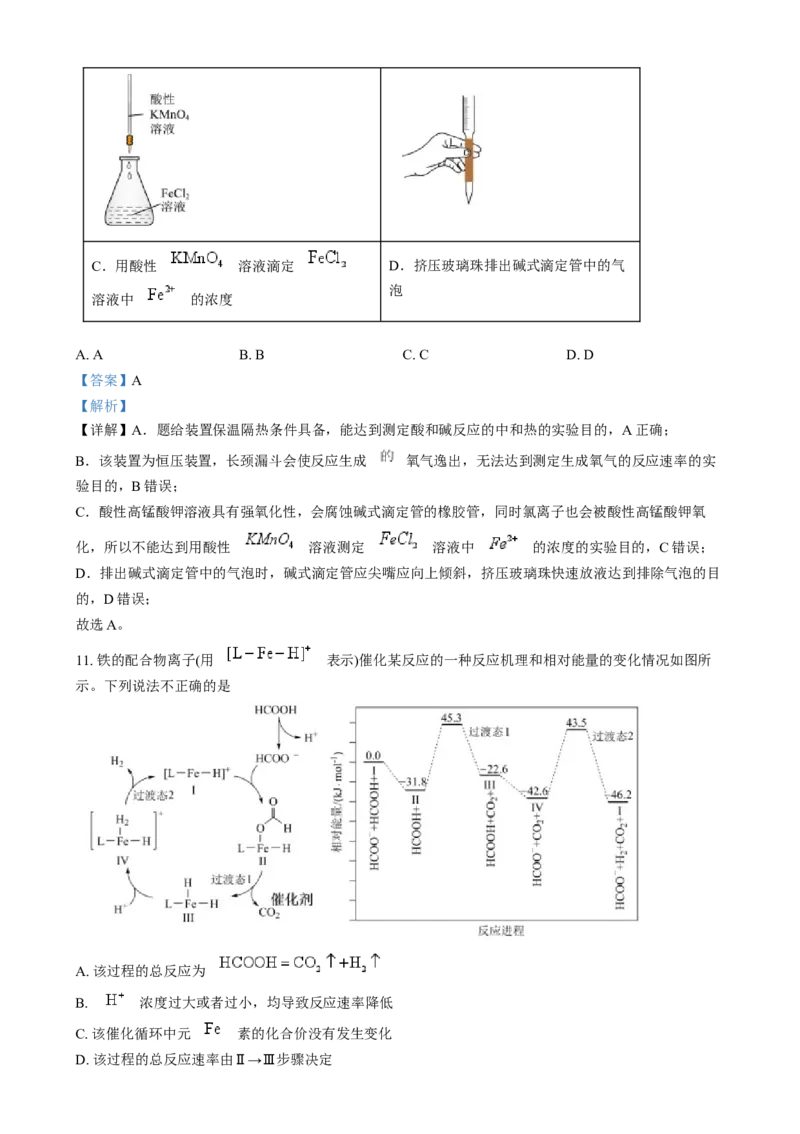
3. 化学是以实验为基础的科学,下述实验操作能达到预期目的的是
选项 实验操作 实验目的
向 沸水中逐滴加入5~6滴 饱和溶液,继续
A
制备 胶体
煮沸至液体呈红褐色,停止加热
证明酸性:
B
在 溶液中通入 气体
检验该溶液是否含
向某溶液中滴加稀 溶液,将湿润红色石蕊试纸置于试
C
管口
分别向2支试管中加入 和 的 溶
研究催化剂对
D
分解速率的影响
液,再向其中1支加入少量 粉末
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.制取氢氧化铁胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液并继续煮沸至液体变红褐色,
故A正确;
B. 与 发生的是氧化还原反应,不能比较 与 的酸性强弱,故
B错误;
C.应该使用浓氢氧化钠溶液并微热,使得生成的氨气挥发出来后,使用湿润的红色石蕊试纸检验,故C
错误;
D.实验中有2个变量,要研究催化剂对过氧化氢分解速率的影响,应该保证过氧化氢的浓度相同,选项
中的实验方案不能研究催化剂对 分解速率的影响,故D错误;
故选A。
4. 已知反应 (X、Y、Z、W均为气体)在不同条件下的化学反应速率如下,其中表
示反应速率最快的是
A. B.
C D.
【答案】D
【解析】
【分析】化学反应速率之比等于化学计量数之比,比较速率和系数的比值大小即可,比值越大,反应速度
越大,以此分析;【详解】A. ,
;
B. ;
C. ;
D. ,
;
对比可知反应速率最快的是D,故答案选D。
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 的溶液中:
B. 能使甲基橙变红的溶液中:
C. 的溶液中:
D. 水电离的 为 的溶液中:
【答案】B
【解析】
【 详 解 】 A . 在 的 溶 液 中 , 和 要 水 解 生 成 沉 淀 和
沉淀而不能共存,A错误;
B.能使甲基橙变红的溶液为酸性溶液,给出的4种离子相互之间都不发生反应,能共存,B正确;
C. 的溶液 ,解得
,溶液显碱性,则 与 要反应
不能共存,C错误;
D.水电离的 为 的溶液可能显酸性,则 不能共存,也可能显
碱性,则 不能共存,D错误;
故答案为:B。
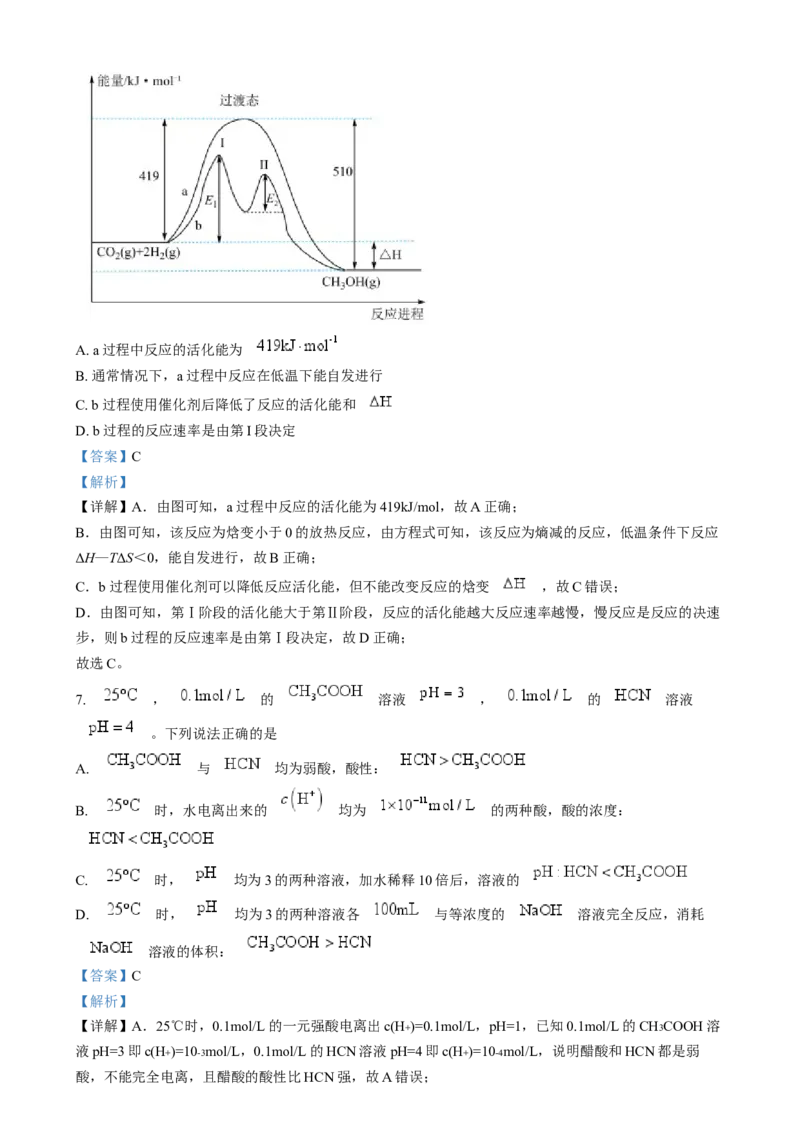
6. 反应 ,其两种反应过程中的能量变化曲线如图a、b所示,下列说法错
误的是A. a过程中反应的活化能为
B. 通常情况下,a过程中反应在低温下能自发进行
C. b过程使用催化剂后降低了反应的活化能和
D. b过程的反应速率是由第I段决定
【答案】C
【解析】
【详解】A.由图可知,a过程中反应的活化能为419kJ/mol,故A正确;
B.由图可知,该反应为焓变小于0的放热反应,由方程式可知,该反应为熵减的反应,低温条件下反应
ΔH—TΔS<0,能自发进行,故B正确;
C.b过程使用催化剂可以降低反应活化能,但不能改变反应的焓变 ,故C错误;
D.由图可知,第Ⅰ阶段的活化能大于第Ⅱ阶段,反应的活化能越大反应速率越慢,慢反应是反应的决速
步,则b过程的反应速率是由第Ⅰ段决定,故D正确;
故选C。
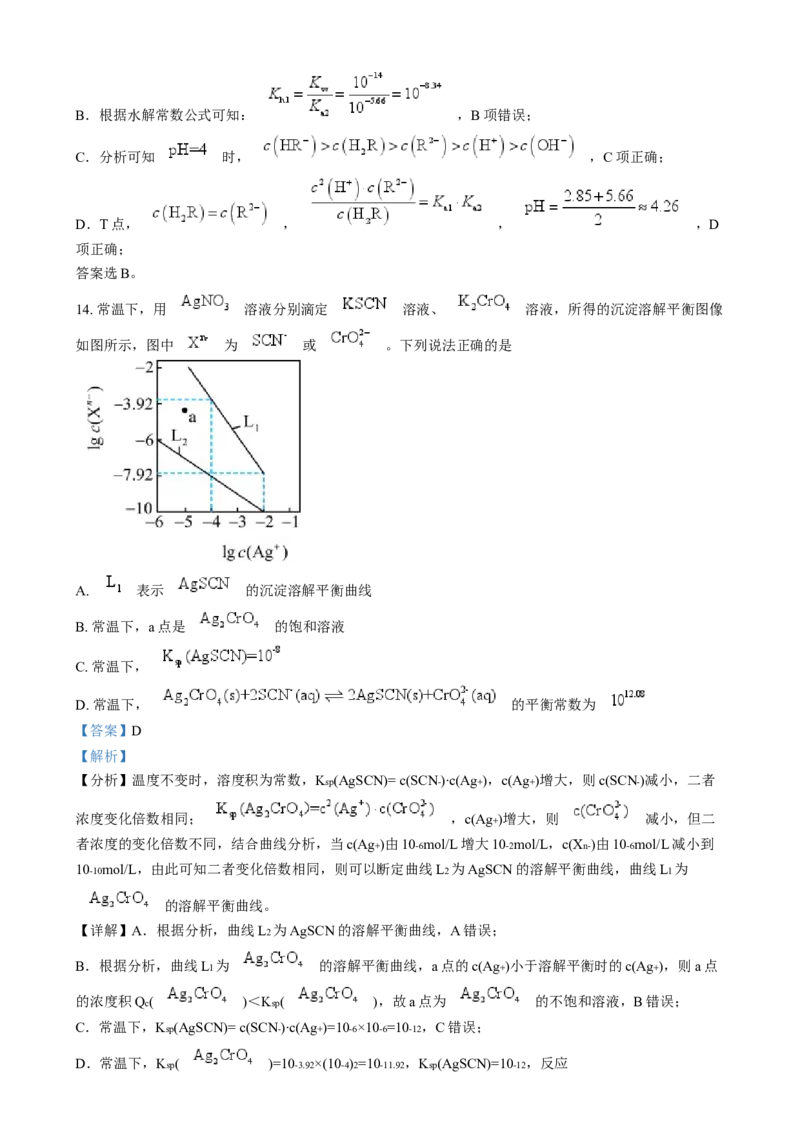
7. , 的 溶液 , 的 溶液
。下列说法正确的是
A. 与 均为弱酸,酸性:
B. 时,水电离出来的 均为 的两种酸,酸的浓度:
C. 时, 均为3的两种溶液,加水稀释10倍后,溶液的
D. 时, 均为3的两种溶液各 与等浓度的 溶液完全反应,消耗
溶液的体积:
【答案】C
【解析】
【详解】A.25℃时,0.1mol/L 的一元强酸电离出c(H+)=0.1mol/L,pH=1,已知0.1mol/L 的CH3COOH溶
液pH=3即c(H+)=10-3mol/L,0.1mol/L 的HCN溶液pH=4即c(H+)=10-4mol/L,说明醋酸和HCN都是弱
酸,不能完全电离,且醋酸的酸性比HCN强,故A错误;B.醋酸和HCN溶液中氢离子浓度相同时,对水的电离的抑制作用相同,醋酸酸性比较HCN强,当其氢
离子浓度相同时,酸的浓度:HCN>CH3COOH,故B错误;
C.加水稀释促进弱电解质的电离,醋酸的酸性比HCN强,所以25℃时,pH均为3的CH3COOH和HCN
溶液,加水稀释10倍后,HCN电离出氢离子浓度大于CH3COOH,溶液的pH:HCN2
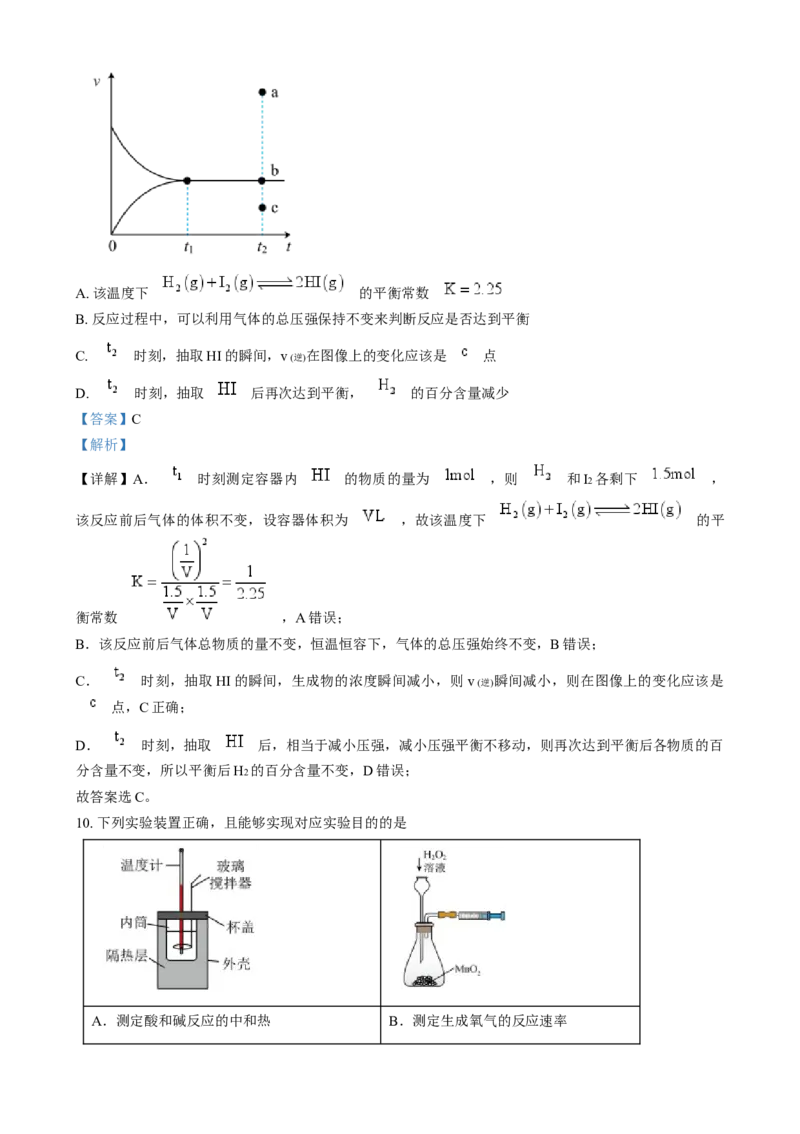
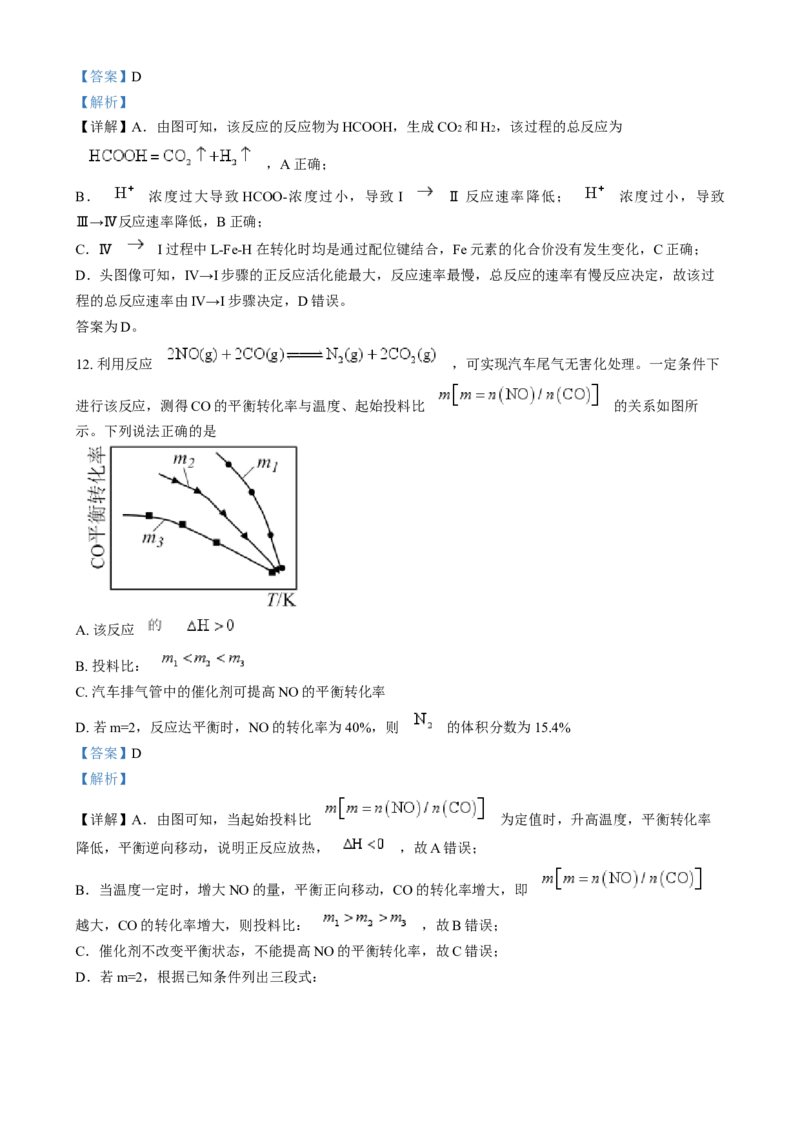
B.草酸能与碳酸钠溶液反应产生气泡
C.标准状况下,取100 mL 0.10 mol·L-1 H2C2O4 溶液与足量锌粉反应,产生224mL H2
(2)写出草酸的电离方程式:___________。
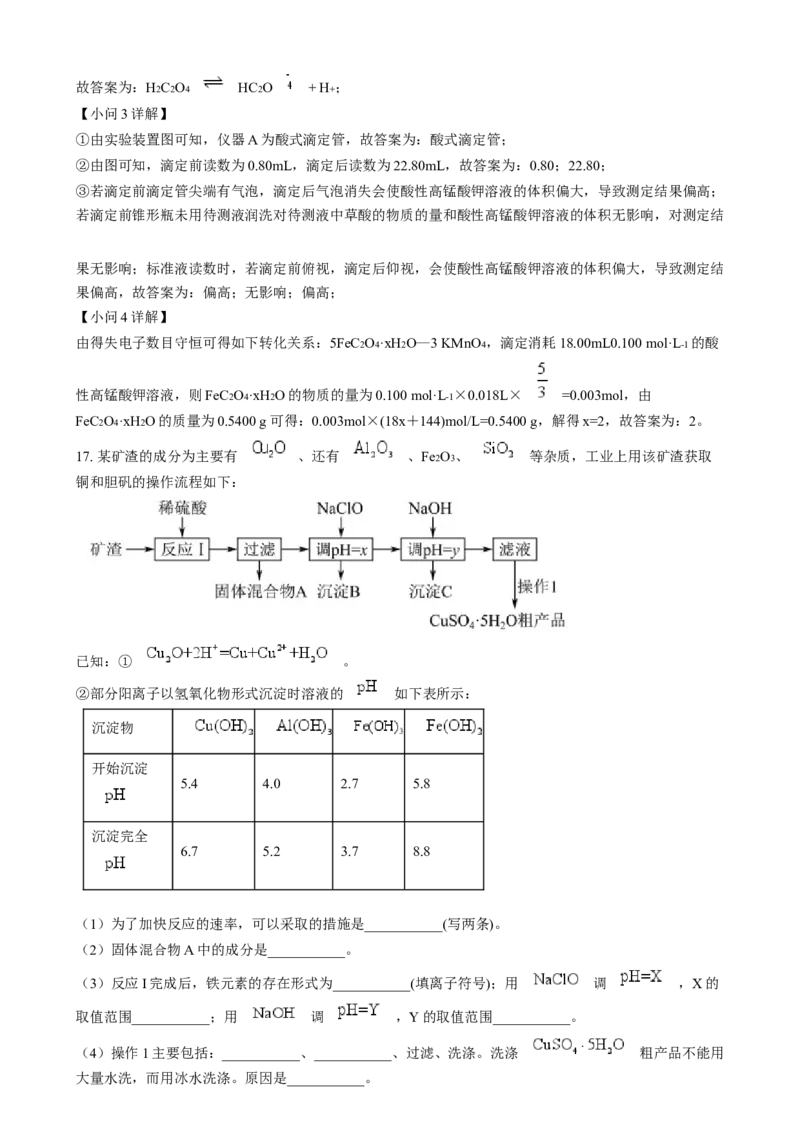
(3)如图是利用一定物质的量浓度的KMnO4 标准溶液滴定某未知浓度的草酸溶液的示意图和滴定前、后
盛放KMnO4 溶液的滴定管中液面的位置。已知滴定原理为①仪器A的名称是___________。
②KMnO4 溶液的体积读数:滴定前读数为___________mL,滴定后读数为___________mL。
③对下列几种假定情况进行讨论:
测定结果的影响(填“偏高”“偏
假定情况
低”或“无影响”)
Ⅰ.若滴定前滴定管尖端有气泡,滴定后气泡消失 ________
Ⅱ.若滴定前锥形瓶未用待测液润洗 ________
Ⅲ.标准液读数时,若滴定前俯视,滴定后仰视 ________
(4)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为
。利用氧化还原滴定法测定草酸亚铁晶体
(FeC2O4 ·xH2O)的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性KMnO4
溶液滴定,达到滴定终点时,消耗0.100 mol·L-1 的酸性KMnO4 溶液18.00 mL。已知:滴定过程中铁、
碳元素分别被氧化为Fe3+ 、CO2 ,锰元素被还原为Mn2+ ,x=___________(FeC2O4 的摩尔质量是144
g·mol-1)。
【答案】(1)A (2)H2C2O4 HC2O + H+
(3) . 酸式滴定管 . 0.80 . 22.80 . 偏高 . 无影响 . 偏高
(4)2
① ② ③ ④ ⑤ ⑥
【解析】
【小问1详解】
A.室温下,取0.005 mol·L-1 的H2C2O4 溶液,测其pH>2说明草酸溶液中存在电离平衡,证明草酸是弱
酸,故符合题意;
B.草酸能与碳酸钠溶液反应产生气泡只能说明草酸的酸性强于碳酸,但不能说明草酸是弱酸,故不符合
题意;
C.标准状况下,取100 mL 0.10 mol·L-1 H2C2O4 溶液与足量锌粉反应,产生224mL H2 只能说明草酸表现
酸性,但不能说明草酸是弱酸,故不符合题意;
故选A;
【小问2详解】
草酸是二元弱酸,在溶液中分步电离,以一级电离为主,电离方程式为H2C2O4 HC2O + H+ ,故答案为:H2C2O4 HC2O + H+ ;
【小问3详解】
①由实验装置图可知,仪器A为酸式滴定管,故答案为:酸式滴定管;
②由图可知,滴定前读数为0.80mL,滴定后读数为22.80mL,故答案为:0.80;22.80;
③若滴定前滴定管尖端有气泡,滴定后气泡消失会使酸性高锰酸钾溶液的体积偏大,导致测定结果偏高;
若滴定前锥形瓶未用待测液润洗对待测液中草酸的物质的量和酸性高锰酸钾溶液的体积无影响,对测定结
果无影响;标准液读数时,若滴定前俯视,滴定后仰视,会使酸性高锰酸钾溶液的体积偏大,导致测定结
果偏高,故答案为:偏高;无影响;偏高;
【小问4详解】
由得失电子数目守恒可得如下转化关系:5FeC2O4·xH2O—3 KMnO4 ,滴定消耗18.00mL0.100 mol·L-1 的酸
性高锰酸钾溶液,则FeC2O4·xH2O的物质的量为0.100 mol·L-1 ×0.018L× =0.003mol,由
FeC2O4·xH2O的质量为0.5400 g可得:0.003mol×(18x+144)mol/L=0.5400 g,解得x=2,故答案为:2。
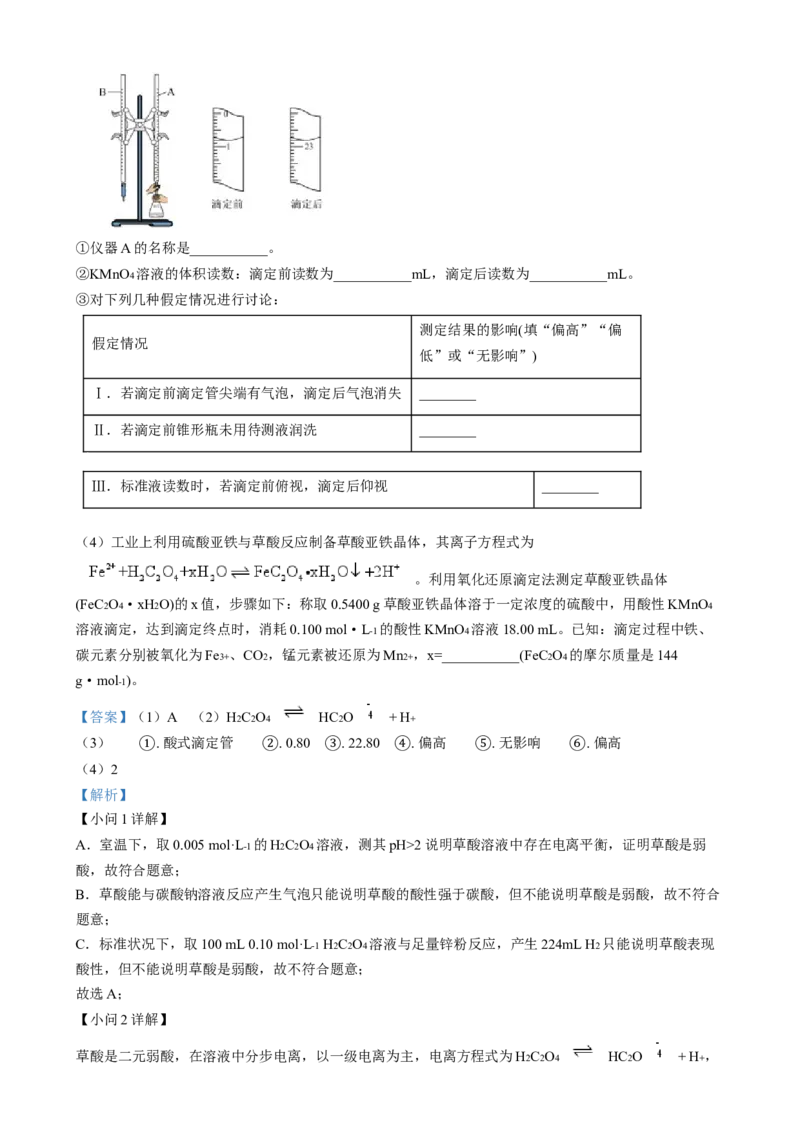
17. 某矿渣的成分为主要有 、还有 、Fe2O3 、 等杂质,工业上用该矿渣获取
铜和胆矾的操作流程如下:
已知:① 。
②部分阳离子以氢氧化物形式沉淀时溶液的 如下表所示:
沉淀物
开始沉淀
5.4 4.0 2.7 5.8
沉淀完全
6.7 5.2 3.7 8.8
(1)为了加快反应的速率,可以采取的措施是___________(写两条)。
(2)固体混合物A中的成分是___________。
(3)反应I完成后,铁元素的存在形式为___________(填离子符号);用 调 ,X的
取值范围___________;用 调 ,Y的取值范围___________。
(4)操作1主要包括:___________、___________、过滤、洗涤。洗涤 粗产品不能用
大量水洗,而用冰水洗涤。原因是___________。(5)用 调 ,生成沉淀B的同时生成一种具有漂白作用的物质,利用题中所给信息分
析沉淀B为___________,该反应的离子方程式为___________。
【答案】(1)适当升高温度;不断搅拌;将矿渣粉碎;适当增大硫酸的浓度等
(2) 、
(3) . . 3.7—4.0 . 5.2—5.4
(4) . 蒸发浓缩 . 冷却结晶 . 冰水既可以洗去晶体表面的杂质离子,又可以减少晶体
① ② ③
的损失
① ② ③
(5) . .
【解析】
① ②
【分析】矿渣加入稀硫酸,Cu2O、Al2O3 、Fe2O3 溶解,二氧化硅不溶,所以固体混合物A是不溶于稀硫
酸的物质,发生的反应有 ,得出A的成分是SiO2 、Cu;由于单质Cu存
在,铁元素以Fe2+ 形式存在,反应为:2Fe3++Cu=Cu2++2Fe2+ ,滤液中主要是Al3+ 、Fe2+ 、Cu2+ ;加入
NaClO具有氧化性,氧化 Fe2+ 为Fe3+ ,同时调节溶液 pH使Al3+ 、Fe3+ 沉淀完全,根据 和
开始沉淀和沉淀结束的pH关系,x范围是:3.7≤pH<4.0,目的是沉淀 ;y范围
是:5.2≤pH<5.4,沉淀 ;得到溶液处理得到硫酸铜晶体;
【小问1详解】
为了加速矿渣和硫酸之间的反应速率,可以采用适当升高温度、不断搅拌、将矿渣粉碎、适当增大硫酸的
浓度等;
【小问2详解】
由分析,A为: 、 ;
【小问3详解】
由于单质Cu存在,发生反应:2Fe3++Cu=Cu2++2Fe2+ ,铁元素以Fe2+ 形式存在;滤液中主要是Al3+ 、
Fe2+ 、Cu2+ ;加入NaClO具有氧化性,氧化Fe2+ 为Fe3+ ,同时调节溶液pH使Al3+ 、Fe3+ 沉淀完全,根据
和 开始沉淀和沉淀结束的pH关系,x范围是:3.7≤pH<4.0,目的是沉淀
;y范围是:5.2≤pH<5.4,沉淀 ;
【小问4详解】
硫酸铜溶液得到晶体的方法:蒸发浓缩、冷却结晶、过滤;胆矾晶体带有结晶水,温度太高导致结晶水失
去,所以可以采用冰水来洗涤,故答案为:蒸发浓缩、冷却结晶;冰水既可以洗去表面的杂质离子,还可
以减少晶体的损失;
【小问5详解】
用NaClO调pH,次氯酸钠氧化亚铁离子生成氢氧化铁沉淀,反应中铁化合价由+2变为+3、氯化合价由
+1变为-1,结合电子守恒反应为: ,生成沉淀B为氢
氧化铁。
18. 合成气( 、 )可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇是科研工
作者的研究热点。回答下列问题:(1)已知:
则 ___________。
(2)在一恒温恒容的密闭容器中发生反应 ,下列说法不能说明该反
应达到化学平衡状态的是___________(填字母)。
A. 体系的压强保持不变 B. 混合气体的密度保持不变
C. D. 的浓度保持不变
(3)用合成气制甲醇的反应为 (假设不发生其他反应)。三个容器中起
始时容积相同,维持恒温,控制条件如表:
编 条件控
号 制
维持恒
A 0.2 0.4 0
容
维持恒
B 0.4 0.8 0
容
维持恒
C 0.4 0.8 0
压
达到平衡时,三个容器中甲醇的体积分数由大到小的顺序是___________(填编号)。
(4)在一定条件下,在容积恒定为 的密闭容器中充入 与 在催化剂作用
下合成甲醇: 。 转化率与温度、压强的关系如图所示:
①由图可知 ___________(填“>”“<”或“=”) 。
②图中b、c、d三点的化学平衡常数为 、 、 ,从大到小的顺序为___________。
③比较体系中气体平均摩尔质量: ___________(填“>”“<”或“=”) 。
④下列措施中能够同时满足增大正反应速率和提高 转化率的是___________(填字母)。
A.使用高效催化剂 B.降低反应温度C.再充入 与 D.不断将甲醇从体系混合物中分离出来
【答案】(1) (2)BC
(3)C>B>A (4) . < . . < . C
【解析】
① ② ③ ④
小问1详解】
由已知反应结合盖斯定律可得,ΔH3=ΔH1-ΔH2=-49-41=-90kJ•mol-1 ,故答案为:-90kJ•mol-1 ;
【小问2详解】
A.由于反应前计量数之和为3,反应后为1,则压强不变时反应达到平衡,故A不选;
B.由于是恒容容器,无论反应是否平衡密度一直保持不变,故B选;
C.达到平衡时,其中氢气的反应速度时甲醇的2倍,即 ,故C选;
D.当某一参加反应的物质浓度不变时,其达到平衡状态,故D不选;
故答案为:BC;
【小问3详解】
B的投入量为 A的2倍;C、B相比,C中恒压,反应进行时物质的减小、体积减小,C相当于加压,平
衡正向进行的程度比C大,故答案为:C>B>A;
【小问4详解】
当压强增大时,平衡正向移动,CO转化率增大,即p2 大于p1 ,故答案为:<;
由图可知升高温度CO转化率降低,平衡逆向移动,K值减小,而且K只和温度有关,b、d两点温度
①
②相同,所以K从大到小为: ,故答案为: ;
由于反应容器密闭,则物质总质量不变,同时d点的物质转化率大于b点,即物质的量:b点大于d
③
点,根据 ,可知M(b)