文档内容
毫州二中 2024-2025 学年度高二上学期第二次月考
化学试卷
满分:100分:考试时间:75分钟
可能用到的相对原子质量:H:1 C:12 O:16 Fe:56
第I卷(选择题)
一、单选题(每小题3分,共42分)
1. 下列关于化学反应热效应的描述中,正确的是
A. 已知中和热 为 ,则
B. 甲醇燃烧热的热化学方程式可表示为
C. 已知 ,则生成物分子的化学键形成时所释
放的总能量大于反应物分子的化学键断裂时所吸收的总能量
D. 一定条件下,将 和 置于密闭的容器中充分反应生成 ,放出热量
,用热化学方程式可表示为
2. 下列有关仪器使用方法或实验操作正确的是
A. 用 试纸测定氯水溶液的
B. 用强酸溶液滴定弱碱溶液,可以用甲基橙作指示剂
C. 酸碱中和滴定实验中,装待测液的锥形瓶用蒸馏水洗过后再用待测液润洗
D. 在进行滴定操作中,眼睛应注视上端滴定管中液面变化
3. 化学是以实验为基础的科学,下述实验操作能达到预期目的的是
选项 实验操作 实验目的
制备
向 沸水中逐滴加入5~6滴 饱和溶液,继续煮沸至液体
A
胶
呈红褐色,停止加热
体
证明酸性:
B
在 溶液中通入 气体
检验该溶液是否含
向某溶液中滴加稀 溶液,将湿润红色石蕊试纸置于试管
C
口分别向2支试管中加入 和 的 溶
研究催化剂对 分
D
解速率的影响
液,再向其中1支加入少量 粉末
A. A B. B C. C D. D
4. 已知反应 (X、Y、Z、W均为气体)在不同条件下的化学反应速率如下,其中表
示反应速率最快的是
A. B.
C. D.
5. 常温下,下列各组离子在指定溶液中能大量共存的是
A. 的溶液中:
B. 能使甲基橙变红的溶液中:
C. 的溶液中:
D. 水电离的 为 的溶液中:
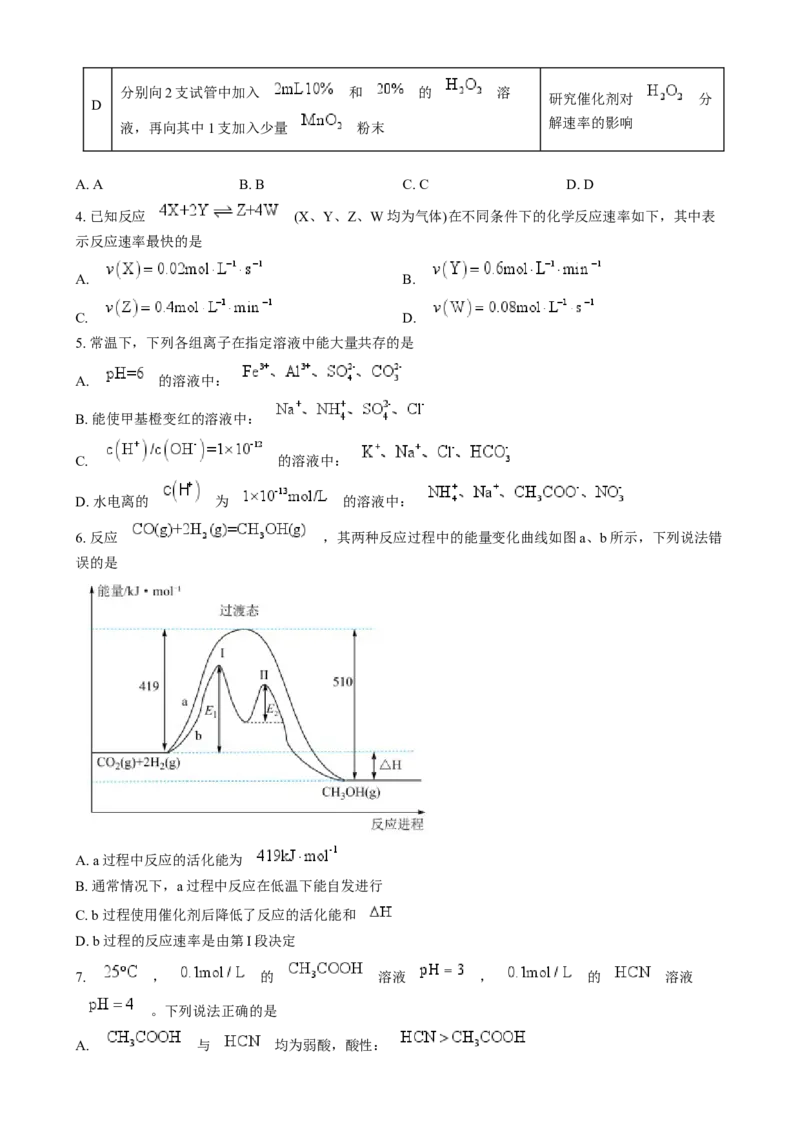
6. 反应 ,其两种反应过程中的能量变化曲线如图a、b所示,下列说法错
误的是
A. a过程中反应的活化能为
B. 通常情况下,a过程中反应在低温下能自发进行
C. b过程使用催化剂后降低了反应的活化能和
D. b过程的反应速率是由第I段决定
7. , 的 溶液 , 的 溶液
。下列说法正确的是
A. 与 均为弱酸,酸性:B. 时,水电离出来的 均为 的两种酸,酸的浓度:
C. 时, 均为3的两种溶液,加水稀释10倍后,溶液的
D. 时, 均为3的两种溶液各 与等浓度的 溶液完全反应,消耗
溶液的体积:
8. 下列说法中正确 是
A. 溶液中离子浓度大小顺序为
B. 的溶液中:
C. 向 、 的混合饱和溶液中加入少量 ,溶液中 减小
D. 浓度均为 的① ② ③ ④
, 由小到大的顺序:④<③<①<②
9. 某温度下,将 和 充入密闭的刚性容器中发生反应
,该反应的 图像如图所示, 时刻测定容器内 的物
质的量为 时刻保持等温等容,抽走 。下列有关叙述正确的是
A. 该温度下 的平衡常数
B. 反应过程中,可以利用气体的总压强保持不变来判断反应是否达到平衡
C. 时刻,抽取HI的瞬间,v (逆) 在图像上的变化应该是 点
D. 时刻,抽取 后再次达到平衡, 的百分含量减少
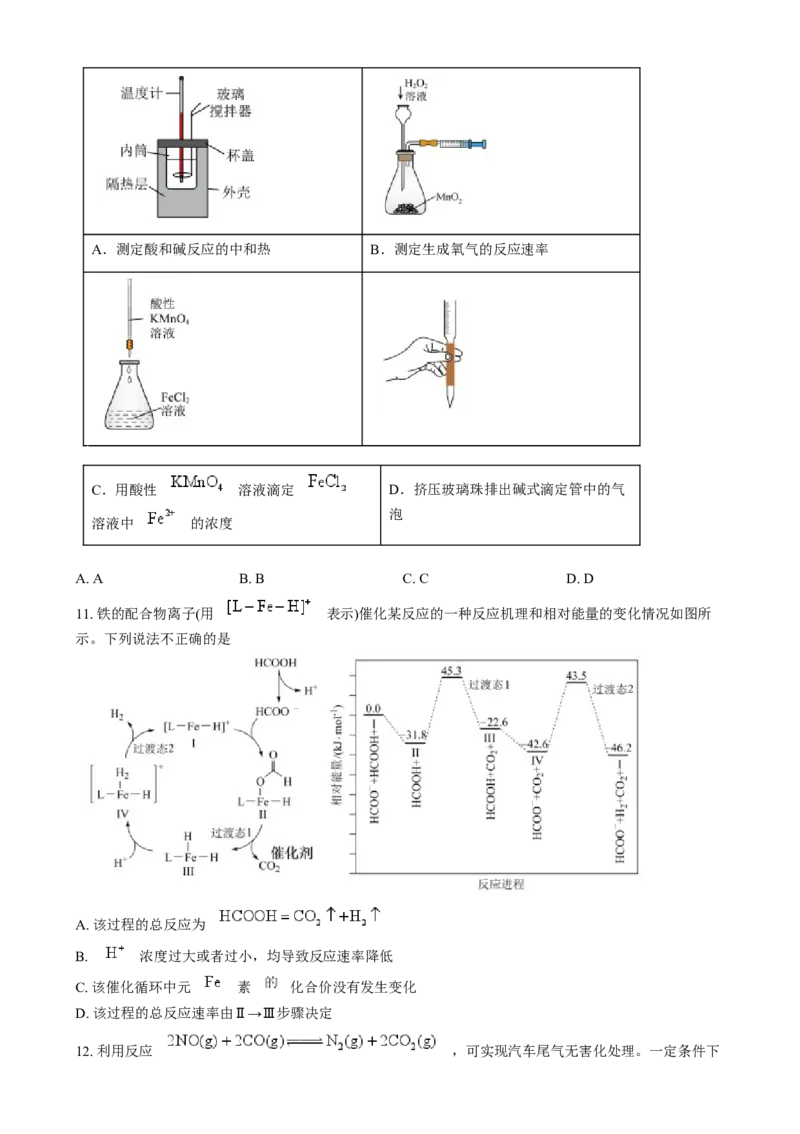
10. 下列实验装置正确,且能够实现对应实验目的的是A.测定酸和碱反应的中和热 B.测定生成氧气的反应速率
C.用酸性 溶液滴定 D.挤压玻璃珠排出碱式滴定管中的气
泡
溶液中 的浓度
A. A B. B C. C D. D
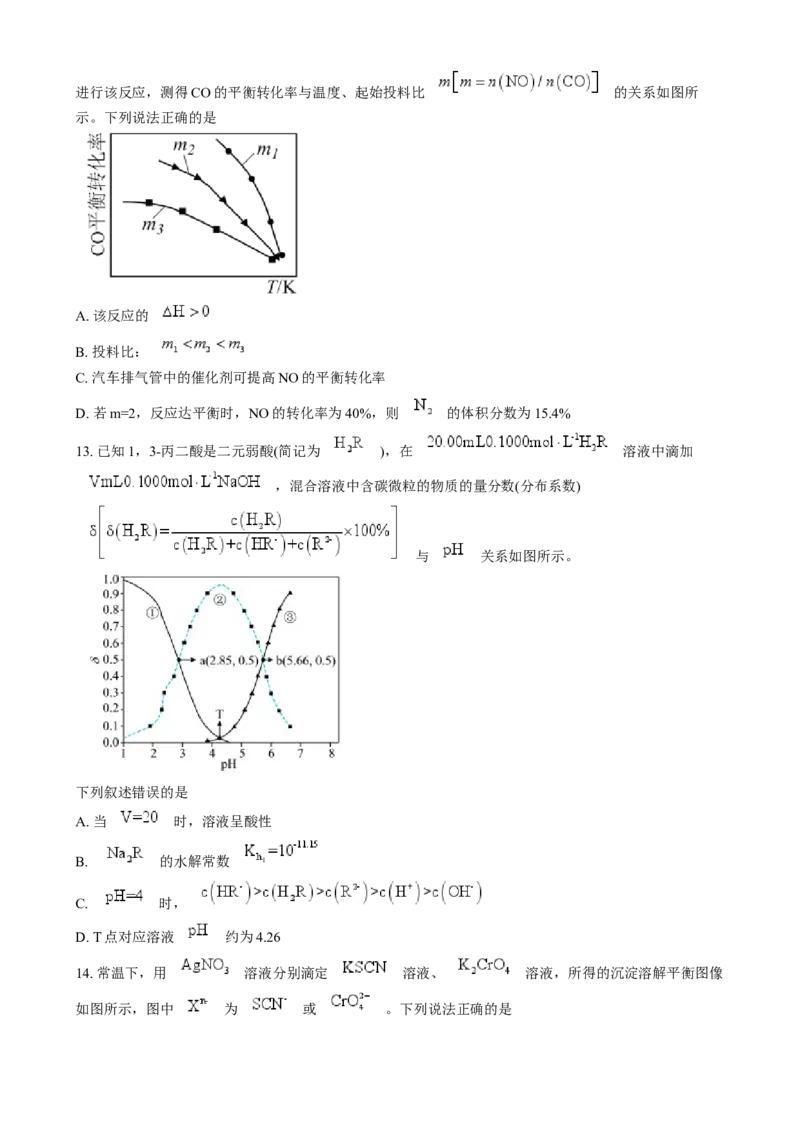
11. 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所
示。下列说法不正确的是
A. 该过程的总反应为
B. 浓度过大或者过小,均导致反应速率降低
C. 该催化循环中元 素 化合价没有发生变化
D. 该过程的总反应速率由Ⅱ→Ⅲ步骤决定
12. 利用反应 ,可实现汽车尾气无害化处理。一定条件下进行该反应,测得CO的平衡转化率与温度、起始投料比 的关系如图所
示。下列说法正确的是
A. 该反应的
B. 投料比:
C. 汽车排气管中的催化剂可提高NO的平衡转化率
D. 若m=2,反应达平衡时,NO的转化率为40%,则 的体积分数为15.4%
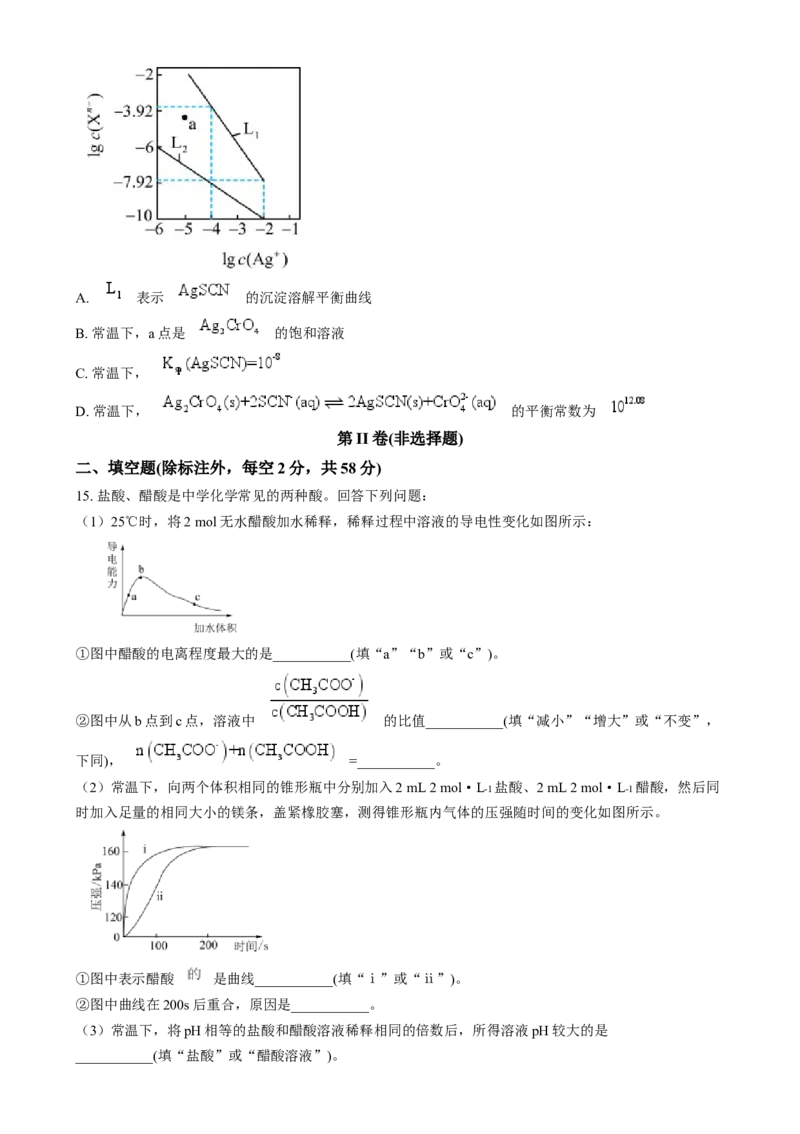
13. 已知1,3-丙二酸是二元弱酸(简记为 ),在 溶液中滴加
,混合溶液中含碳微粒的物质的量分数(分布系数)
与 关系如图所示。
下列叙述错误的是
A. 当 时,溶液呈酸性
B. 的水解常数
C. 时,
D. T点对应溶液 约为4.26
14. 常温下,用 溶液分别滴定 溶液、 溶液,所得的沉淀溶解平衡图像
如图所示,图中 为 或 。下列说法正确的是A. 表示 的沉淀溶解平衡曲线
B. 常温下,a点是 的饱和溶液
C. 常温下,
D. 常温下, 的平衡常数为
第II卷(非选择题)
二、填空题(除标注外,每空2分,共58分)
15. 盐酸、醋酸是中学化学常见的两种酸。回答下列问题:
(1)25℃时,将2 mol无水醋酸加水稀释,稀释过程中溶液的导电性变化如图所示:
①图中醋酸的电离程度最大的是___________(填“a”“b”或“c”)。
②图中从b点到c点,溶液中 的比值___________(填“减小”“增大”或“不变”,
下同), =___________。
(2)常温下,向两个体积相同的锥形瓶中分别加入2 mL 2 mol·L-1 盐酸、2 mL 2 mol·L-1 醋酸,然后同
时加入足量的相同大小的镁条,盖紧橡胶塞,测得锥形瓶内气体的压强随时间的变化如图所示。
①图中表示醋酸 是曲线___________(填“ⅰ”或“ⅱ”)。
②图中曲线在200s后重合,原因是___________。
(3)常温下,将pH相等的盐酸和醋酸溶液稀释相同的倍数后,所得溶液pH较大的是
___________(填“盐酸”或“醋酸溶液”)。(4)常温下,有pH均为3的CH3COOH、HCl两种物质的溶液,物质的量浓度较大的是___________溶
液。
(5)常温下,测得a mol·L-1 的CH3COOH溶液的pH=b,此温度下,CH3COOH的电离平衡常数
Ka=___________(用含a和b的代数式表示),向该CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数
Ka___________(填“增大”“减小”或“不变”)。
16. 草酸(H2C2O4 ,属于二元弱酸)在实验研究和化学工业中应用广泛。回答下列问题:
(1)下列能证明H2C2O4 为弱酸的方案是___________(填字母)。
A.室温下,取0.005 mol·L-1 的H2C2O4 溶液,测其pH>2
B.草酸能与碳酸钠溶液反应产生气泡
C.标准状况下,取100 mL 0.10 mol·L-1 H2C2O4 溶液与足量锌粉反应,产生224mL H2
(2)写出草酸的电离方程式:___________。
(3)如图是利用一定物质的量浓度的KMnO4 标准溶液滴定某未知浓度的草酸溶液的示意图和滴定前、后
盛放KMnO4 溶液的滴定管中液面的位置。已知滴定原理为
①仪器A的名称是___________。
②KMnO4 溶液的体积读数:滴定前读数为___________mL,滴定后读数为___________mL。
③对下列几种假定情况进行讨论:
测定结果的影响(填“偏高”“偏
假定情况
低”或“无影响”)
Ⅰ.若滴定前滴定管尖端有气泡,滴定后气泡消失 ________
Ⅱ.若滴定前锥形瓶未用待测液润洗 ________
Ⅲ.标准液读数时,若滴定前俯视,滴定后仰视 ________
(4)工业上利用硫酸亚铁与草酸反应制备草酸亚铁晶体,其离子方程式为
。利用氧化还原滴定法测定草酸亚铁晶体
(FeC2O4 ·xH2O)的x值,步骤如下:称取0.5400 g草酸亚铁晶体溶于一定浓度的硫酸中,用酸性KMnO4
溶液滴定,达到滴定终点时,消耗0.100 mol·L-1 的酸性KMnO4 溶液18.00 mL。已知:滴定过程中铁、
碳元素分别被氧化为Fe3+ 、CO2 ,锰元素被还原为Mn2+ ,x=___________(FeC2O4 的摩尔质量是144
g·mol-1)。
17. 某矿渣的成分为主要有 、还有 、Fe2O3 、 等杂质,工业上用该矿渣获取铜和胆矾的操作流程如下:
已知:① 。
②部分阳离子以氢氧化物形式沉淀时溶液的 如下表所示:
沉淀物
开始沉淀
5.4 4.0 2.7 5.8
6.7 5.2 3.7 8 8
沉淀完全
(1)为了加快反应的速率,可以采取的措施是___________(写两条)。
(2)固体混合物A中的成分是___________。
(3)反应I完成后,铁元素的存在形式为___________(填离子符号);用 调 ,X的
取值范围___________;用 调 ,Y的取值范围___________。
(4)操作1主要包括:___________、___________、过滤、洗涤。洗涤 粗产品不能用
大量水洗,而用冰水洗涤。原因 ___________。
(5)用 调 ,生成沉淀B的同时生成一种具有漂白作用的物质,利用题中所给信息分
析沉淀B为___________,该反应的离子方程式为___________。
18. 合成气( 、 )可由煤、天然气和生物质等非石油路线获得,由合成气制取甲醇是科研工
作者的研究热点。回答下列问题:
(1)已知:
则 ___________。
(2)在一恒温恒容的密闭容器中发生反应 ,下列说法不能说明该反
应达到化学平衡状态的是___________(填字母)。
A. 体系的压强保持不变 B. 混合气体的密度保持不变
C. D. 的浓度保持不变
(3)用合成气制甲醇的反应为 (假设不发生其他反应)。三个容器中起始时容积相同,维持恒温,控制条件如表:
编 条件控
号 制
维持恒
A 0.2 0.4 0
容
维持恒
B 0.4 0.8 0
容
C 维持恒压 0.4 0.8 0
达到平衡时,三个容器中甲醇的体积分数由大到小的顺序是___________(填编号)。
(4)在一定条件下,在容积恒定为 的密闭容器中充入 与 在催化剂作用
下合成甲醇: 。 转化率与温度、压强的关系如图所示:
①由图可知 ___________(填“>”“<”或“=”) 。
②图中b、c、d三点的化学平衡常数为 、 、 ,从大到小的顺序为___________。
③比较体系中气体平均摩尔质量: ___________(填“>”“<”或“=”) 。
④下列措施中能够同时满足增大正反应速率和提高 转化率的是___________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.再充入 与 D.不断将甲醇从体系混合物中分离出来