文档内容
白城市第一中学 2024-2025 学年度上学期开学测验化学试题
姓名:__________ 班级:__________ 考号:__________
一、单选题(共15小题)
1. 下列是从海藻灰和智利硝石矿层中提取碘的主要反应:
①2NaI+MnO +3H SO ===2NaHSO +MnSO +2H O+I
2 2 4 4 4 2 2
②2NaIO +5NaHSO ===2Na SO +3NaHSO +H O+I
3 3 2 4 4 2 2
下列说法正确的是( )
A. 氧化性:MnO >SO >IO >I
2 2
B. I 在反应①中是还原产物,在反应②中是氧化产物
2
C. 反应①②中生成等量的I 时转移电子数之比为1∶5
2
D. NaHSO 溶液呈酸性,则NaHSO 溶液中c(HSO )>c(H SO )>c(SO )
3 3 2 3
2. (2024届江西省赣州市期中联考)下列离子方程式能解释对应的实验事实的是( )
IO5I6H 3I 3H O
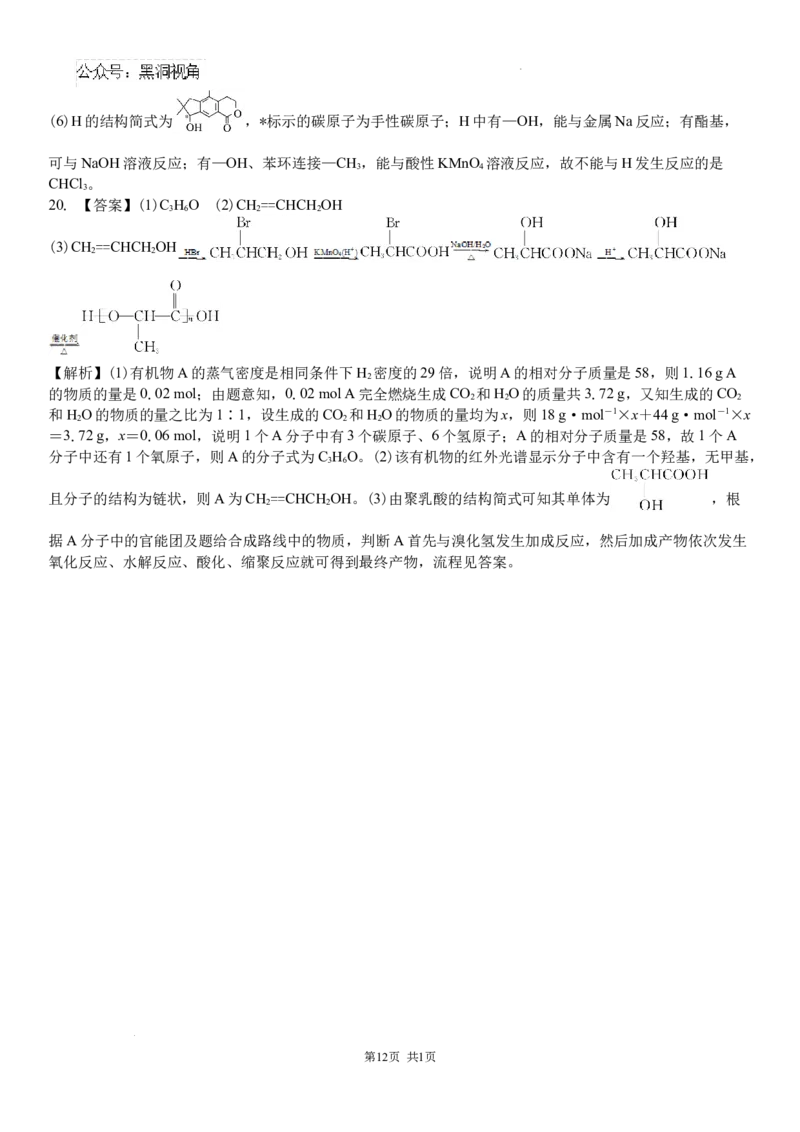
A. KI溶液滴入酸性 溶液中: 3 2 2
KIO
3
2BrCl Br 2Cl
B. 向溴化亚铁溶液中通入足量氯气: 2 2
SO H OClO HClOHSO
C. 将过量 通入NaClO溶液中: 2 2 3
SO
2
Ag2H NO Ag NO H O
D. 用稀硝酸洗涤做过银镜反应的试管: 3 2 2
3. 类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
A. 答案A B. 答案B C. 答案C D. 答案D
4. 葡萄糖在生物体内会发生分子内反应形成葡萄糖的半缩醛(如图所示),物质A和B分别为两种葡萄糖半
缩醛,下列说法正确的是( )
第1页 共1页
学科网(北京)股份有限公司A. 形成半缩醛时发生了取代反应 B. 葡萄糖半缩醛A和B的分子式均为C H O
6 10 6
C. 物质A分子不具有手性 D. 半缩醛的形成可看作羟基与醛基发生了加成反应
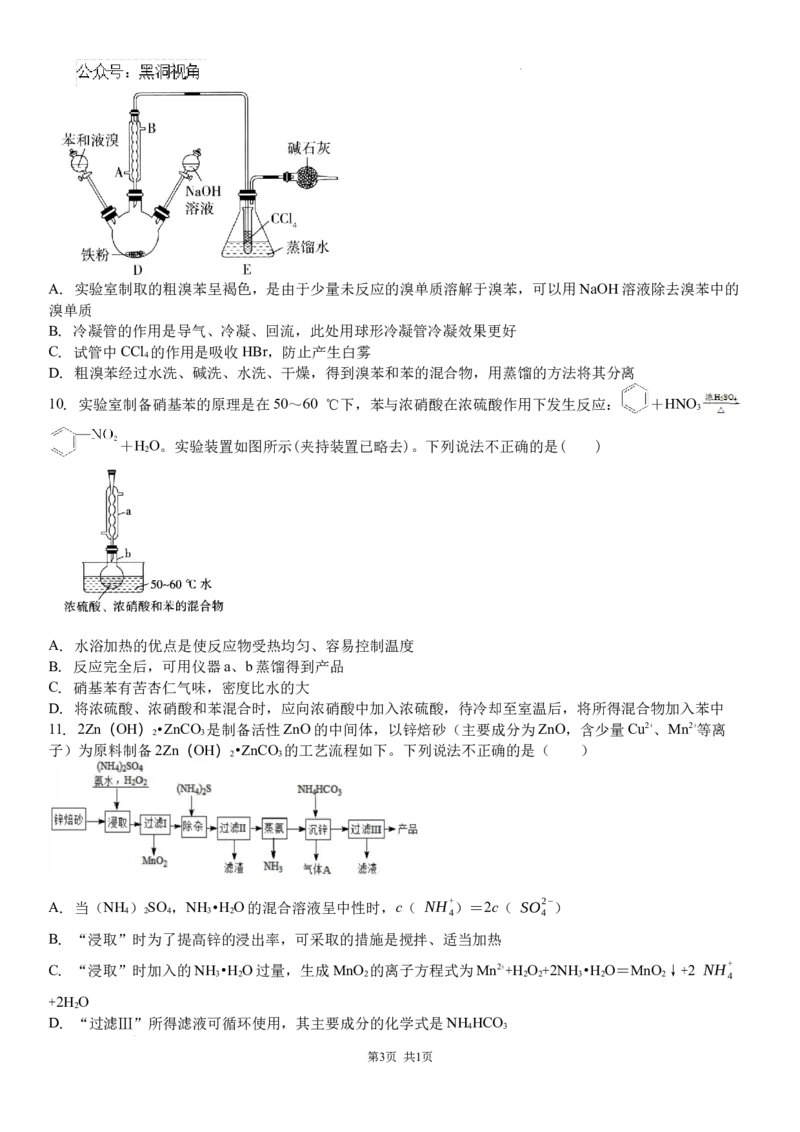
5. 已知青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于有机溶剂,如丙酮、氯仿,可溶于乙醇、乙醚等,
在水中几乎不溶,熔点为156~157 ℃,热稳定性差。乙醚的沸点为35 ℃。如图是从黄花青蒿中提取青蒿素
的工艺流程,下列有关实验操作的说法正确的是( )
A. 研碎时应该将黄花青蒿置于烧杯中
B. 操作Ⅰ是萃取,所用的玻璃仪器有烧杯、分液漏斗
C. 操作Ⅱ是蒸馏,所用的玻璃仪器主要有蒸馏烧瓶、酒精灯、冷凝管、温度计、锥形瓶等
D. 操作Ⅲ是用酒精灯加热,然后加水溶解、过滤
6. 某溶液中可能含有 K+、Na+、Mg2+、Cl-、 HCO−、 SO2−中的几种,且所含离子浓度均相等。为进一步
3 4
确定该溶液的组成,进行如下实验:
①取100 mL该溶液加入足量Ba(OH) 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88 g。
2
②向所得沉淀中加入过量的盐酸,还有2.33 g沉淀不溶解。
下列推测不正确的是( )
A. 4.88 g 沉淀中含有1.97g BaCO
3
B. 第②步实验共消耗0.02 mol HCl
C. 原溶液一定存在 SO2−、 HCO−、Mg2+
4 3
D. 在①所得滤液中加足量硝酸酸化的AgNO 溶液,可确定原溶液中是否同时含K+和Na+
3
7. 4-羟基戊酸( )在浓硫酸存在时加热,可得到分子式为C H O 的有机物,该有机
5 8 2
物不可能是( )
A. B. C. D.
8. 某溶液A可能含有Na+、Fe3+、Ba2+、 、Cl-、 、 、 中的几种离子,溶液中阳离子浓度相同。
为了确定其组成,进行如下实验(假设气体全部逸出,忽略H O 分解)
2 2
下列说法不正确的是( )
A. 溶液A中一定不存在Fe3+、 B. 气体1的成分可能是CO 或SO 或两者混合物
2 2
C. 溶液A中一定存在Cl-,且n(Cl-)=0.01 mol或0.02 mol D. 溶液A中肯定存在 、 、Ba2+、
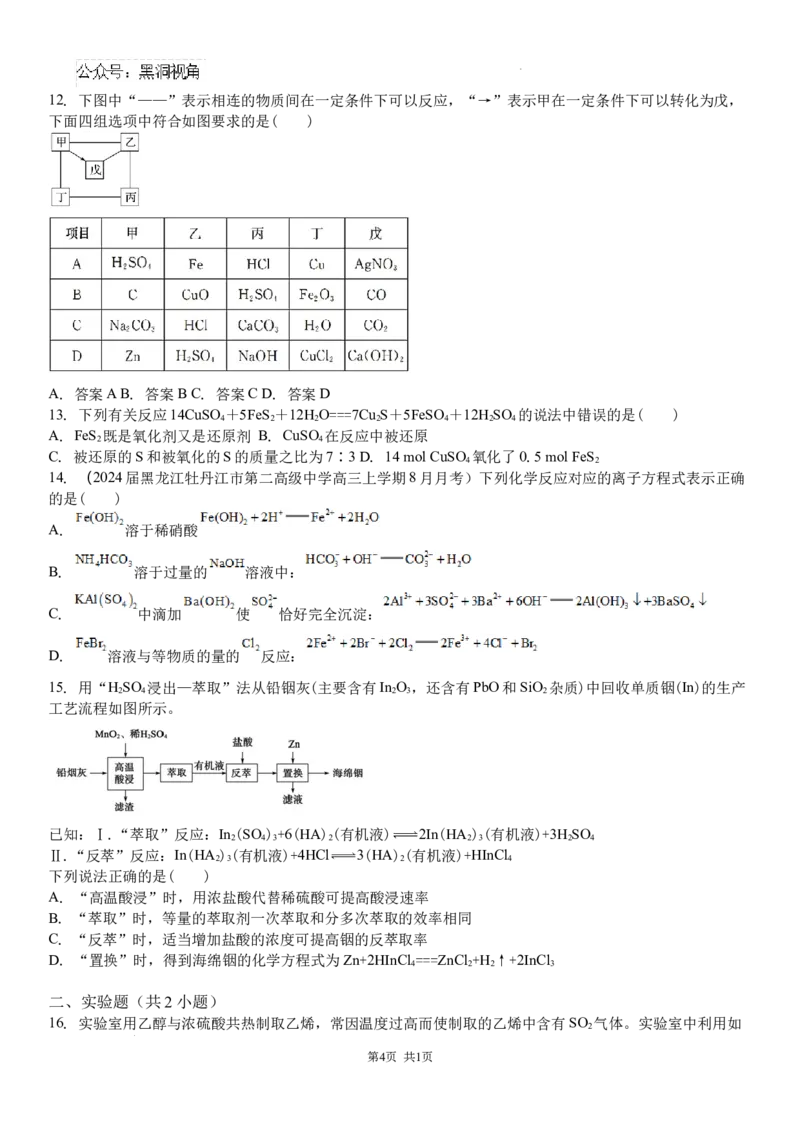
9. 如图为制取溴苯的实验装置(夹持装置已略去),下列有关现象的叙述和解释不正确的是( )
第2页 共1页
学科网(北京)股份有限公司A. 实验室制取的粗溴苯呈褐色,是由于少量未反应的溴单质溶解于溴苯,可以用NaOH溶液除去溴苯中的
溴单质
B. 冷凝管的作用是导气、冷凝、回流,此处用球形冷凝管冷凝效果更好
C. 试管中CCl 的作用是吸收HBr,防止产生白雾
4
D. 粗溴苯经过水洗、碱洗、水洗、干燥,得到溴苯和苯的混合物,用蒸馏的方法将其分离
10. 实验室制备硝基苯的原理是在50~60 ℃下,苯与浓硝酸在浓硫酸作用下发生反应: +HNO
3
+H O。实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
2
A. 水浴加热的优点是使反应物受热均匀、容易控制温度
B. 反应完全后,可用仪器a、b蒸馏得到产品
C. 硝基苯有苦杏仁气味,密度比水的大
D. 将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,将所得混合物加入苯中
11. 2Zn(OH) •ZnCO 是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离
2 3
子)为原料制备2Zn(OH) •ZnCO 的工艺流程如下。下列说法不正确的是( )
2 3
A. 当(NH ) SO ,NH •H O的混合溶液呈中性时,c( NH+ )=2c( SO2−)
4 2 4 3 2 4 4
B. “浸取”时为了提高锌的浸出率,可采取的措施是搅拌、适当加热
C. “浸取”时加入的NH •H O过量,生成MnO 的离子方程式为Mn2++H O +2NH •H O=MnO ↓+2 NH+
3 2 2 2 2 3 2 2 4
+2H O
2
D. “过滤Ⅲ”所得滤液可循环使用,其主要成分的化学式是NH HCO
4 3
第3页 共1页
学科网(北京)股份有限公司12. 下图中“——”表示相连的物质间在一定条件下可以反应,“→”表示甲在一定条件下可以转化为戊,
下面四组选项中符合如图要求的是( )
A. 答案A B. 答案B C. 答案C D. 答案D
13. 下列有关反应14CuSO +5FeS +12H O===7Cu S+5FeSO +12H SO 的说法中错误的是( )
4 2 2 2 4 2 4
A. FeS 既是氧化剂又是还原剂 B. CuSO 在反应中被还原
2 4
C. 被还原的S和被氧化的S的质量之比为7∶3 D. 14 mol CuSO 氧化了0.5 mol FeS
4 2
14. (2024届黑龙江牡丹江市第二高级中学高三上学期8月月考)下列化学反应对应的离子方程式表示正确
的是( )
A. 溶于稀硝酸
B. 溶于过量的 溶液中:
C. 中滴加 使 恰好完全沉淀:
D. 溶液与等物质的量的 反应:
15. 用“H SO 浸出—萃取”法从铅铟灰(主要含有In O ,还含有PbO和SiO 杂质)中回收单质铟(In)的生产
2 4 2 3 2
工艺流程如图所示。
已知:Ⅰ.“萃取”反应:In (SO ) +6(HA) (有机液) 2In(HA ) (有机液)+3H SO
2 4 3 2 2 3 2 4
Ⅱ.“反萃”反应:In(HA ) (有机液)+4HCl 3(HA) (有机液)+HInCl
2 3 2 4
下列说法正确的是( )
A. “高温酸浸”时,用浓盐酸代替稀硫酸可提高酸浸速率
B. “萃取”时,等量的萃取剂一次萃取和分多次萃取的效率相同
C. “反萃”时,适当增加盐酸的浓度可提高铟的反萃取率
D. “置换”时,得到海绵铟的化学方程式为Zn+2HInCl ===ZnCl +H ↑+2InCl
4 2 2 3
二、实验题(共2小题)
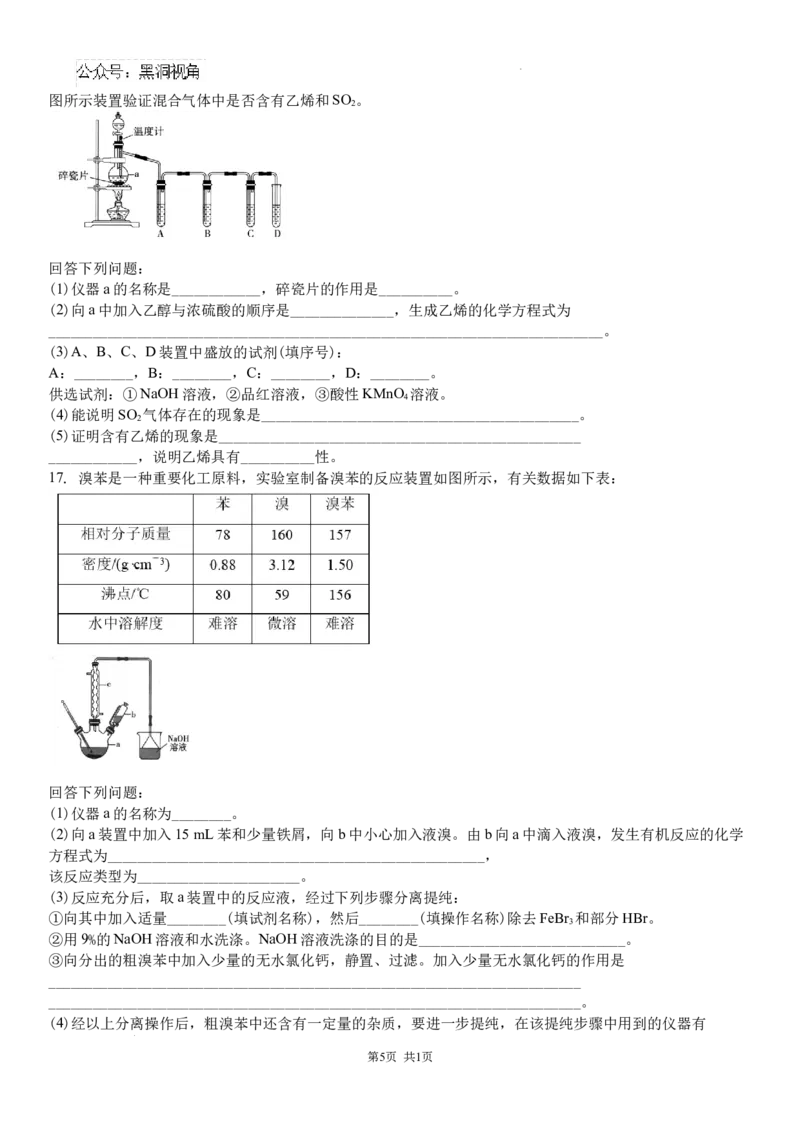
16. 实验室用乙醇与浓硫酸共热制取乙烯,常因温度过高而使制取的乙烯中含有SO 气体。实验室中利用如
2
第4页 共1页
学科网(北京)股份有限公司图所示装置验证混合气体中是否含有乙烯和SO 。
2
回答下列问题:
(1)仪器a的名称是____________,碎瓷片的作用是__________。
(2)向a中加入乙醇与浓硫酸的顺序是______________,生成乙烯的化学方程式为
___________________________________________________________________________。
(3)A、B、C、D装置中盛放的试剂(填序号):
A:________,B:________,C:________,D:________。
供选试剂:①NaOH溶液,②品红溶液,③酸性KMnO 溶液。
4
(4)能说明SO 气体存在的现象是___________________________________________。
2
(5)证明含有乙烯的现象是_________________________________________________
____________,说明乙烯具有__________性。
17. 溴苯是一种重要化工原料,实验室制备溴苯的反应装置如图所示,有关数据如下表:
回答下列问题:
(1)仪器a的名称为________。
(2)向a装置中加入15 mL苯和少量铁屑,向b中小心加入液溴。由b向a中滴入液溴,发生有机反应的化学
方程式为___________________________________________________,
该反应类型为______________________。
(3)反应充分后,取a装置中的反应液,经过下列步骤分离提纯:
①向其中加入适量________(填试剂名称),然后________(填操作名称)除去FeBr 和部分HBr。
3
②用9%的NaOH溶液和水洗涤。NaOH溶液洗涤的目的是____________________________。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入少量无水氯化钙的作用是
________________________________________________________________________
________________________________________________________________________。
(4)经以上分离操作后,粗溴苯中还含有一定量的杂质,要进一步提纯,在该提纯步骤中用到的仪器有
第5页 共1页
学科网(北京)股份有限公司________(填字母)。
(5)最终得到产品11 mL,本实验的产率是________(保留2位有效数字)。
三、推断题(共3小题)
18. (2024届吉林省长春市高三上学期11月期中考试)制造牙膏的常用摩擦剂有①CaCO 、②CaHPO 、
3 4
③SiO 、④Al(OH) 。某实验室设计两种工艺流程制取超细CaCO ,其原理如图所示。回答下列问题:
2 3 3
(1)上述摩擦剂属于盐的是___________(填化学式,下同),属于氧化物的是___________。
(2)气体A的化学式为___________,操作a的名称为___________。
(3)方案一“沉钙”时发生反应的化学方程式为____________________,由NaOH溶液得到NaOH固体的操作
为___________。
(4)方案二“酸浸”时发生反应的化学方程式为____________________。若生成44 g气体B,则消耗
___________g CaCO 。
3
19. 天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
已知:
回答下列问题:
(1)A的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结构:________________。
(2)在核磁共振氢谱中,化合物B有________________组吸收峰。
(3)化合物X的结构简式为_______________________________________________________。
(4)D→E的反应类型为______________________。
第6页 共1页
学科网(北京)股份有限公司(5)F的分子式为______________________,G所含官能团的名称为______________________。
(6)化合物H含有手性碳原子的数目为______________________,下列物质不能与H发生反应的是
________________(填序号)。
a.CHCl b.NaOH溶液
3
c.酸性KMnO 溶液 d.金属Na
4
(7)以 和 为原料,合成 ,在方框中写出路线流程图(无机试剂和不超过2
个碳的有机试剂任选)。
20. 某有机物A含有C、H、O三种元素,其蒸气密度是相同条件下H 密度的29倍,把1.16 g该有机物在
2
O 中完全燃烧,将生成物通过足量碱石灰,碱石灰增重3.72 g,又知生成的CO 和H O的物质的量之比为
2 2 2
1∶1。
回答下列问题:
(1)有机物A的分子式为______________。
(2)经红外光谱法测定,发现该分子中含有一个羟基,无甲基,且分子的结构为链状,请写出A的结构简式:
______________。
(3)已知聚乳酸 是一种很有前途的可降解高分子材料,可制成袋子替代日常生活中的
大部分塑料袋。请完成以有机物A为原料合成聚乳酸的路线(无机试剂任选)。
有机物A―→____________ ―→____________―→____________
第7页 共1页
学科网(北京)股份有限公司参考答案
1. 【答案】C
【解析】在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,故反应①中氧化性:MnO >I ,反应
2 2
②中氧化性:IO >SO ,A项错误;在反应①中,I元素的化合价升高,被氧化,I 为氧化产物,在反应②
2
中,I元素的化合价降低,被还原,I 为还原产物,B项错误;假设反应①②均生成1 mol I ,反应①转移2
2 2
mol电子,反应②转移10 mol电子,则转移电子数之比为1∶5,C项正确;NaHSO 溶液呈酸性,则HSO 的
3
电离程度大于其水解程度,所以c(HSO )>c(SO )>c(H SO ),D项错误。
2 3
2. 【答案】A
SO2
【解析】氯气足量,Br、Fe2均会被氧化,B项错误;ClO具有氧化性,可将SO 2 氧化为 4 ,C项错
误;稀硝酸与银反应生成NO气体,D项错误。
3. 【答案】D
【解析】将Na加入CuSO 溶液中,钠先与水反应生成氢氧化钠和H ,氢氧化钠再与硫酸铜发生复分解反应,
4 2
不能置换出铜,A错误;向Ca(ClO) 溶液中通入少量SO ,二氧化硫具有还原性,二者发生氧化还原反应,
2 2
不可能生成CaSO 沉淀,应该生成CaSO 沉淀,B错误;用惰性电极电解MgBr 溶液,阴极产物OH-与
3 4 2
Mg2+不能共存,生成Mg(OH) 沉淀。离子方程式为Mg2++2Br-+2H O Mg(OH) ↓+H ↑+Br ,C错误。
2 2 2 2 2
4. 【答案】D
【解析】形成半缩醛时,可以看成醇羟基与醛基发生了分子内的加成反应,葡萄糖和A、B的分子式均为
C H O ,三者互为同分异构体,A、B错误,D正确;物质A的1个分子中含有5个手性碳原子,具有手性,
6 12 6
C错误。
5. 【答案】C
【解析】根据题组流程可知,对黄花青蒿进行干燥、研碎,可以增大黄花青蒿与乙醚的接触面积,提高青蒿
素的浸取率;用乙醚对固体粉末进行浸取后,过滤,可得提取液和残渣;提取液经过蒸馏后可得青蒿素的粗
品;向粗品中加入乙醇,浓缩、结晶、过滤可得精品,据此解答。研碎时应该将黄花青蒿置于研钵中进行,
选项A错误;由上述分析可知,操作Ⅰ是将固体和液体分离的操作,是过滤,选项B错误;操作Ⅱ是将提取
液中的乙醚分离出去的操作,是蒸馏,蒸馏用到的玻璃仪器主要有蒸馏烧瓶、酒精灯、冷凝管、温度计、锥
形瓶等,选项C正确;酒精灯加热温度较高,青蒿素热稳定性差,由粗品得精品时不能用酒精灯加热,且青
蒿素在水中基本不溶,选项D错误。
6. 【答案】B
【解析】由分析可知,BaCO 的物质的量是0.01 mol,m=n·M=0.01 mol×197 g/mol=1.97g,A正确;由分
3
析可知,消耗的盐酸为0.04 mol,B错误;由沉淀可推知,一定含有 SO2−、 HCO−、Mg2+,C正确;K+和
4 3
Na+至少含一种,可能含有Cl-,可通过加入足量硝酸酸化的AgNO 溶液验证,如原溶液中含Cl-,根据溶液呈
3
电中性知,则同时含K+和Na+,否则只有其中一种,D正确。
7. 【答案】C
【解析】4-羟基戊酸在浓硫酸、加热时,可能发生羟基的消去反应生成 或 ;4-羟基
戊酸在浓硫酸、加热时,可能发生分子内的酯化反应生成 ,不可能生成 。
8. 【答案】B
【解析】①H O 具有强氧化性,溶液A中加入盐酸酸化的H O 生成的沉淀为BaSO ,物质的量为n=
2 2 2 2 4
m 2.33g
= =0.01 mol,根据元素守恒,则原溶液中含有0.01 mol Ba2+、0.01 mol ,根据离子共存
M 233g/mol
第8页 共1页
学科网(北京)股份有限公司原则,没有Fe3+和 ;
V 0.224L
②溶液A中加入足量的盐酸生成的224 mL标准状况下的气体为CO ,物质的量为n= =
2 V 22.4L/mol
m
=0.01 mol,则原溶液中含有0.01 mol ;
m 0.17g
③溶液1中加入过量Ba(OH) 溶液,加热生成的0.17 g气体2为NH ,物质的量为n= =
2 3 M 17g/mol
=0.01 mol,则原溶液中含有0.01 mol ;
④溶液不显电性,则原溶液中一定含有Cl-,不能确定的离子为Na+,由于溶液中阳离子浓度相同,可能含有
0.01 mol Na+,则n(Cl-)=0.01 mol或0.02 mol,
综上可知:原溶液中一定含有0.01mol Ba2+、0.01mol 、0.01 mol 、0.01 mol 、0.01 mol或
0.02 mol Cl-;可能含有0.01 mol Na+;一定没有Fe3+、 ;
A.由以上分析可知,溶液A中含有0.01molBa2+、0.01mol ,根据离子共存推断:溶液A中一定不存在
Fe3+、 ,故A正确;
B.溶液A中加入足量盐酸酸化的H O 溶液,则气体1的成分是CO ,不含有SO ,故B错误;
2 2 2 2
C.原溶液中一定含有0.01molBa2+、0.01mol 、0.01mol 、0.01 mol 和0.01 mol或0.02 mol
Cl-,可能含有0.01 mol Na+:①若不含有Na+,则n(Cl-)=0.01 mol;②若含有0.01 mol Na+,则n(Cl-)
=0.02 mol,即液A中一定存在Cl-,且n(Cl-)=0.01 mol或0.02 mol,故C正确;
D.由以上分析可知,溶液A中一定含有0.01 mol Ba2+、0.01 mol 、0.01 mol 、0.01 mol 、
0.01 mol或0.02 mol Cl-,故D正确;
9. 【答案】C
【解析】溴苯是无色液体,溴苯中因溶有溴单质而呈褐色,溴单质可以和氢氧化钠溶液反应,可用NaOH溶
液除去溴苯中的溴单质,A项正确;冷凝管的作用是导气、冷凝、回流,直形冷凝管常用于蒸馏装置,此处
用球形冷凝管效果更好,B项正确;HBr难溶于CCl ,试管中CCl 不能用于吸收HBr,C项错误;粗溴苯经
4 4
过水洗、碱洗、水洗、干燥,得到溴苯和苯的混合物,用蒸馏的方法可将溴苯和苯分离,D项正确。
10. 【答案】B
【解析】水浴加热的优点为反应物受热均匀、容易控制温度,A正确;反应完全后,溶液分层,应选分液漏
斗分离,粗产品用蒸馏烧瓶(不用圆底烧瓶)和直形冷凝管蒸馏得到硝基苯,B错误;硝基苯有苦杏仁气味,
密度比水的大,C正确;混合时要使热量及时散失,防止苯挥发,由于浓硫酸的密度大于浓硝酸,为避免液
体迸溅,应向浓硝酸中加入浓硫酸,待冷却后,将所得的混合物加入苯中,D正确。
11. 【答案】D
【解析】A.(NH ) SO 与NH •H O的混合溶液中存在电荷守恒:c( NH+ )+c(H+)=2c( SO2−)+c
4 2 4 3 2 4 4
(OH﹣),溶液显中性的,c(H+)=c(OH﹣),所以c( NH+ )=2c( SO2−),故A正确;B.搅拌可
4 4
增大接触面积,增大反应速率;适当加热,可增大反应速率,故B正确;C.“浸取”时加入的NH •H O过
3 2
量,溶液呈碱性,双氧水将锰离子氧化成MnO ,反应的离子方程式为Mn2++H O +2NH •H O===MnO ↓+2
2 2 2 3 2 2
NH+
+2H O,故C正确;D.“过滤Ⅲ”所得滤液为硫酸铵溶液,可循环使用,其化学式为(NH ) SO ,故
4 2 4 2 4
D错误。
12. 【答案】B
【解析】HCl与Cu不反应,H SO 与Fe不能一步转化为AgNO ,A错误;CaCO 与H O不反应,C错误;
2 4 3 3 2
Zn 、H SO 不能一步转化为Ca(OH) ,D错误。
3 2 4 2
13. 【答案】D
【解析】化学方程式中的化合价变化:CuSO 中+2价的Cu得电子,化合价降低为Cu S中+1价的Cu;5个
4 2
FeS 中10个-1价的S有7个化合价降低为Cu S中-2价的S,有3个化合价升高为SO 中+6价的S(生成
2 2
第9页 共1页
学科网(北京)股份有限公司物中有17个SO ,其中有14个来自反应物CuSO )。反应中FeS 中S的化合价有升高有降低,因此FeS 既
4 2 2
是氧化剂又是还原剂,选项A正确;硫酸铜中Cu元素的化合价都降低,S、O元素的化合价不变,所以硫酸
铜是氧化剂,选项B正确;10个-1价的S有7个化合价降低,有3个化合价升高,所以被还原的S和被氧
化的S的质量之比为7∶3,选项C正确;14 mol CuSO 在反应中得到14 mol电子,FeS 被氧化时,应该是-
4 2
1价的S被氧化为+6价,所以1个FeS 会失去14个电子;根据得失电子守恒,14 mol CuSO 应该氧化1 mol
2 4
FeS ,选项D错误。
2
14. 【答案】D
【解析】A.硝酸具有氧化性,将 氧化成 ,正确的离子方程式为
,故A错误;B. 溶于水后,其电离出的 、 均能
与 反应,因此该离子反应方程式为 ,故B错误;C.设
溶液中溶质为 ,向溶液中滴加 使 恰好完全沉淀,则需要加入 ,所加
入的 的物质的量为 , 先与 反应生成 ,后 恰好与 完全反应,因此该离子方
程式为 ,故C错误;D.因还原性: ,因此 先
与 反应,再与 反应,设 的物质的量为 ,则 完全反应消耗 ,余下 与
反应,其离子方程式为 ,故D正确;故选D。
15. 【答案】C
【解析】A.二氧化锰与浓盐酸加热生成氯气,且高温会使HCl挥发造成损失,不能提高酸浸速率,A错误;
B.每一次萃取都是按照一定比例进行的溶质分配,所以多次萃取的效率更高,B错误;C.“反萃”时,适
当增加盐酸的浓度,平衡In(HA ) (有机液)+4HCl 3(HA) (有机液)+HInCl 正向移动,可提高铟的反萃取
2 3 2 4
率,C正确;D.“置换”时锌与HInCl 反应产生In单质而不是氢气,发生反应的化学方程式为
4
3Zn+2HInCl ===2In+3ZnCl +2HCl,D错误。
4 2
16. 【答案】(1)蒸馏烧瓶 防止暴沸
(2)先加乙醇后加浓硫酸 CH CH OH CH ==CH ↑+H O (3)② ① ② ③
3 2 2 2 2
(4)A中品红溶液褪色
(5)装置C中的品红溶液不褪色,D中的酸性高锰酸钾溶液褪色 还原
【解析】(1)装置中a仪器为蒸馏烧瓶;实验室制取乙烯用乙醇与浓硫酸共热,因液体加热时易暴沸,所以加
碎瓷片。(2)浓硫酸稀释会释放大量的热,为防止液体飞溅,在蒸馏烧瓶中先加乙醇后加浓硫酸;实验室利用
乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯。
(3)检验二氧化硫用品红溶液,检验乙烯可用酸性高锰酸钾溶液,乙烯和二氧化硫都能使酸性高锰酸钾溶液褪
色,所以先检验二氧化硫,然后检验乙烯。故装置A用来检验SO ,试管中品红溶液褪色,说明含有SO ,
2 2
装置B用来除去SO ,装置C中的品红溶液不褪色可确认SO 已除净,装置D中的酸性高锰酸钾溶液褪色证
2 2
明含有乙烯。
17. 【答案】(1)三颈烧瓶
(2) +Br +HBr↑ 取代反应
2
(3)①水 分液 ②除去未反应的Br 和剩余的HBr ③除去产品中残留的水 (4)bcf (5)62%
2
【解析】苯与溴在FeBr 作催化剂的条件下发生取代反应生成溴苯、HBr,装置a为反应装置,该反应为放热
3
反应,溴单质、苯易挥发,因此利用装置c进行冷凝回流,使其充分反应,HBr为有毒气体,直接排放会污
染空气,利用氢氧化钠溶液吸收。a中未反应的Fe可用过滤的方法除去,未反应的溴和未挥发的HBr用
NaOH溶液吸收,然后用无水氯化钙除去水,最后蒸馏除去残留的苯,据此解答。(4)溴苯与苯互溶,根据表
第10页 共1页
学科网(北京)股份有限公司格数据可知,二者的沸点差异较大,因此用蒸馏法分离,故需酒精灯、蒸馏烧瓶、直形冷凝管等。(5)最终得
到产品11 mL,实际生成溴苯的物质的量为 mol≈0.105 mol,15 mL苯的物质的量为
mol≈0.169 mol,理论上生成溴苯的物质的量等于苯的物质的量,则溴苯的产率为 ×100%≈62%。
18. 【答案】(1).CaCO 、CaHPO SiO
3 4 2
(2).CO 过滤
2
(3).Ca(OH) +Na CO =CaCO ↓+2NaOH 蒸发结晶
2 2 3 3
(4).CaCO +2HCl=CaCl +CO ↑+H O 100
3 2 2 2
【解析】(1)上述摩擦剂属于盐的是CaCO 、CaHPO ,属于氧化物的是SiO ;
3 4 2
(2)由分析可知,气体A的化学式为CO ;操作a的名称为过滤;
2
(3)方案一“沉钙”时是氢氧化钙溶液中加入碳酸钠使其沉淀,生成的碳酸钙和氢氧化钠,化学方程式为:
Ca(OH) +Na CO =CaCO ↓+2NaOH;由NaOH溶液得到NaOH固体的操作为蒸发结晶;
2 2 3 3
(4)方案二“酸浸”是石灰石与盐酸反应,生成氯化钙、水和CO ,化学方程式为:CaCO +2HCl=CaCl +
2 3 2
44 g100
= =
CO ↑+H O;气体B为CO ,若生成44 g CO ,则消耗CaCO 的质量 44 100 g。
2 2 2 2 3
19. 【答案】(1)H C==CHCH CHO、 、 、
2 2
(2)4
(3)
(4)加成反应
(5)C H O 羰基、酯基
13 12 3
(6)1 a
(7)
【解析】(1)A( )的链状同分异构体可发生银镜反应,则结构中必须有—CHO,可能的结构有
H C==CHCH CHO、 ,考虑顺反异构有 、 。
2 2
(2)B的结构简式为H C—C≡C—CH —CH —OH,则核磁共振氢谱中有4种不同化学环境的氢原子,即有4
3 2 2
组吸收峰。
(3)根据流程图中C+X―→D知,C中的—OH与X反应生成D中的酯基,则X中有—COOH,所以X为
。
(4)结合题给已知信息与流程图可知,D―→E的反应类型为加成反应。
(5)F的结构简式为 ,其分子式为C H O ;由G的结构简式可知,G所含官能团的名称为羰基、酯
13 12 3
基。
第11页 共1页
学科网(北京)股份有限公司(6)H的结构简式为 ,*标示的碳原子为手性碳原子;H中有—OH,能与金属Na反应;有酯基,
可与NaOH溶液反应;有—OH、苯环连接—CH ,能与酸性KMnO 溶液反应,故不能与H发生反应的是
3 4
CHCl 。
3
20. 【答案】(1)C H O (2)CH ==CHCH OH
3 6 2 2
(3)CH ==CHCH OH
2 2
【解析】(1)有机物A的蒸气密度是相同条件下H 密度的29倍,说明A的相对分子质量是58,则1.16 g A
2
的物质的量是0.02 mol;由题意知,0.02 mol A完全燃烧生成CO 和H O的质量共3.72 g,又知生成的CO
2 2 2
和H O的物质的量之比为1∶1,设生成的CO 和H O的物质的量均为x,则18 g·mol-1×x+44 g·mol-1×x
2 2 2
=3.72 g,x=0.06 mol,说明1个A分子中有3个碳原子、6个氢原子;A的相对分子质量是58,故1个A
分子中还有1个氧原子,则A的分子式为C H O。(2)该有机物的红外光谱显示分子中含有一个羟基,无甲基,
3 6
且分子的结构为链状,则A为CH ==CHCH OH。(3)由聚乳酸的结构简式可知其单体为 ,根
2 2
据A分子中的官能团及题给合成路线中的物质,判断A首先与溴化氢发生加成反应,然后加成产物依次发生
氧化反应、水解反应、酸化、缩聚反应就可得到最终产物,流程见答案。
第12页 共1页
学科网(北京)股份有限公司