文档内容
东莞实验中学 2024-2025 学年第二学期第一次段考
高二年级化学
注意事项:
1.答卷前,考生务必用黑色字迹钢笔或签字笔将自己的姓名、考生号、考场号和座位号填写在答题
卡上。用2B铅笔将试卷类型(A)填涂在答题卡相应位置上。
2.作答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑;如需
改动,用橡皮擦干净后,再选涂其他答案。
3.非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置
上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。不按以上要
求作答的答案无效。
4.考生必须保持答题卡整洁。考试结束后,只需将答题卡交回。
可能用到的相对原子质量: H-1 C-12 N-14 O-16 K-39 Fe-56 Se-79
一、选择题:本题共16小题,共44分。其中1-10题每小题2分,共20分。11-16题每小题
4分,共24分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列现象与电子的跃迁没有直接关联的是
A.氢原子发光 B.霓虹灯发光 C.燃放烟花 D.钠与水剧烈反应
2.下列化学用语正确的是
A.基态Cr的核外电子排布式:[Ar]3d54s1
B.3p电子的电子云轮廓图:
C.SO 的VSEPR模型:
2
D.NCl 分子中N原子杂化方式为sp2杂化
3
3.按官能团分类,下列属于羧酸的是
A. B. C. D.
4.下列各物质的晶体中,晶体类型相同的是
A.CO 和SiO B.NaCl和HCl C.CO 和CS D.CCl 和MgCl
2 2 2 2 4 25.下列分离方法不正确的是
A.用重结晶法提纯含有少量NaCl的苯甲酸粗品
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.用分液漏斗分离汽油和植物油
6.膦(PH )又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常
3
含有磷化氢。以下关于PH 的叙述不正确的是
3
A.PH 分子中有未成键的孤对电子 B.PH 是极性分子
3 3
C.它的分子构型是三角锥形 D.磷原子采用sp2杂化方式
7.下列各组元素的性质正确的是
A.第一电离能:Al>Mg>Na B.电负性:F>O>N
C.最高正价:F>S>Si D.原子半径:P>N>C
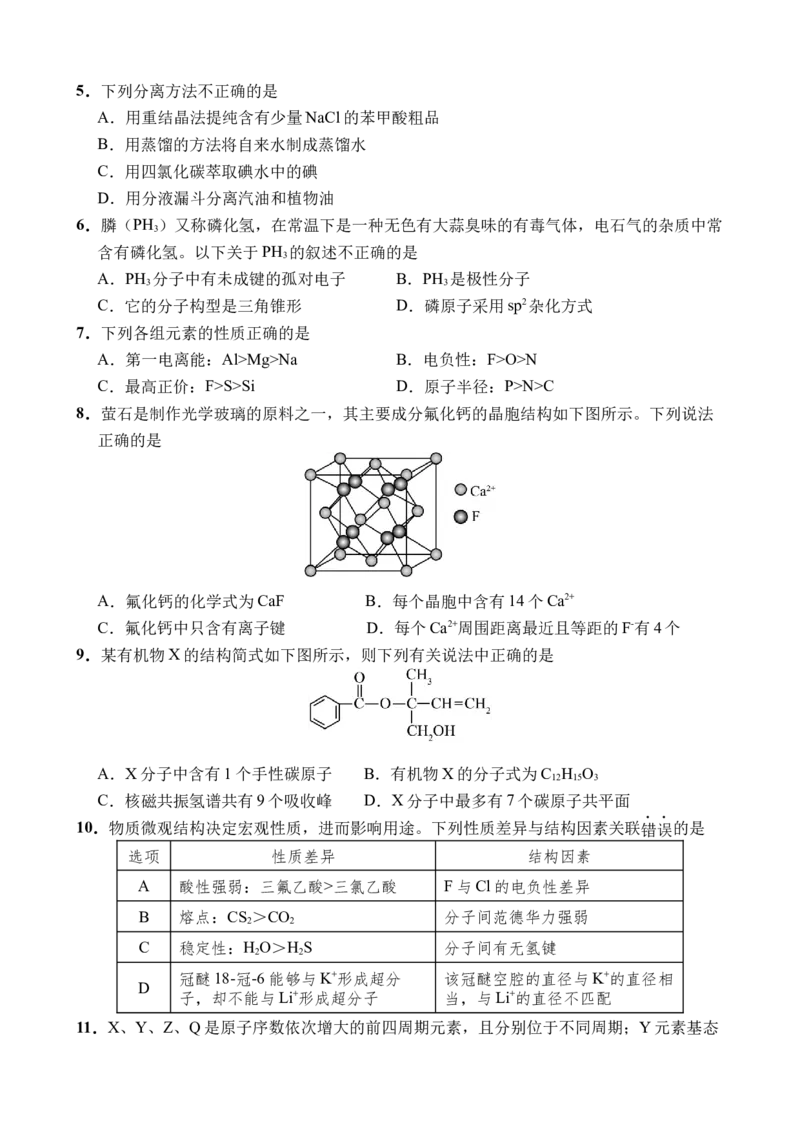
8.萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如下图所示。下列说法
正确的是
A.氟化钙的化学式为CaF B.每个晶胞中含有14个Ca2+
C.氟化钙中只含有离子键 D.每个Ca2+周围距离最近且等距的F-有4个
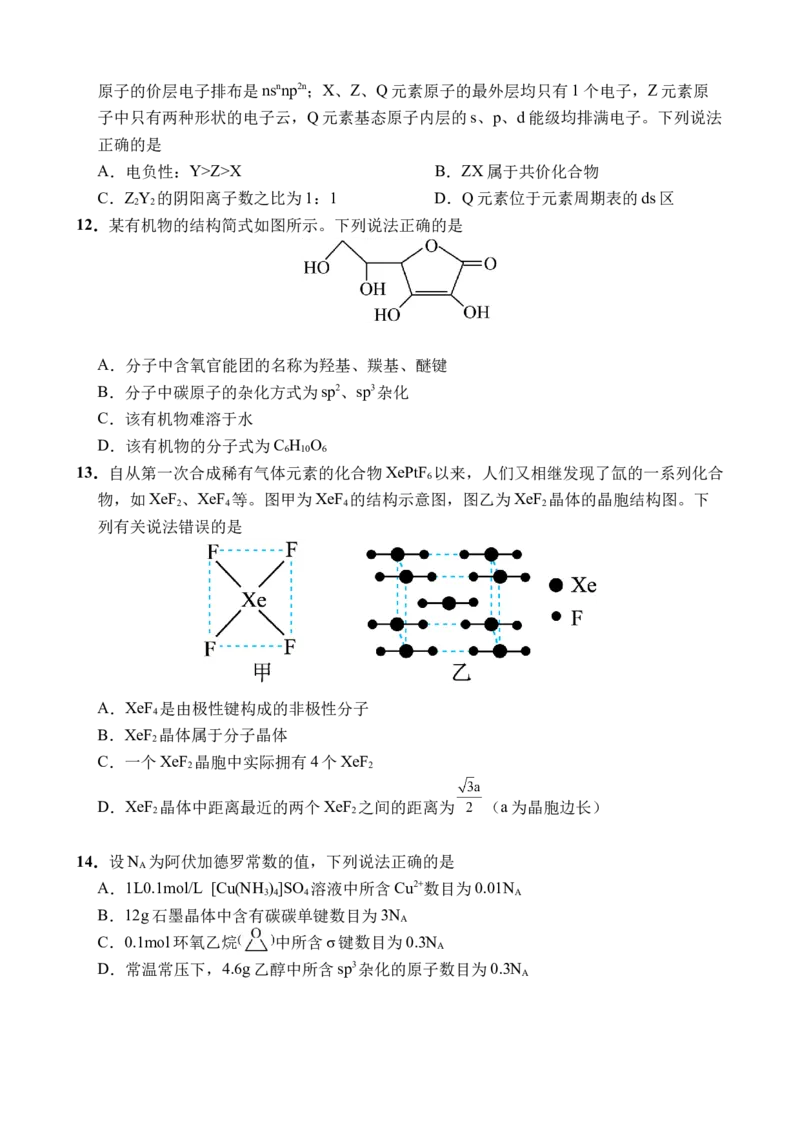
9.某有机物X的结构简式如下图所示,则下列有关说法中正确的是
A.X分子中含有1个手性碳原子 B.有机物X的分子式为C H O
12 15 3
C.核磁共振氢谱共有9个吸收峰 D.X分子中最多有7个碳原子共平面
10.物质微观结构决定宏观性质,进而影响用途。下列性质差异与结构因素关联错误的是
选项 性质差异 结构因素
A 酸性强弱:三氟乙酸>三氯乙酸 F与Cl的电负性差异
B 熔点:CS >CO 分子间范德华力强弱
2 2
C 稳定性:H O>H S 分子间有无氢键
2 2
冠醚18-冠-6能够与K+形成超分 该冠醚空腔的直径与K+的直径相
D
子,却不能与Li+形成超分子 当,与Li+的直径不匹配
11.X、Y、Z、Q是原子序数依次增大的前四周期元素,且分别位于不同周期;Y元素基态原子的价层电子排布是nsnnp2n;X、Z、Q元素原子的最外层均只有1个电子,Z元素原
子中只有两种形状的电子云,Q元素基态原子内层的s、p、d能级均排满电子。下列说法
正确的是
A.电负性:Y>Z>X B.ZX属于共价化合物
C.Z Y 的阴阳离子数之比为1:1 D.Q元素位于元素周期表的ds区
2 2
12.某有机物的结构简式如图所示。下列说法正确的是
A.分子中含氧官能团的名称为羟基、羰基、醚键
B.分子中碳原子的杂化方式为sp2、sp3杂化
C.该有机物难溶于水
D.该有机物的分子式为C H O
6 10 6
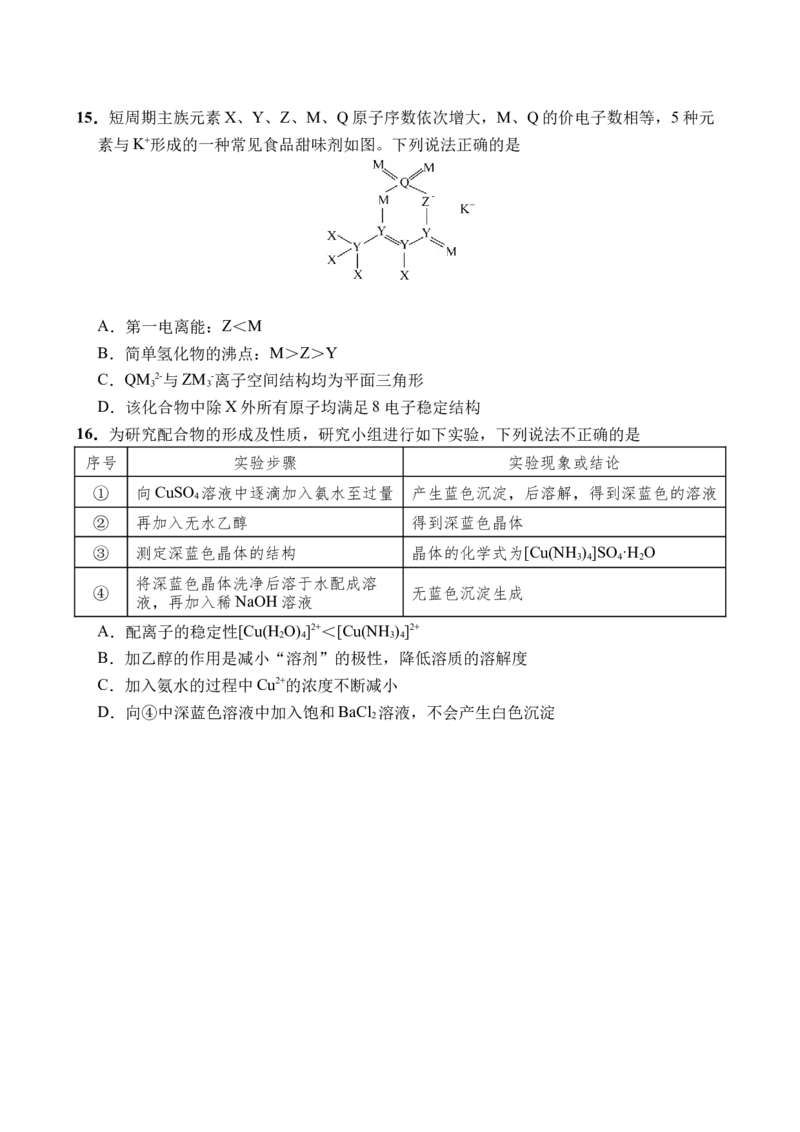
13.自从第一次合成稀有气体元素的化合物XePtF 以来,人们又相继发现了氙的一系列化合
6
物,如XeF 、XeF 等。图甲为XeF 的结构示意图,图乙为XeF 晶体的晶胞结构图。下
2 4 4 2
列有关说法错误的是
A.XeF 是由极性键构成的非极性分子
4
B.XeF 晶体属于分子晶体
2
C.一个XeF 晶胞中实际拥有4个XeF
2 2
D.XeF 晶体中距离最近的两个XeF 之间的距离为 (a为晶胞边长)
2 2
14.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.1L0.1mol/L [Cu(NH ) ]SO 溶液中所含Cu2+数目为0.01N
3 4 4 A
B.12g石墨晶体中含有碳碳单键数目为3N
A
C.0.1mol环氧乙烷 中所含σ键数目为0.3N
A
D.常温常压下,4.6g乙醇中所含sp3杂化的原子数目为0.3N
A15.短周期主族元素X、Y、Z、M、Q原子序数依次增大,M、Q的价电子数相等,5种元
素与K+形成的一种常见食品甜味剂如图。下列说法正确的是
A.第一电离能:Z<M
B.简单氢化物的沸点:M>Z>Y
C.QM 2-与ZM -离子空间结构均为平面三角形
3 3
D.该化合物中除X外所有原子均满足8电子稳定结构
16.为研究配合物的形成及性质,研究小组进行如下实验,下列说法不正确的是
序号 实验步骤 实验现象或结论
① 向CuSO 溶液中逐滴加入氨水至过量 产生蓝色沉淀,后溶解,得到深蓝色的溶液
4
② 再加入无水乙醇 得到深蓝色晶体
③ 测定深蓝色晶体的结构 晶体的化学式为[Cu(NH ) ]SO ·H O
3 4 4 2
将深蓝色晶体洗净后溶于水配成溶
④ 无蓝色沉淀生成
液,再加入稀NaOH溶液
A.配离子的稳定性[Cu(H O) ]2+<[Cu(NH ) ]2+
2 4 3 4
B.加乙醇的作用是减小“溶剂”的极性,降低溶质的溶解度
C.加入氨水的过程中Cu2+的浓度不断减小
D.向④中深蓝色溶液中加入饱和BaCl 溶液,不会产生白色沉淀
2二、填空题:本题共4小题,共56分。
17.根据已学知识,请回答下列问题:
(1)物质A的结构简式为 ,写出A中的含氧官能团名称
。
(2)键线式 表示的有机物的分子式为 ,其中等效氢个数比为
。
(3)与 具有相同官能团的一种同分异构体的结构简式为 。
(4)醛基的结构简式为 ,氨基的结构简式为 。
(5)实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示。
写出下列仪器的名称:① ,② 。①的进水口是 (填“f”或
“g”)。
18.合成氨是人类科学技术发展史上的一项重大成就,是化学和技术对社会发展与进步的巨
大贡献。请回答下列问题:
(1)自然界中的氮元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态N
原子的未成对电子个数为 ,占据最高能级的电子的电子云轮廓图为
形。
(2)铁触媒是以铁为主体的多成分催化剂,通常还含有Al O 、K O、MgO、Cr O 等氧化
2 3 2 2 3
物。
①上述氧化物所涉及的元素中,处于元素周期表中d区的元素是 (填元素符
号)。
②第一电离能:O N(填“>”“<”或“=”),原因是
。
(3)我国科研人员研制出了“Fe-LiH”作催化剂,温度、压强,由450℃、20MPa左右降到
了350℃、1MPa左右,这是近年来对合成氨反应研究中心的重要突破。①铁(Fe)在元素周期表中的位置为 ,基态Fe原子的核外电子排布式为
。
②Li+与H-的半径大小关系:r(Li+) r(H-)(填“>”或“<”)。
19.GaN是制造芯片的新型半导体材料。回答下列问题:
(1)镓为第四周期元素,基态Ga原子的简化核外电子排布式为[Ar] 。
(2)N、Si、P的电负性由强到弱的顺序为 (元素符号表示,下
同);
(3)芯片制造中用到光刻胶,可由甲基丙烯酸甲酯( )、马来酸酐(
)等通过加聚反应制得。甲基丙烯酸甲酯中碳原子的轨道杂化类型为
,马来酸酐分子中, 键和 键个数比为 。
(4)GaN、GaP、GaAs的结构类似于金刚石,熔点如表所示:
物质 GaN GaP GaAs
熔点/℃ 1700 1480 1238
试分析三者熔点变化的原因: 。
(5)GaAs的晶胞结构如图所示(白球是Ga,黑球是As)。图甲中,与Ga原子紧邻的As
原子有 个。20.天津大学杨全红、吴士超团队报告了一种脱碳-氟化策略,通过在60℃下Li CO 与
2 3
LiPF 原位转化成LiF等物质,界面的氟化有效地抑制了寄生反应,大大降低了界面电
6
阻,显著提高了电池倍率性能和循环稳定性。请回答下列问题:
(1)基态P原子的价层电子轨道表示式为 。如图为F原子基态和激发态的核外
电子的轨道表示式,其中属于激发态且发生电子跃迁回到基态时释放能量最多的是
(填字母)。
A.
B.
C.
D.
(2)LiF晶体类型与NaCl相同,但LiF熔点更高,原因是
。
(3)Li CO 中阴离子的空间构型为 。
2 3
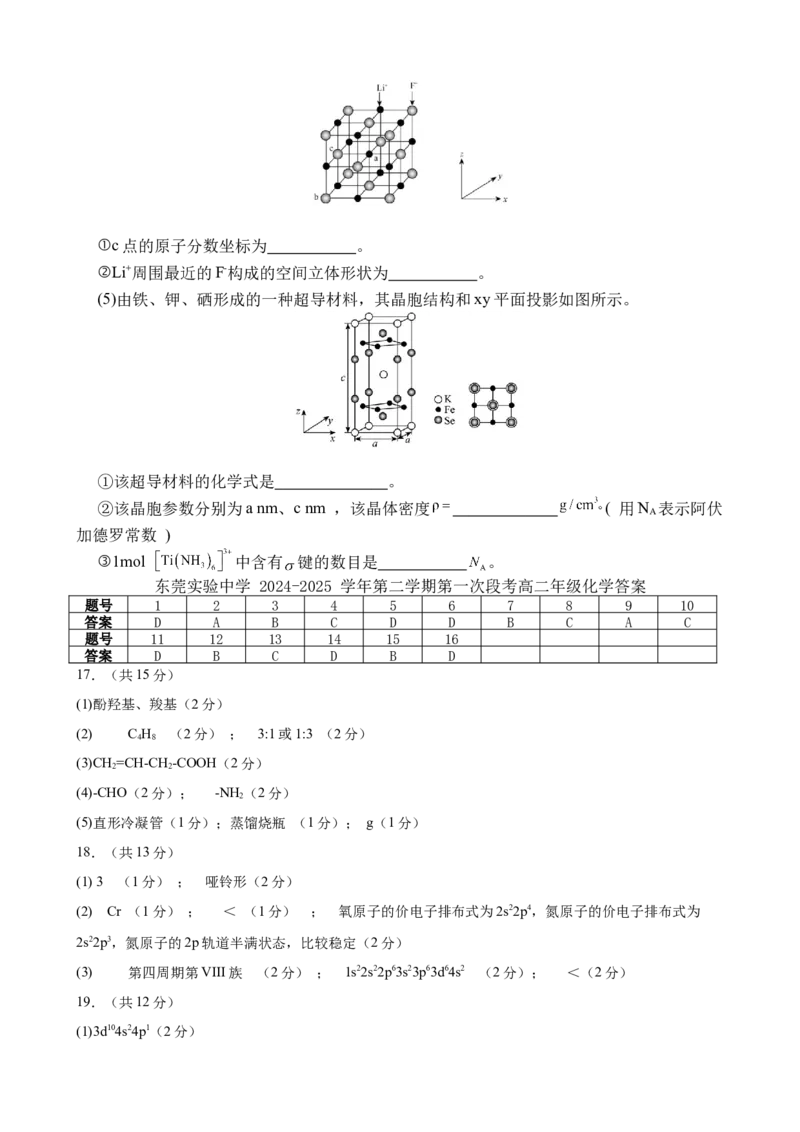
(4)LiF的晶胞结构如图所示,已知a点和b点的原子分数坐标分别为( )、(0,0,
0),①c点的原子分数坐标为 。
②Li+周围最近的F-构成的空间立体形状为 。
(5)由铁、钾、硒形成的一种超导材料,其晶胞结构和xy平面投影如图所示。
①该超导材料的化学式是 。
②该晶胞参数分别为a nm、c nm ,该晶体密度 ( 用N 表示阿伏
A
加德罗常数 )
③1mol 中含有 键的数目是 。
东莞实验中学 2024-2025 学年第二学期第一次段考高二年级化学答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A B C D D B C A C
题号 11 12 13 14 15 16
答案 D B C D B D
17.(共15分)
(1)酚羟基、羧基(2分)
(2) C H (2分) ; 3:1或1:3 (2分)
4 8
(3)CH=CH-CH-COOH(2分)
2 2
(4)-CHO(2分); -NH (2分)
2
(5)直形冷凝管(1分);蒸馏烧瓶 (1分); g(1分)
18.(共13分)
(1) 3 (1分) ; 哑铃形(2分)
(2) Cr (1分) ; < (1分) ; 氧原子的价电子排布式为2s22p4,氮原子的价电子排布式为
2s22p3,氮原子的2p轨道半满状态,比较稳定(2分)
(3) 第四周期第VIII族 (2分) ; 1s22s22p63s23p63d64s2 (2分); <(2分)
19.(共12分)
(1)3d104s24p1(2分)(2) N>P>Si (2分)
(3) sp2、sp3 (2分) ; 3∶1(2分)
(4)GaN、GaP、GaAs均为共价晶体,原子半径:N<P<As,与Ca原子形成的共价键键长逐渐增大,所以
熔点逐渐下降(2分)
(5) 4 (2分)
20.(共16分)
(1) (2分) ; D(1分)
(2)Li+离子半径比Na+小,F-离子半径比Cl-小,离子半径越小离子键越强,熔点越高(2分)
(3)平面三角形(2分)
(4) ( ) (1分) ; 正八面体 (2分)
(5) ① KFe Se (2分) ② ×1023 (2分) ③ 24 (2分)
2 2