文档内容
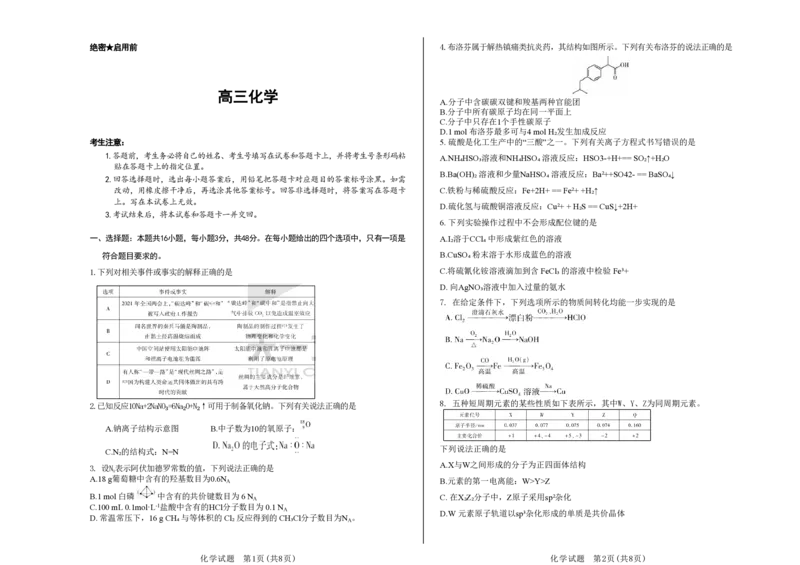
绝密★启用前 4.布洛芬属于解热镇痛类抗炎药,其结构如图所示。下列有关布洛芬的说法正确的是
高三化学
A.分子中含碳碳双键和羧基两种官能团
B.分子中所有碳原子均在同一平面上
C.分子中只存在1个手性碳原子
D.1 mol 布洛芬最多可与4 mol H₂发生加成反应
考生注意: 5. 硫酸是化工生产中的“三酸”之一。下列有关离子方程式书写错误的是
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘
A.NH₄HSO₃溶液和NH₄HSO₄ 溶液反应:HSO3-+H+== SO₂↑+H₂O
贴在答题卡上的指定位置。
B.Ba(OH)₂ 溶液和少量NaHSO₄ 溶液反应:Ba²++SO42- == BaSO₄↓
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡 C.铁粉与稀硫酸反应:Fe+2H+ == Fe²+ +H₂↑
上。写在本试卷上无效。
D.硫化氢与硫酸铜溶液反应:Cu²+ + H₂S == CuS↓+2H+
3.考试结束后,将本试卷和答题卡一并交回。
6. 下列实验操作过程中不会形成配位键的是
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是 A.I₂溶于CCl₄ 中形成紫红色的溶液
符合题目要求的。 B.CuSO₄ 粉末溶于水形成蓝色的溶液
1.下列对相关事件或事实的解释正确的是 C.将硫氰化铵溶液滴加到含 FeCl₃ 的溶液中检验 Fe³+
D. 向AgNO₃溶液中加入过量的氨水
7. 在给定条件下,下列选项所示的物质间转化均能一步实现的是
8. 五种短周期元素的某些性质如下表所示,其中W、Y、Z为同周期元素。
2.已知反应10Na+2NaNO₃=6Na₂O+N₂↑可用于制备氧化钠。下列有关说法正确的是
A.钠离子结构示意图 B.中子数为10的氧原子:
下列说法正确的是
C.N₂的结构式:N=N
A.X与W之间形成的分子为正四面体结构
3. 设N表示阿伏加德罗常数的值,下列说法正确的是
A
A.18 g葡萄糖中含有的羟基数目为0.6N A B.元素的第一电离能:W>Y>Z
B.1 mol 白磷 中含有的共价键数目为 6 N C. 在X₂Z₂分子中,Z原子采用sp²杂化
A
C.100 mL 0.1mol·L-1盐酸中含有的HCl分子数目为 0.1 N
A
D.W 元素原子轨道以sp³杂化形成的单质是共价晶体
D. 常温常压下,16 g CH₄ 与等体积的 Cl₂ 反应得到的 CH₃Cl分子数目为N 。
A
化学试题 第1页(共8页) 化学试题 第2页(共8页)9.化学是以实验为基础的科学。下列实验方案不能达到实验目的的是 12.以煤渣(主要含Al₂O₃、Fe₂O₃、CaCO₃ 等)为原料制取CaCl₂ 的一种工艺流程如图所示:
下列分析错误的是
A. “酸浸”前将煤渣粉碎有利于煤渣充分溶解在盐酸中
B. “沉铝、铁”后滤液中大量存在Ca2+、NH₄+、Cl-、OH-
C. 实验室“过滤”用到的玻璃仪器有烧杯、漏斗、玻璃棒
D. “蒸氨”时总反应的离子方程式为
10. 据《科学网》报道,我国科学家采用新技术实现绿色高效回收聚酯。
13. 下列对科学探究事实的解释正确的是
下列说法正确的是
A. 乙二醇 难溶于水
B.BHET 能发生水解、加成反应
C.1 mol PET最多能消耗(2n-1)mol NaOH
D.用酸性KMnO₄溶液可鉴别乙二醇和BHET
11. 化合物T是一种用于合成药物的重要试剂,其结构式如图所示。已知X、Y、Z、M、N为
原子序数依次增大的前20号元素,且分别位于四个周期,其中Y、Z不相邻,Y、Z、M 的最 14.某实验小组制取丙酸甲酯(沸点:79.7 ℃)的步骤:将丙酸、甲醇和浓硫酸置于三颈烧瓶
外层电子数之和为16。下列有关说法错误的是
中,在一定温度下充分反应并冷却后,加入5% Na₂CO₃ 溶液洗涤,分离出有机层。经无水
A. 非金属性:Z>M
B. 最高价氧化物对应水化物的酸性:M>Y
C.Y 的最高价氧化物是酸性氧化物
D.N 与M 形成的简单二元化合物的水溶液不能使无色酚酞变红
MgSO₄干燥、蒸馏,得到产物。下列有关实验装置(部分夹持及加热装置略)的操作、评价
或叙述正确的是
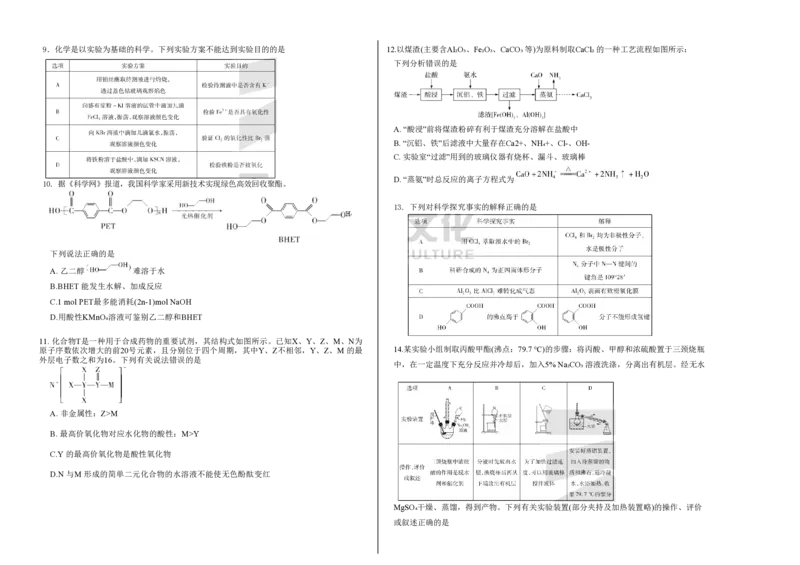
mk/度厚层温逆15.(16分)含氯消毒剂家族庞大、应用广泛,Cl₂ 、ClO₂、“84”消毒液等都是常见的含氯消毒剂。
(1)①Cl 可用于自来水的消毒、杀菌。Cl 与水反应的化学方程式为 。 16. (12分)铜是常见的、用途广泛的金属元素之一。
2 2
②对新制氯水进行光照并连接氯离子传感器,实验结果如图所示。 (1)基态Cu原子核外未成对电子所在的原子轨道是
Cl- 浓度变化的原因是 (用离子方程式表示);50 s 时,氯水中c(Cl-) (2)一价铜离子配合物的结构如图所示:
为 mol·L-1 (保留两位有效数字)。
① 上述配合物中Cu(I)的配位数是 。
②上述配合物分子中碳原子的杂化方式为 。
③上述配合物中所含元素电负性由大到小的顺序为 (用元素符号表示)。
(2)已知某“84”消毒液瓶体部分标签如图所示,某同学欲使用480 mL该消毒液,故用
(3)常见的铜的氧化物有 CuO 和 Cu₂O 两种。
NaClO固体配制该消毒液。
已知:CuO 晶胞中O2-的位置如图1所示:两种晶胞中Cu+ 和 Cu²+ 的位置相同,其在晶
胞侧视图中的位置相同(如图2)。假设两种晶胞的参数相同,CuO晶体的密度是ρ g·cm-3。
①配制过程中使用的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、 。
②需要用托盘天平称量 NaClO 固体的质量为 (保留三位有效数字)。 ①CuO 晶胞中,铜离子的坐标参数是
(3)①一种制备CIO₂ 的反应原理为 NaClO₃+Na₂SO₃+H₂SO₄→Na₂SO₄+ClO₂↑+H₂O(未配平),配 ② Cu₂O 晶体的密度是 g·cm-3(用含ρ的代数式表示)。
平方程式并用双线桥法标出该反应中电子转移的方向和数目: 。
17. (16分)某同学根据铜与浓硫酸的反应,设计如图所示装置探究与验证锌与浓硫酸反应的
②为测定某ClO₂水溶液的浓度,进行以下实验操作:取该待测CIO₂溶液20.00 mL 于锥形瓶 产物(部分加热和夹持装置略)。
中,用稀硫酸调节溶液呈酸性,加入足量 KI 晶体充分反应,再逐滴加入0.1 mol·L-1 Na₂S₂O₃
溶液,恰好完全反应时,消耗Na₂S₂O₃ 溶液10.00 mL。
上述过程中发生反应:2ClO₂+10KI+4H₂SO₄ ===2KCl+5I₂+4K₂SO₄+4H₂O 、
I₂+2Na₂S₂O₃==Na₂S₄O₆+2NaI。
该溶液中 ClO2 的物质的量浓度为 。若加入 KI 晶体后在空气中放置时间过长,会导致
测得的 ClO2浓度 (填“偏高”“偏低”或“无影响”)。
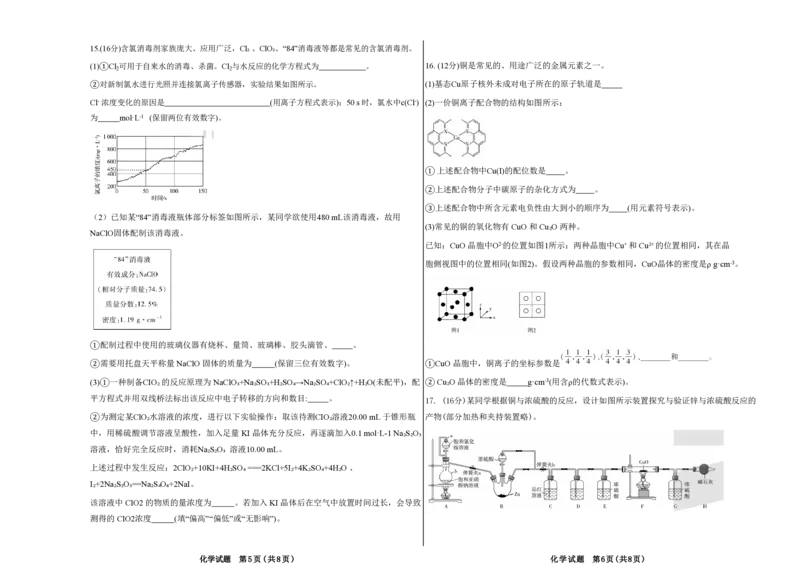
化学试题 第5页(共8页) 化学试题 第6页(共8页)请回答下列问题: ②若向体系中充入少量的 NO 气体,NO 的平衡转化率不变
(1)装置A为制备氮气的装置,该制备氮气反应的化学方程式为 。 ③当体系中压强不再变化时,反应达到平衡状态
(2)装置B中加入50.0 g 锌粉,通过分液漏斗加入浓硫酸,产生的气体能使品红溶液褪色,产生该 ④当体系中混合气体的密度不变时,反应达到平衡状态
气体反应的化学方程式为 。
(3)仪器 b的名称是 。装置F在用酒精灯加热前应先通一段时间的N₂,目的是 。 ( 3 ) 已 知 在 气 缸 中 还 发 生 了 如 下 反 应 :
(4)装置D中装有足量氢氧化钠溶液,装置F中黑色固体变成红色,装置F中发生反应的
反应IV:SO₂(g)+NO₂ (g) NO(g)+SO₃ (g) △H4<0
化学方程式为 ,假设不考虑装置C 对气体的影响,且通过装置F的气
反应V:2SO₂(g)+2NO(g) N₂(g)+2SO₃(g) △H5<0
体全部参加反应,称量装置D和G的增重分别是19.2 g和5.4 g,则剩余锌的质量为 g。
现向某密闭容器中均充入等物质的量的SO₂(g) 和 NO₂(g),在恒温恒容条件下测得气体的压强与
(5)装置H中碱石灰的作用是 。若将装置 D中溶液换成酸性高锰酸钾溶液,其中发
时间的关系如图所示:
生反应的离子方程式为 。
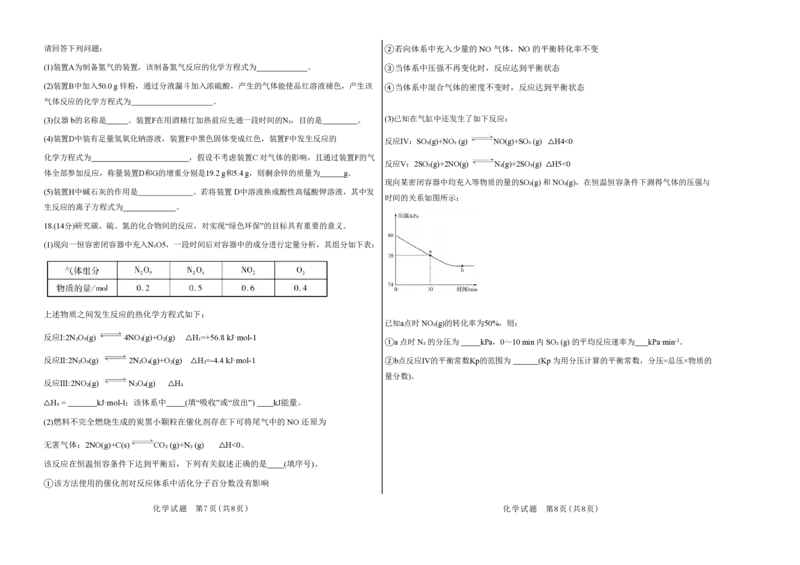
18.(14分)研究碳、硫、氮的化合物间的反应,对实现“绿色环保”的目标具有重要的意义。
(1)现向一恒容密闭容器中充入N₂O5,一段时间后对容器中的成分进行定量分析,其组分如下表:
上述物质之间发生反应的热化学方程式如下:
已知a点时 NO₂(g)的转化率为50%,则:
反应I:2N₂O₅(g) 4NO₂(g)+O₂(g) △H₁=+56.8 kJ·mol-1
①a 点时 N₂ 的分压为 kPa,0~10 min 内 SO₂ (g) 的平均反应速率为 kPa·min-1。
反应Ⅱ:2N₂O₅(g) 2N₂O₄(g)+O₂(g) △H₂=-4.4 kJ·mol-1 ②b点反应IV的平衡常数Kp的范围为 (Kp 为用分压计算的平衡常数,分压=总压×物质的
量分数)。
反应Ⅲ:2NO₂(g) N₂O₄(g) △H₃
△H₃ = kJ·mol-l;该体系中 (填“吸收”或“放出”) kJ能量。
(2)燃料不完全燃烧生成的炭黑小颗粒在催化剂存在下可将尾气中的 NO 还原为
无害气体:2NO(g)+C(s) CO₂ (g)+N₂ (g) △H<0。
该反应在恒温恒容条件下达到平衡后,下列有关叙述正确的是 (填序号)。
①该方法使用的催化剂对反应体系中活化分子百分数没有影响
化学试题 第7页(共8页) 化学试题 第8页(共8页)