文档内容
江苏省前黄中学2025届高三上学期期初检测试卷
化学试卷
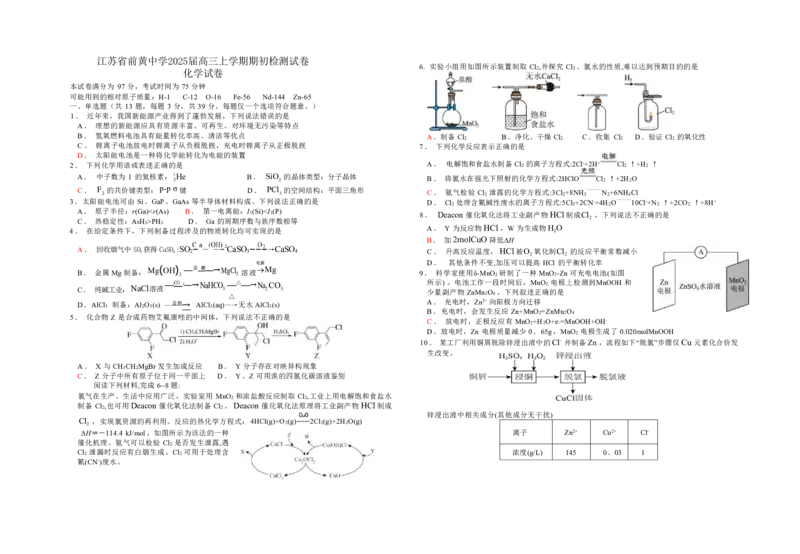
6. 实验小组用如图所示装置制取 Cl2,并探究 Cl2 、氯水的性质,难以达到预期目的的是
本试卷满分为 97 分,考试时间为 75 分钟
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Nd-144 Zn-65
一、单选题(共 13 题,每题 3 分,共 39 分。每题仅一个选项符合题意。)
1. 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B. 氢氧燃料电池具有能量转化率高、清洁等优点 A.制备 Cl2 B.净化、干燥 Cl2 C.收集 Cl2 D.验证 Cl2 的氧化性
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌 7. 下列化学反应表示正确的是
D. 太阳能电池是一种将化学能转化为电能的装置
2. 下列化学用语或表述正确的是 A. 电解饱和食盐水制备 Cl2 的离子方程式:2Cl-+2H+ Cl2 ↑+H2 ↑
A. 中子数为 1 的氦核素:1 2 He B. SiO 2 的晶体类型:分子晶体 B. 将氯水在强光下照射的化学方程式:2HClO Cl2 ↑+2H2O
C. F
2
的共价键类型:p-p σ键 D. PCl
3
的空间结构:平面三角形
C. 氨气检验 Cl 2 泄露的化学方程式:3Cl 2 +8NH 3
—
N 2 +6 — NH 4 Cl
3.太阳能电池可由 Si、GaP、GaAs等半导体材料构成。下列说法正确的是 D. Cl2 处理含氰碱性废水的离子方程式:5Cl2+2CN-+4H2O 10Cl-+N2 ↑+2CO2 ↑+8H+
A. 原子半径:r(Ga)PH3 D. Ga 的周期序数与族序数相等 2
4. 在给定条件下,下列制备过程涉及的物质转化均可实现的是 A. Y 为反应物HCl ,W为生成物H 2 O
B. 加2molCuO 降低ΔH
a
A. 回收烟气中SO 2 获得CaSO 4 :SO 2 ― 2CaSO 3 →CaSO 4 C. 升高反应温度,HCl被O 氧化制Cl 的反应平衡常数减小
2 2
D. 其他条件不变,加压可以提高 HCl 的平衡转化率
B. 金属 Mg 制备:Mg ( OH ) 2 —盐 —→MgCl 2 溶液 Mg 9. 科学家使用δ-MnO2 研制了一种 MnO2-Zn 可充电电池(如图
C. 纯碱工业:NaCl溶液
— 2—→NaHCO
3
—
△
△—→Na
2
CO
3
所
少
示
量副
)。
产
电
物
池
Z
工
nM
作
n
一
2O
段
4 。
时
下
间
列
后
叙
,
述
M
正
nO
确
2
的
电
是
极上检测到MnOOH 和
D.AlCl3 制备:Al2O3(s) 盐酸→ AlCl3(aq)—→无水 AlCl3(s)
A. 充电时,Zn2+向阳极方向迁移
B.充电时,会发生反应 Zn+MnO2=ZnMn2O4
5. 化合物 Z 是合成药物艾氟康唑的中间体,下列说法不正确的是
C. 放电时,正极反应有 MnO2+H2O+e-=MnOOH+OH-
D.放电时,Zn 电极质量减少 0.65g,MnO2 电极生成了 0.020molMnOOH
10. 某工厂利用铜屑脱除锌浸出液中的Cl- 并制备Zn,流程如下“脱氯”步骤仅Cu 元素化合价发
生改变。
A. X 与 CH3CH2MgBr 发生加成反应 B. Y 分子存在对映异构现象
C. Z 分子中所有原子位于同一平面上 D. Y、Z 可用溴的四氯化碳溶液鉴别
阅读下列材料,完成 6⁓8题:
氯气在生产、生活中应用广泛。实验室用 MnO2 和浓盐酸反应制取 Cl2,工业上用电解饱和食盐水
制备 Cl2,也可用Deacon 催化氧化法制备 Cl2 。 Deacon 催化氧化法原理将工业副产物HCl制成
CuO 锌浸出液中相关成分(其他成分无干扰)
Cl
2
,实现氯资源的再利用。反应的热化学方程式:4HCl(g)+O2(g)══2Cl2(g)+2H2O(g)
ΔH=-114.4 kJ/mol。如图所示为该法的一种 离子 Zn2+ Cu2+ Cl-
催化机理。氨气可以检验 Cl2 是否发生泄露,遇
Cl2 泄漏时反应有白烟生成。Cl2 可用于处理含 浓度(g/L) 145 0.03 1
氰(CN-)废水。下列说法正确的是
C. 适当增加
n
起始
(H2O
,有利于提高 H 的产率
2
A. “浸铜”时应加入足量H
2
O
2
,确保铜屑溶解完全 n
起始
(CH3OC
3
)
B. “浸铜”反应: 2Cu+4H++H O =2Cu2++H ↑+2H O
D. 一定温度下,若增大压强,CO 的平衡产量不变
2 2 2 2
C. “脱氯”反应: Cu+Cu2++2Cl- = 2CuCl 二、非选择题:共 4 题,共 58 分。
D. 脱氯液净化后电解,可在阳极得到Zn 14. (14 分)回收磁性合金钕铁硼(Nd Fe B)可制备半导体
2 14
11. 室温下,根据下列实验过程及现象,能验证相应实验结论的是 材料铁酸铋和光学材料氧化钕。
选项 实验过程及现象 实验结论 (1)钕铁硼在空气中焙烧转化为 Nd O 、 Fe O 等(忽略
2 3 2 3
A 向 Al(OH)3 沉淀中分别滴加盐酸和氨水,观察沉淀变化
探
性氢
究
氧
A
化
l(O
物
H)3 为两
硼的化合物),用0.4mol.L—1盐
浸
酸
出
酸
液
浸
中
后
某
过
元
滤
素
得
的
到
物
Nd
质
C
的
l
3
量
×100%
溶液和含铁滤渣。Nd、Fe 浸出率( 某元素的总物质的量 )随浸取时间变化如图所示。
向2mL 0.1mol.L—1 Na S溶液中滴加几滴溴水,振荡,产生 ①含铁滤渣的主要成分为 (填化学式)。
B 2 氧化性:Br >S
淡黄色沉淀 2 ②浸出初期 Fe浸出率先上升后下降的原因是 。
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
C 向溶有 SO2 的 BaCl2 溶液中通入气体 X,出现白色沉淀 气
氧化
体
性
X 一定具有强 ①用含有机胺(R3N)的有机溶剂作为萃取剂提纯一定浓度的 Fe2(SO4)3 溶液,原理为:
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加 KSCN 溶液, 食品脱氧剂样品中
( R
3
NH )
2
SO
4
+Fe3++SO2
4
-+H
2
O H++ ( R
3
NH )
2
Fe ( OH )( SO
4
)
2
(有机层)
D
溶液未出现血红色 没有+3 价铁
(R NH) SO +H+ +HSO — ≈2(R NH.HSO )
①已知:
3 2 4 4 3 4
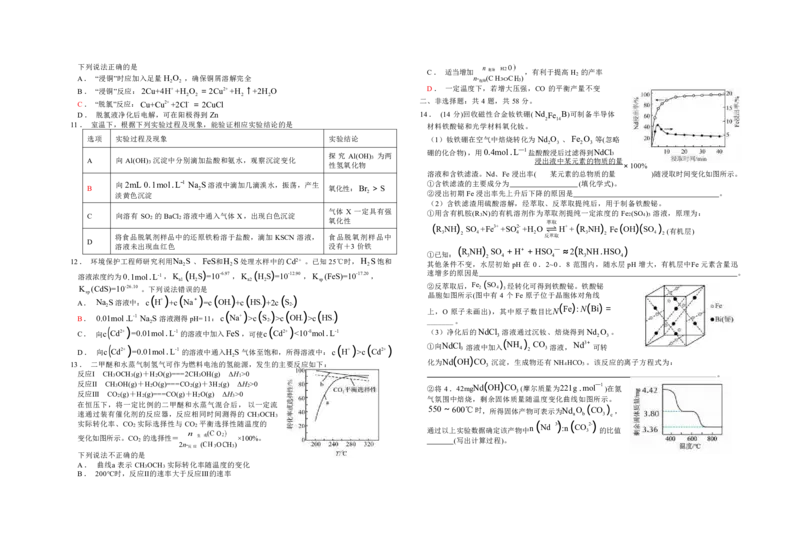
12. 环境保护工程师研究利用Na
2
S 、FeS和H
2
S处理水样中的Cd2+ 。已知25℃时,H
2
S饱和
其他条件不变,水层初始 pH在 0.2~0.8 范围内,随水层 pH 增大,有机层中Fe元素含量迅
溶液浓度约为0.1mol.L-1,K ( H S ) =10-6.97 ,K ( H S ) =10-12.90 ,K (FeS)=10-17.20, 速增多的原因是 。
a1 2 a2 2 sp
K (CdS)=10-26.10 。下列说法错误的是 ②反萃取后,Fe 2 (SO 4 ) 3 经转化可得到铁酸铋。铁酸铋
sp 晶胞如图所示(图中有 4 个 Fe 原子位于晶胞体对角线
A. Na
2
S溶液中:c
( H+)
+c
( Na+)
=c
(
OH
(
-
)
+c
)
(
HS
(
-
)
+2
)
c
(
S
(
2-
)
) ( )
上,O 原子未画出),其中原子数目比N ( Fe ) :N (Bi) =
B. 0.01mol.L-1 Na
2
S溶液测得pH=11:c Na+ >c S
2-
>c OH
-
>c HS
- _______。
C. 向c ( Cd2+ ) =0.01mol.L-1的溶液中加入FeS,可使c ( Cd2+ ) <10-8mol.L-1 (3)净化后的NdCl
3
溶液通过沉钕、焙烧得到Nd
2
O
3
。
D. 向c ( Cd2+) =0.01mol.L-1 的溶液中通入H S 气体至饱和,所得溶液中:c ( H+) >c ( Cd2+) ①向NdCl 3 溶液中加入 (NH 4 ) 2 CO 3溶液,Nd3+ 可转
2
( )
13. 二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下: 化为Nd OH CO 3 沉淀,生成物还有 NH4HCO3 。该反应的离子方程式为:
反应Ⅰ CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0 。
反应Ⅱ CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0 ②将 4.42mgNd ( OH ) CO (摩尔质量为221g .mol —1 )在氮
反应Ⅲ CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
气氛围中焙烧,剩余固体质
3
量随温度变化曲线如图所示。
在恒压下,将一定比例的二甲醚和水蒸气混合后,以一定流
550 ~600℃时,所得固体产物可表示为Nd O ( CO ) ,
速通过装有催化剂的反应器,反应相同时间测得的 CH3OCH3 a b 3 c
实际转化率、CO2 实际选择性与 CO2 平衡选择性随温度的
通过以上实验数据确定该产物中n
(
Nd
3)+
:n
(
CO 3
2-)
的比值
n O
变化如图所示。CO
2
的选择性= 生 ×100%。
(写出计算过程)。
2n
反应
( 3O H3)
下列说法不正确的是
A. 曲线a 表示 CH3OCH3 实际转化率随温度的变化
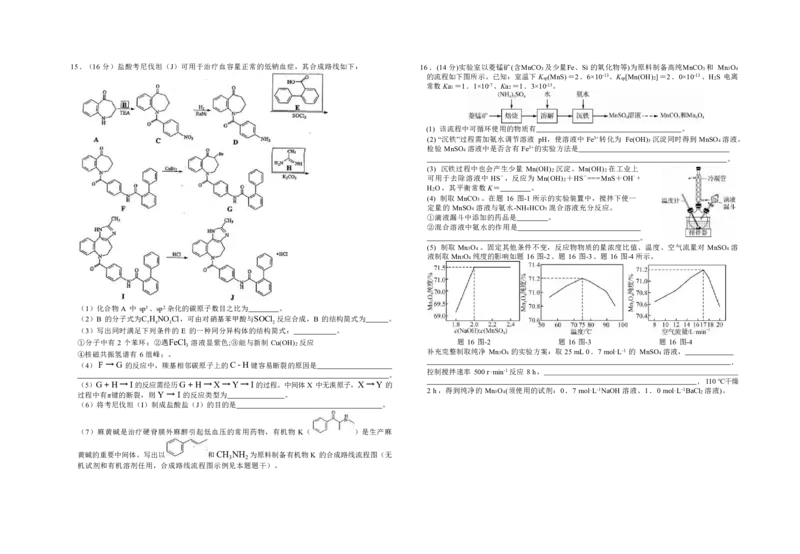
B. 200℃时,反应Ⅱ的速率大于反应Ⅲ的速率15.(16 分)盐酸考尼伐坦(J)可用于治疗血容量正常的低钠血症,其合成路线如下: 16.(14分)实验室以菱锰矿(含MnCO3 及少量Fe、Si的氧化物等)为原料制备高纯MnCO3 和 Mn3O4
的流程如下图所示。已知:室温下Ksp(MnS)=2.6×10-13、Ksp[Mn(OH)2]=2.0×10-13、H2S 电离
常数Ka1 =1.1×10-7、Ka2 =1.3×10-13。
(1) 该流程中可循环使用的物质有 。
(2) “沉铁”过程需加氨水调节溶液 pH,使溶液中 Fe3+转化为 Fe(OH)3 沉淀同时得到 MnSO4 溶液。
检验 MnSO4 溶液中是否含有 Fe3+的实验方法是
。
(3) 沉铁过程中也会产生少量 Mn(OH)2 沉淀。Mn(OH)2 在工业上
可用于去除溶液中 HS-,反应为 Mn(OH)2 +HS-===MnS+OH-+
H2O,其平衡常数K= 。
(4) 制取 MnCO3 。在题 16 图-1 所示的实验装置中,搅拌下使一
定量的 MnSO4 溶液与氨水-NH4HCO3 混合溶液充分反应。
①滴液漏斗中添加的药品是 。
②混合溶液中氨水的作用是
。
(5) 制取 Mn3O4 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 MnSO4 溶
液制取 Mn3O4 纯度的影响如题 16 图-2、题 16 图-3、题 16 图-4所示。
(1)化合物 A 中 sp3、sp2杂化的碳原子数目之比为 。
(2)B 的分子式为C H NO Cl,可由对硝基苯甲酸与SOCl 反应合成,B 的结构简式为 。
7 4 3 2
(3)写出同时满足下列条件的 E 的一种同分异构体的结构简式: 。
①分子中有 2 个苯环;②遇FeCl
3
溶液显紫色;③能与新制 Cu(OH)2 反应 题 16 图-2 题 16 图-3 题 16 图-4
④核磁共振氢谱有 6 组峰;。 补充完整制取纯净 Mn3O4 的实验方案:取 25mL0.7mol·L-1 的 MnSO4 溶液,
,
(4)F →G 的反应中,羰基相邻碳原子上的C-H键容易断裂的原因是
控制搅拌速率 500r·min-1反应 8h,
。
, 110℃干燥
(5)G+H→I的反应需经历G+H→X→Y→I的过程。中间体X 中无溴原子,X→Y 的
过程中有π键的断裂,则 Y → I 的反应类型为 。
2 h,得到纯净的 Mn3O4(须使用的试剂:0.7 mol·L-1NaOH溶液、1.0 mol·L-1BaCl2 溶液)。
(6)将考尼伐坦(I)制成盐酸盐(J)的目的是 。
(7)麻黄碱是治疗硬脊膜外麻醉引起低血压的常用药物,有机物 K( )是生产麻
黄碱的重要中间体。写出以 和CH NH 为原料制备有机物 K 的合成路线流程图(无
3 2
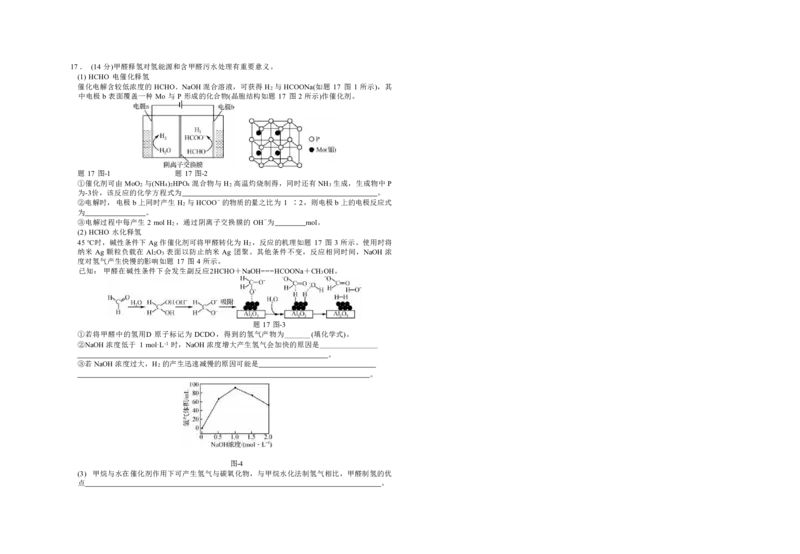
机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。17. (14 分)甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1) HCHO 电催化释氢
催化电解含较低浓度的 HCHO、NaOH混合溶液,可获得 H2 与 HCOONa(如题 17 图 1 所示),其
中电极 b 表面覆盖一种 Mo 与 P 形成的化合物(晶胞结构如题 17 图 2所示)作催化剂。
题 17 图-1 题 17 图-2
①催化剂可由 MoO2 与(NH4)2HPO4 混合物与 H2 高温灼烧制得,同时还有 NH3 生成,生成物中 P
为-3价,该反应的化学方程式为 。
②电解时,电极b上同时产生 H2 与 HCOO-的物质的量之比为 1 ∶2,则电极 b上的电极反应式
为 。
③电解过程中每产生 2 molH2 ,通过阴离子交换膜的 OH-为 mol。
(2) HCHO 水化释氢
45 ℃时,碱性条件下 Ag作催化剂可将甲醛转化为 H2 ,反应的机理如题 17 图 3 所示。使用时将
纳米 Ag 颗粒负载在 Al2O3 表面以防止纳米 Ag 团聚。其他条件不变,反应相同时间,NaOH 浓
度对氢气产生快慢的影响如题 17 图 4 所示。
已知: 甲醛在碱性条件下会发生副反应2HCHO+NaOH===HCOONa+CH3OH。
题 17 图-3
①若将甲醛中的氢用D 原子标记为 DCDO,得到的氢气产物为_______(填化学式)。
②NaOH 浓度低于 1 mol·L-1 时,NaOH浓度增大产生氢气会加快的原因是________________
。
③若NaOH浓度过大,H2 的产生迅速减慢的原因可能是
。
图-4
(3) 甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优
点 。江苏省前黄中学2025届高三上学期期初检测试卷
化学答案
一、单选题(共13题,每题3分,共39分。每题仅一个选项符合题意。)
1D2C3B4A5C6A7C8B9C10C11B12B13D
14、(14分)
(1) ①Fe O (2分)
2 3
②浸出初期,c(H+)较大,Fe 2 O 3 溶于盐酸,约5min后,c(H+)减小,Fe3 水解生成Fe(OH) 3
进入滤渣 (2分)
(2)①随水层pH增大,c(H+)减小, R
3
NH
2
SO
4
H HSO
4
2 R
3
NHHSO
4
R NH SO
的化学平衡逆向移动,引起
3 2 4
的量增多,萃取正向程度增大(2分)
②2:1 (2分)
(3) ①Nd3++2CO2-+H O=Nd OH CO +HCO (2分) ②2:1(4分)
3 2 3 3
4.42103g
8.84mg Nd
OH
CO 的物质的量为
2105mol,
3 221gmol1
n Nd3+ =2105mol;n(C)=2105mol, n(H)=2105mol
550600℃时,根据H元素守恒可知,固体分解时生成H O的质量为
2
1
2105mol 18103mgmol10.18mg
2 (1分),
固体减少的质量的质量为4.42mg-3.80mg=0.62mg,所以还有CO 生成。
2
则生成CO 的质量为 0.62mg-0.18mg=0.44mg,
2
0.44mg
则生成n(CO )= 1105mol(1分)
2 44103mgmol1
由C元素守恒可知,
分解后剩余的CO2的物质的量为2×10-5mol-1105mol=1105mol(1分)
3
2105mol
n Nd3+ :n CO2- = 2:1(1分)
3 1105mol
15.(16分)
(1)3:7(2分)(2) (1分)
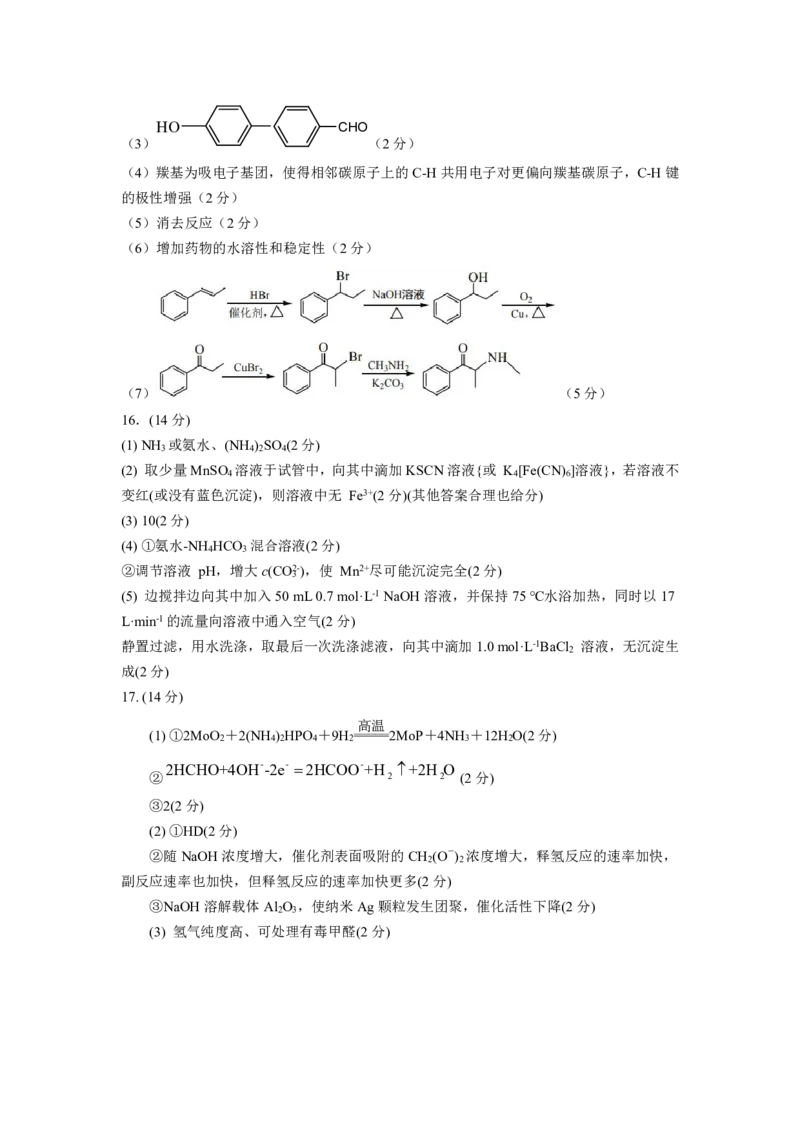
{#{QQABAYYQggAIQIIAABhCQwWICAOQkACACSgOgAAAoAAAwQNABAA=}#}HO CHO
(3) (2分)
(4)羰基为吸电子基团,使得相邻碳原子上的C-H共用电子对更偏向羰基碳原子,C-H键
的极性增强(2分)
(5)消去反应(2分)
(6)增加药物的水溶性和稳定性(2分)
(7) (5分)
16.(14分)
(1)NH 或氨水、(NH ) SO (2分)
3 4 2 4
(2) 取少量MnSO 溶液于试管中,向其中滴加KSCN溶液{或 K [Fe(CN) ]溶液},若溶液不
4 4 6
变红(或没有蓝色沉淀),则溶液中无 Fe3+(2分)(其他答案合理也给分)
(3)10(2分)
(4)①氨水-NH HCO 混合溶液(2分)
4 3
②调节溶液 pH,增大c(CO2-),使 Mn2+尽可能沉淀完全(2分)
3
(5) 边搅拌边向其中加入50mL0.7mol·L-1NaOH溶液,并保持75℃水浴加热,同时以17
L·min-1的流量向溶液中通入空气(2分)
静置过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加1.0mol·L-1BaCl 溶液,无沉淀生
2
成(2分)
17.(14分)
高温
(1)①2MoO +2(NH ) HPO +9H =====2MoP+4NH +12H O(2分)
2 4 2 4 2 3 2
2HCHO+4OH--2e- 2HCOO-+H +2H O
② 2 2 (2分)
③2(2分)
(2)①HD(2分)
②随NaOH浓度增大,催化剂表面吸附的CH (O-) 浓度增大,释氢反应的速率加快,
2 2
副反应速率也加快,但释氢反应的速率加快更多(2分)
③NaOH溶解载体Al O ,使纳米Ag颗粒发生团聚,催化活性下降(2分)
2 3
(3) 氢气纯度高、可处理有毒甲醛(2分)
{#{QQABAYYQggAIQIIAABhCQwWICAOQkACACSgOgAAAoAAAwQNABAA=}#}