文档内容
2024 年湖北云学名校联盟高二年级 10 月联考
化学试卷
命题学校:钟祥一中 命题人:高二化学组 审题人:夷陵中学 黄岗
考试时间:2024年10月16日14:30-17:05 时长:75分钟 满分:100分
可能用到的相对原子质量:
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.中华传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是( )
A.“高奴县出脂水,燃之如麻,但烟甚浓”,所述“脂水”就是现在的石油
B.“烈火焚烧若等闲”涉及的碳酸钙分解反应在低温下能自发进行
C.《本草经集注》中写到“如握雪不冰,以火烧之,紫青烟起,仍成灰,乃真硝石也。“硝石”是指
D.“煮豆燃豆其,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
2.生活中处处有化学,下列物质的性质与用途对应关系正确的是( )
A. 可中和酸并受热分解,产生大量气体,可用作食品膨松剂
B. 具有漂白性,可用作葡萄酒的添加剂
C.氯化钙能够吸水,可用作豆腐的制作过程中的凝固剂
D.乙烯能够发生加成反应,可用作果实催熟剂
3.欲除去下列物质中混有的少量杂质,所用试剂和分离方法均正确的是( )
选项 物质 杂质 试剂 分离方法
A 乙醇 水 生石灰 蒸馏
B 乙酸乙酯 乙酸 过滤
饱和 溶液
C 乙烷 乙烯 酸性高锰酸钾溶液 洗气
D 洗气
饱和 溶液
A.A B.B C.C D.D
4.设 为阿伏加德罗常数的值,下列说法正确的是( )
A.将 和 充入密闭容器中,充分反应后,容器内分子数目为
B.常温常压下, 甲基( )含有电子数目为
C. 的乙醇溶液与足量的钠反应生成 分子数目为D. 与 混合光照充分反应后分子总数目为
5.解释下列事实的化学方程式或离子方程式正确的是( )
A.用石英和焦炭制取粗硅:
B.向氨水中通入过量 :
C.碳酸氢铵溶液与足量的 溶液混合后加热:
D.向 溶液中加入稀硫酸:
6.海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下列是海水利用的部分过程,有
关说法正确的是( )
A.制纯碱:
B.提取镁:海水
C.制漂白粉: 漂白粉
D.提取溴: 液溴
7.下列说法错误的是( )
A.在反应热的测定实验中,用温度计测定盐酸起始温度后,直接测定氢氧化钠溶液的温度,会使中和反应
反应热测定值 偏大
B.甲烷燃烧热为 ,则
C.相同条件下,稀盐酸和稀 溶液反应的中和热与稀硫酸和稀氢氧化钾溶液反应的中和热相等
D.恒温恒容时, 和 充分反应生成 ,放出热量 ,其热化学方程
式可表示为
8.下列事实中,不能用勒夏特列原理解释的是( )
A.打开可口可乐瓶塞,可产生大量气泡
B.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出以提高其产量
C.恒温密闭容器中反应 达到平衡后,缩小体积增大压强气体颜色变深
D.实验室可用浓氨水和氢氧化钠固体快速制取氨气
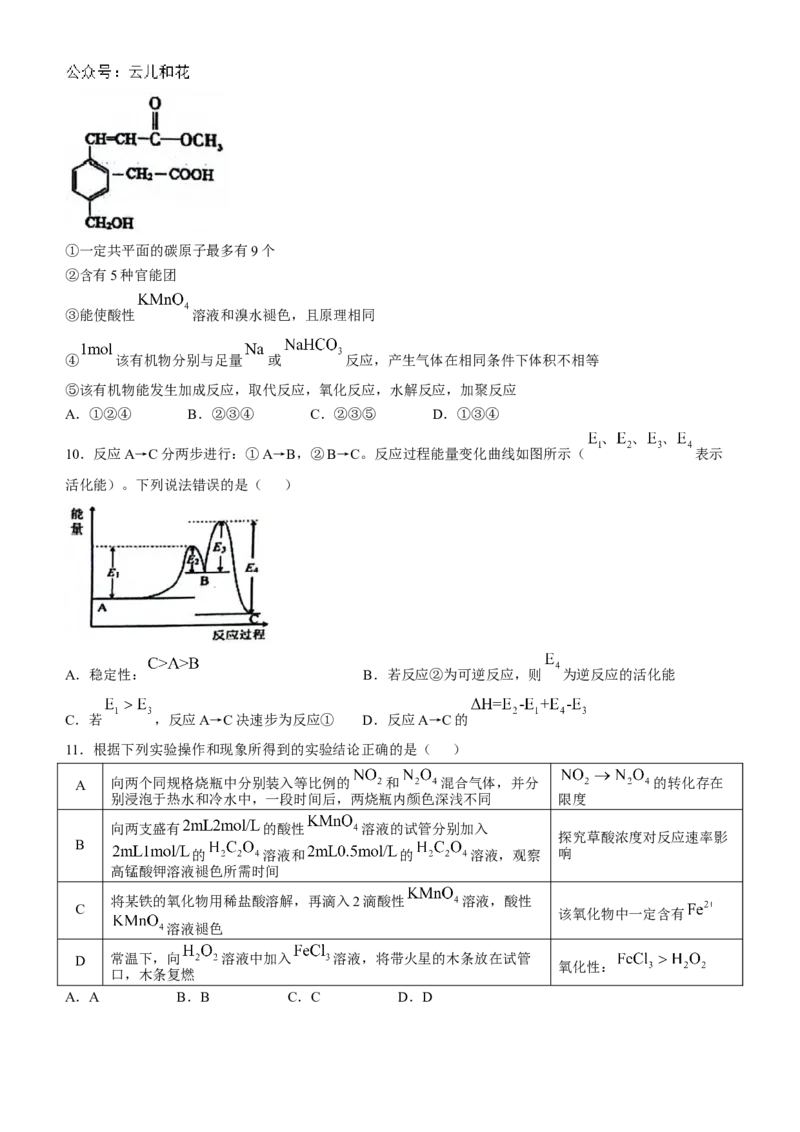
9、某有机物的结构如图所示,下列关于该有机物的说法错误的是( )①一定共平面的碳原子最多有9个
②含有5种官能团
③能使酸性 溶液和溴水褪色,且原理相同
④ 该有机物分别与足量 或 反应,产生气体在相同条件下体积不相等
⑤该有机物能发生加成反应,取代反应,氧化反应,水解反应,加聚反应
A.①②④ B.②③④ C.②③⑤ D.①③④
10.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示( 表示
活化能)。下列说法错误的是( )
A.稳定性: B.若反应②为可逆反应,则 为逆反应的活化能
C.若 ,反应A→C决速步为反应① D.反应A→C的
11.根据下列实验操作和现象所得到的实验结论正确的是( )
A 向两个同规格烧瓶中分别装入等比例的 和 混合气体,并分 的转化存在
别浸泡于热水和冷水中,一段时间后,两烧瓶内颜色深浅不同 限度
向两支盛有 的酸性 溶液的试管分别加入
探究草酸浓度对反应速率影
B
的 溶液和 的 溶液,观察 响
高锰酸钾溶液褪色所需时间
将某铁的氧化物用稀盐酸溶解,再滴入2滴酸性 溶液,酸性
C
该氧化物中一定含有
溶液褪色
D 常温下,向 溶液中加入 溶液,将带火星的木条放在试管
氧化性:
口,木条复燃
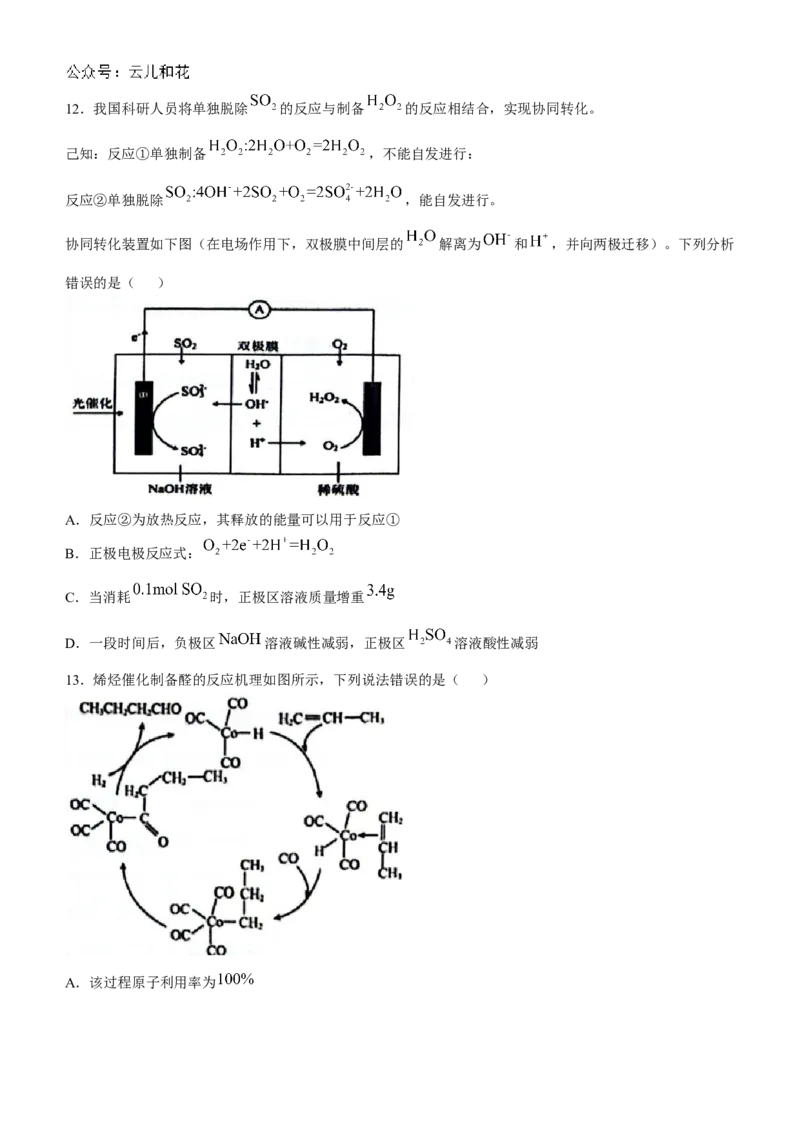
A.A B.B C.C D.D12.我国科研人员将单独脱除 的反应与制备 的反应相结合,实现协同转化。
己知:反应①单独制备 ,不能自发进行:
反应②单独脱除 ,能自发进行。
协同转化装置如下图(在电场作用下,双极膜中间层的 解离为 和 ,并向两极迁移)。下列分析
错误的是( )
A.反应②为放热反应,其释放的能量可以用于反应①
B.正极电极反应式:
C.当消耗 时,正极区溶液质量增重
D.一段时间后,负极区 溶液碱性减弱,正极区 溶液酸性减弱
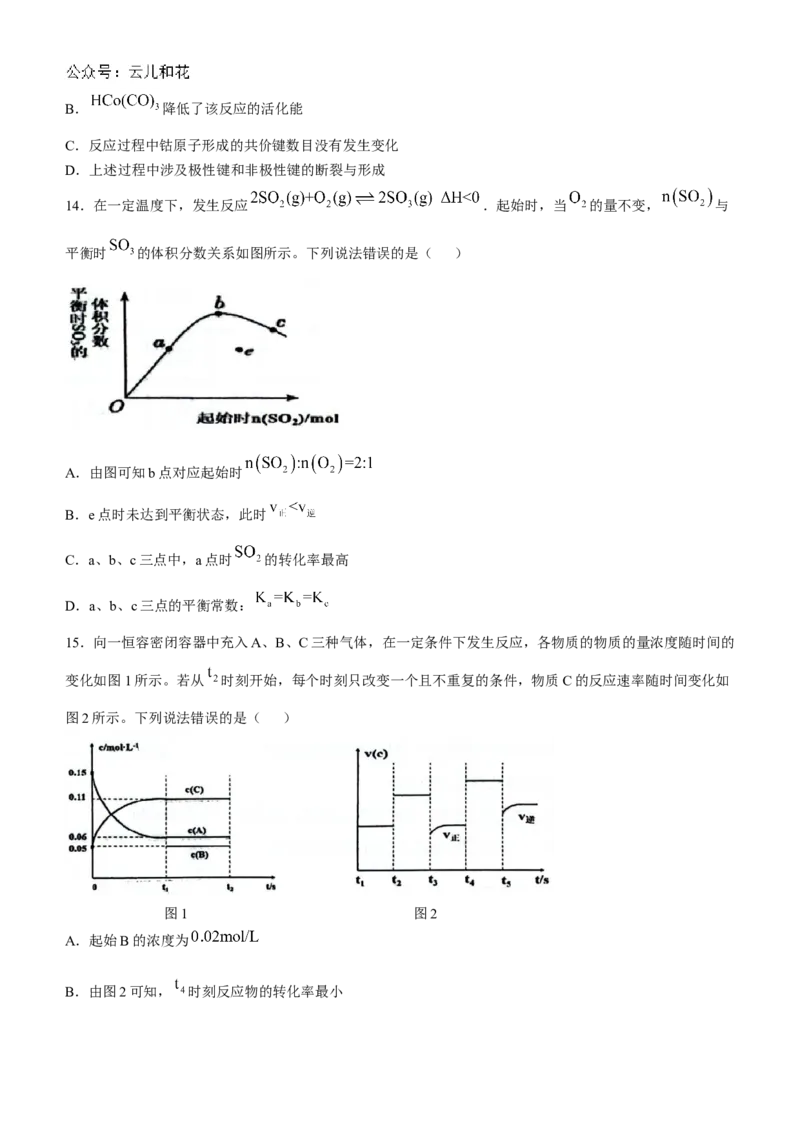
13.烯烃催化制备醛的反应机理如图所示,下列说法错误的是( )
A.该过程原子利用率为B. 降低了该反应的活化能
C.反应过程中钴原子形成的共价键数目没有发生变化
D.上述过程中涉及极性键和非极性键的断裂与形成
14.在一定温度下,发生反应 .起始时,当 的量不变, 与
平衡时 的体积分数关系如图所示。下列说法错误的是( )
A.由图可知b点对应起始时
B.e点时未达到平衡状态,此时
C.a、b、c三点中,a点时 的转化率最高
D.a、b、c三点的平衡常数:
15.向一恒容密闭容器中充入A、B、C三种气体,在一定条件下发生反应,各物质的物质的量浓度随时间的
变化如图1所示。若从 时刻开始,每个时刻只改变一个且不重复的条件,物质C的反应速率随时间变化如
图2所示。下列说法错误的是( )
图1 图2
A.起始B的浓度为
B.由图2可知, 时刻反应物的转化率最小C. 时改变的条件只能是降低反应温度
D.平衡后,在恒温恒容下再充入一定量的气体A,达到新平衡后,A的体积分数不变
二、非选择题:本题共4小题,共55分。
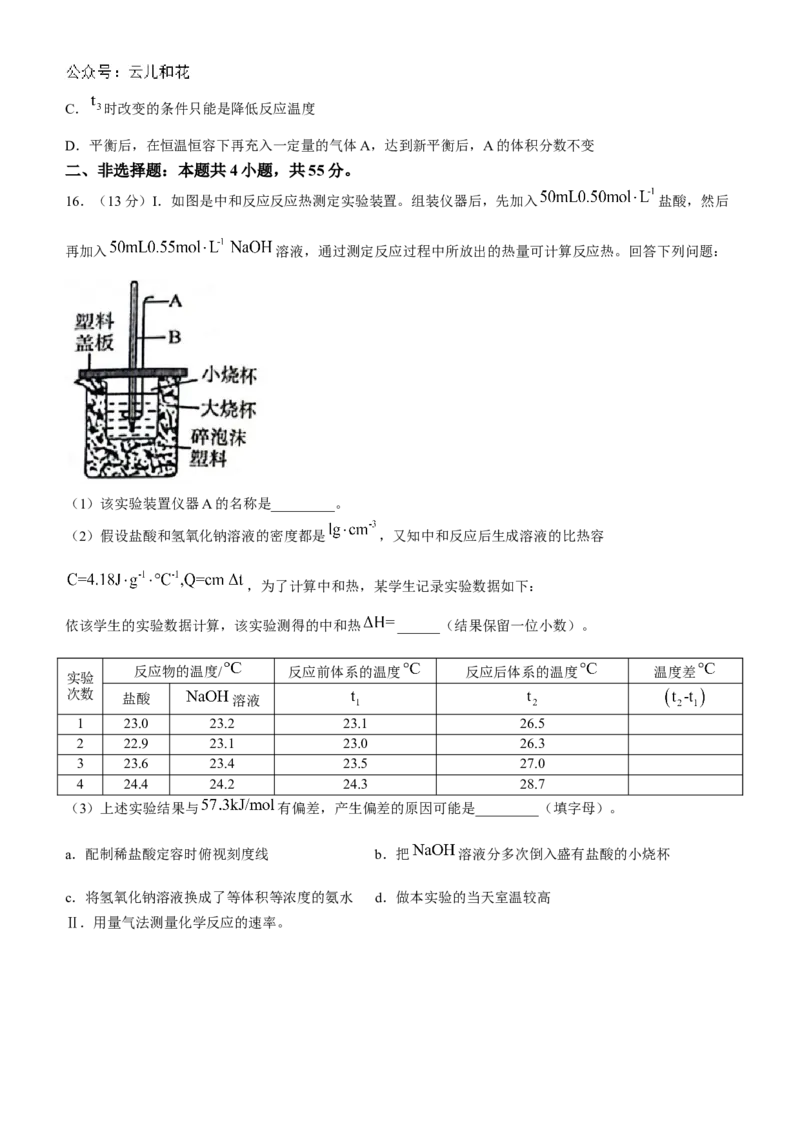
16.(13分)I.如图是中和反应反应热测定实验装置。组装仪器后,先加入 盐酸,然后
再加入 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
(1)该实验装置仪器A的名称是_________。
(2)假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,为了计算中和热,某学生记录实验数据如下:
依该学生的实验数据计算,该实验测得的中和热 ______(结果保留一位小数)。
反应物的温度/ 反应前体系的温度 反应后体系的温度 温度差
实验
次数
盐酸 溶液
1 23.0 23.2 23.1 26.5
2 22.9 23.1 23.0 26.3
3 23.6 23.4 23.5 27.0
4 24.4 24.2 24.3 28.7
(3)上述实验结果与 有偏差,产生偏差的原因可能是_________(填字母)。
a.配制稀盐酸定容时俯视刻度线 b.把 溶液分多次倒入盛有盐酸的小烧杯
c.将氢氧化钠溶液换成了等体积等浓度的氨水 d.做本实验的当天室温较高
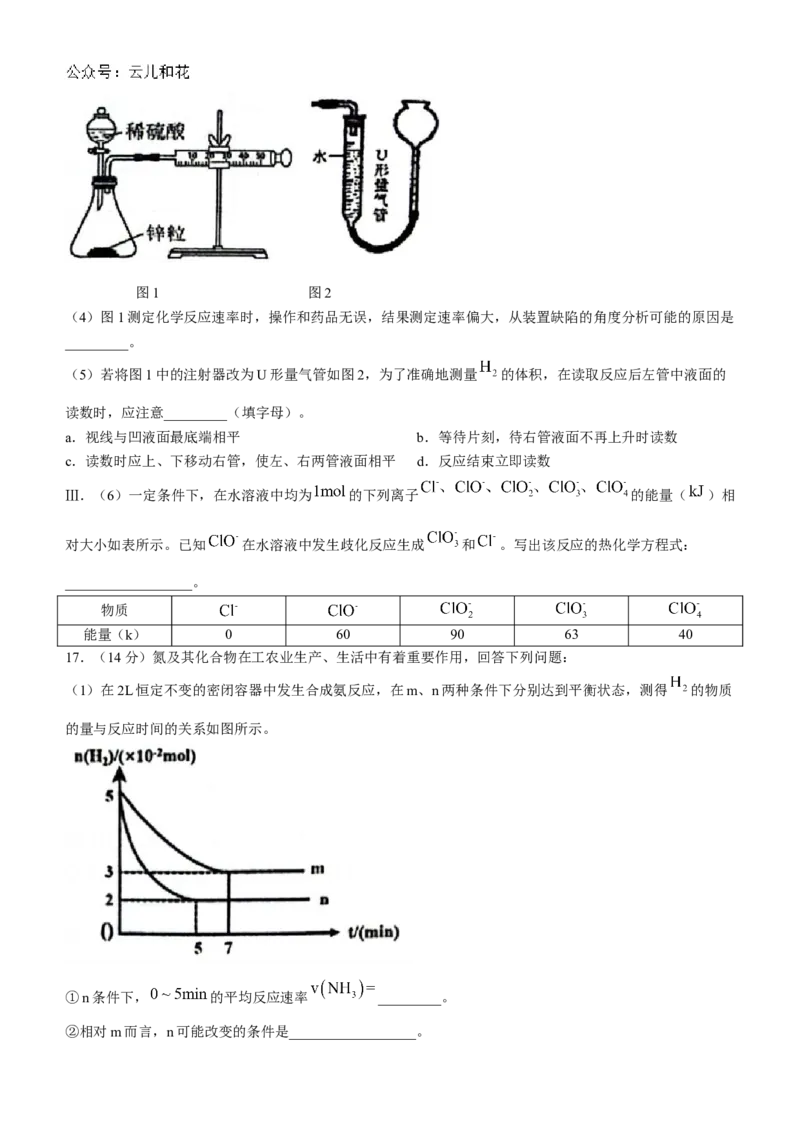
Ⅱ.用量气法测量化学反应的速率。图1 图2
(4)图1测定化学反应速率时,操作和药品无误,结果测定速率偏大,从装置缺陷的角度分析可能的原因是
_________。
(5)若将图1中的注射器改为U形量气管如图2,为了准确地测量 的体积,在读取反应后左管中液面的
读数时,应注意_________(填字母)。
a.视线与凹液面最底端相平 b.等待片刻,待右管液面不再上升时读数
c.读数时应上、下移动右管,使左、右两管液面相平 d.反应结束立即读数
Ⅲ.(6)一定条件下,在水溶液中均为 的下列离子 的能量( )相
对大小如表所示。已知 在水溶液中发生歧化反应生成 和 。写出该反应的热化学方程式:
__________________。
物质
能量(k) 0 60 90 63 40
17.(14分)氮及其化合物在工农业生产、生活中有着重要作用,回答下列问题:
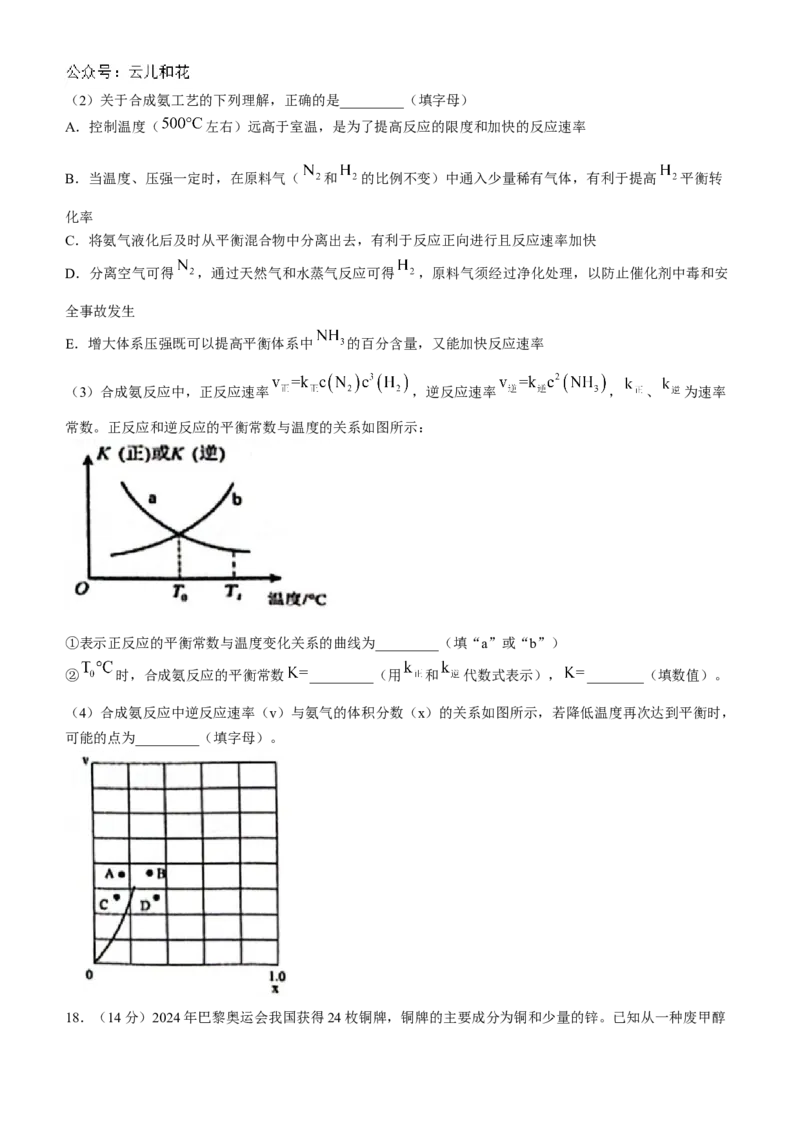
(1)在2L恒定不变的密闭容器中发生合成氨反应,在m、n两种条件下分别达到平衡状态,测得 的物质
的量与反应时间的关系如图所示。
①n条件下, 的平均反应速率 _________。
②相对m而言,n可能改变的条件是__________________。(2)关于合成氨工艺的下列理解,正确的是_________(填字母)
A.控制温度( 左右)远高于室温,是为了提高反应的限度和加快的反应速率
B.当温度、压强一定时,在原料气( 和 的比例不变)中通入少量稀有气体,有利于提高 平衡转
化率
C.将氨气液化后及时从平衡混合物中分离出去,有利于反应正向进行且反应速率加快
D.分离空气可得 ,通过天然气和水蒸气反应可得 ,原料气须经过净化处理,以防止催化剂中毒和安
全事故发生
E.增大体系压强既可以提高平衡体系中 的百分含量,又能加快反应速率
(3)合成氨反应中,正反应速率 ,逆反应速率 , 、 为速率
常数。正反应和逆反应的平衡常数与温度的关系如图所示:
①表示正反应的平衡常数与温度变化关系的曲线为_________(填“a”或“b”)
② 时,合成氨反应的平衡常数 _________(用 和 代数式表示), ________(填数值)。
(4)合成氨反应中逆反应速率(v)与氨气的体积分数(x)的关系如图所示,若降低温度再次达到平衡时,
可能的点为_________(填字母)。
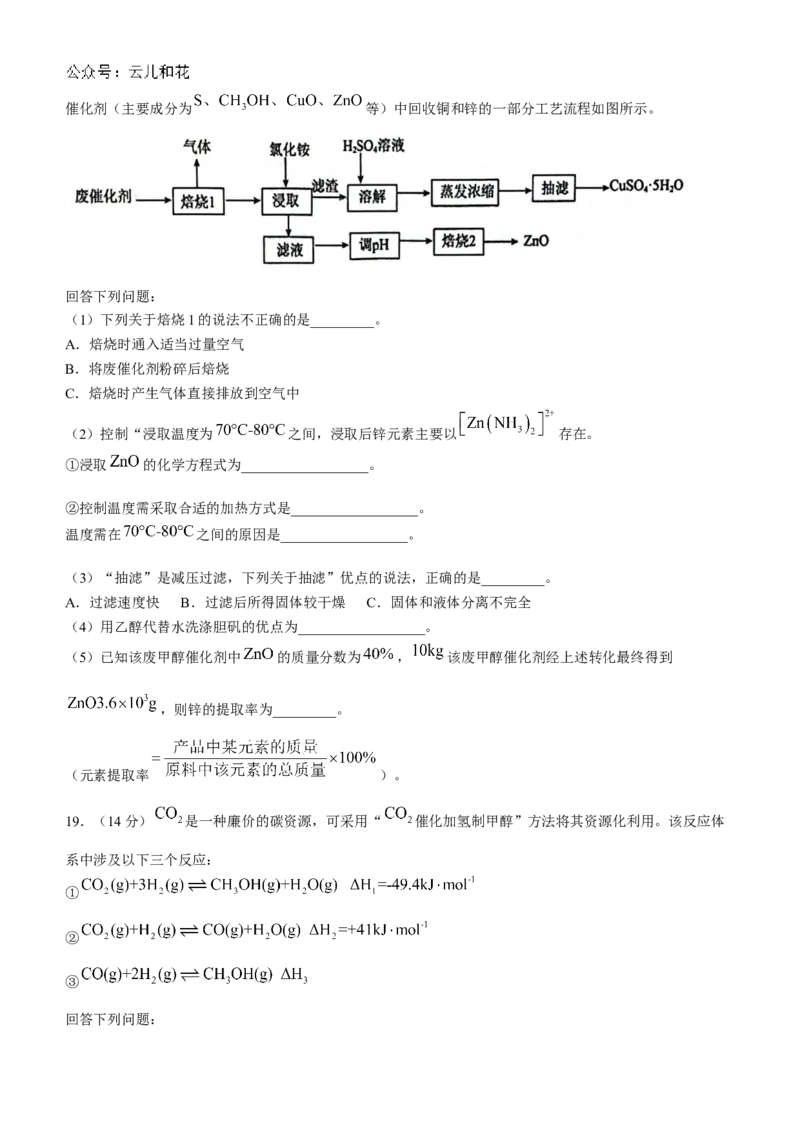
18.(14分)2024年巴黎奥运会我国获得24枚铜牌,铜牌的主要成分为铜和少量的锌。已知从一种废甲醇催化剂(主要成分为 等)中回收铜和锌的一部分工艺流程如图所示。
回答下列问题:
(1)下列关于焙烧1的说法不正确的是_________。
A.焙烧时通入适当过量空气
B.将废催化剂粉碎后焙烧
C.焙烧时产生气体直接排放到空气中
(2)控制“浸取温度为 之间,浸取后锌元素主要以 存在。
①浸取 的化学方程式为__________________。
②控制温度需采取合适的加热方式是__________________。
温度需在 之间的原因是__________________。
(3)“抽滤”是减压过滤,下列关于抽滤”优点的说法,正确的是_________。
A.过滤速度快 B.过滤后所得固体较干燥 C.固体和液体分离不完全
(4)用乙醇代替水洗涤胆矾的优点为__________________。
(5)已知该废甲醇催化剂中 的质量分数为 , 该废甲醇催化剂经上述转化最终得到
,则锌的提取率为_________。
(元素提取率 )。
19.(14分) 是一种廉价的碳资源,可采用“ 催化加氢制甲醇”方法将其资源化利用。该反应体
系中涉及以下三个反应:
①
②
③
回答下列问题:(1) _________ .
(2)关于反应①、②、③的 (K代表化学平衡常数)随 (T代表温度)的变化图正确的是_________。
A. B.
(3)某温度时在1L恒容的容器中加入 和 ,若只发生①、②两个反应,已知此条件下甲醇
的选择性为 [甲醇的选择性 ], 平衡转化率为 ,该条件下反应
②的平衡常数 _________(结果保留两位小数)。
(4)一定温度下,在恒容密闭容器中充入 和 只发生反应①达到平衡,下列有关说法正确
的是_________(填字母)。
A.起始若充入 和 ,达平衡时 的转化率将增大
B.当 时,该反应达到平衡状态
C.若 ,当 的体积分数保持不变时,该反应达到平衡状态
D.单位时间内,断开 的数目和断开 的数目相同时,该反应达到平衡状态
(5)已知反应②可自发,则反应②的 _________0(填“>”“<”或“=”);一定温度下,反应②达到
平衡,测得各组分的平衡分压(即组分的物质的量分数×总压)如表中数据:
物质
分压(MPa) 0.25 0.25 0.75 0.75
维持相同的温度和总压,提高 的比例,使 的平衡转化率提高到 ,则原料气中 和 的物质
的量之比为_________.
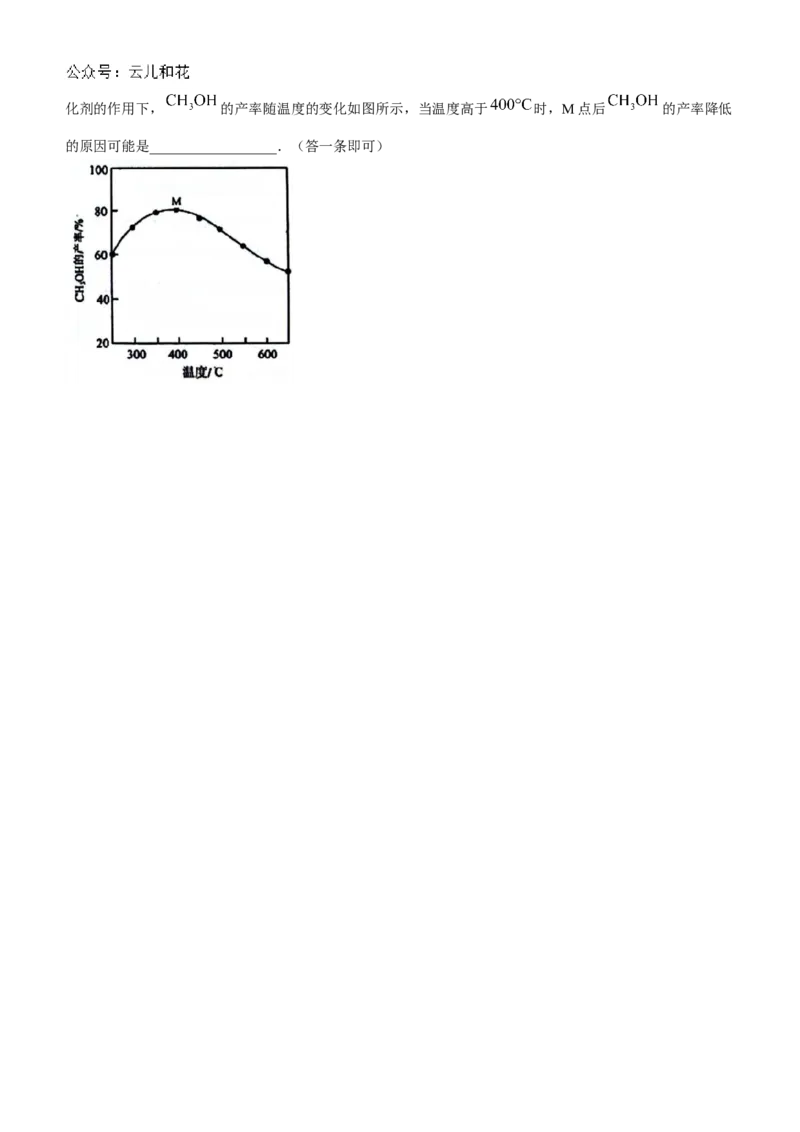
(6)向密闭容器中分别投入一定量的 和 只发生反应③,其他条件相同时,测得相同时间内在某种催化剂的作用下, 的产率随温度的变化如图所示,当温度高于 时,M点后 的产率降低
的原因可能是__________________.(答一条即可)2024 年湖北云学名校联盟高二年级 10 月联考
化学试卷评分细则
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B A A D B C D C B D A D C B C/D
16【答案】(除标注外,每空2分,共13分)
(1)玻璃搅拌器(见错不得分)
(2) ( 或 均给分,写成 或 不得分)
(3)bc(大写不得分,漏选得1分,见错不得分)
(4)忽略加入稀硫酸排出的气体体积(合理答案亦可)
【评分细则】( )玻璃搅拌器(见错不得分,如:(环形)玻璃搅拌棒、搅拌器等均不得分)
(2) ( 或 均给分,写成 或 不得分)
(3)bc(大写不得分,漏选得1分,见错不得分)
(4)忽略加入稀硫酸排出的气体体积(收集到的气体中混有空气导致体积偏大、硫酸的体积影响了气体的体
积等得2分,原装置内有空气、装置漏气、反应放热等不得分)
(5)ac(大写不得分,漏选得1分,见错不得分)
【评分细则】16、(5)按照答案给分。
(6) (3分,见错不得分)
【评分细则】16、(6)按照答案给分。
17【答案】(每空2分,共14分)
(1)① (无单位或者单位错扣1分)
②增加 的物质的量浓度(或者增加 的物质的量也得分,答缩小体积不得分)
【评分细则】17、(1)① (无单位或者单位错不给分,写 不
给分)
②增加 的物质的量浓度(或者增加 的物质的量也得分,答缩小体积或者增大压强不得分)
(2)DE
【评分细则】17、(2)DE(一个1分,有错0分)
正
(3)①a ② 1(4)D(4)【评分细则】17、(3)①a(写大写A不给分) ② 1 (4)D
18【答案】(每空2分,共14分)
(1)C
(2)
②水浴加热;温度过低,浸取慢;温度过高, 受热分解(温度过低,浸取慢,1分;温度过高,
受热分解,1分。)
(3)AB(选A或B得1分)
(4)减少胆矾溶解损失;乙醇易挥发,有利于干燥(减少胆矾溶解损失,1分:乙醇易挥发,有利于干燥,
1分)
(5)
【评分细则】18、(1)C
(2)C(2分,见错不给分)
(3)① (离子方程式不给分,未写条件不扣分)
②水浴加热;(其他方法不给分)温度过低,浸取慢;温度过高, 受热分解
(温度过低,浸取慢,1分,必须达到速率快慢,答成“不反应,反应不充分”等都不给分;温度过高,
受热分解,1分,答成“氨气逸出”“配合物不稳定”也可以给1分,其他答案不给分。正向答“该
范围内速率快,氯化铵稳定不分解”也可以给全分)
(3)答案不全得1分,见错不得分:
(4)减少胆矾溶解损失,1分:乙醇易挥发,有利于干燥,1分,答洗去杂质不得分:
(5) 均分,其它不得分。
19【答案】(每空2分,共14分)
(1) (2)B (3)0.11 (4)A (5)>
(6)催化剂活性降低或温度升高副反应增多或M点之后反应③己平衡,温度升高,平衡逆向移动,使甲醇
产量降低(其他合理答案亦可)部分答案详解
【评分细则】(1) (2)B (3)0.11
三空按答案改,第(1)问带单位了不扣分,第(2)问写成“b”或“②”的均不给分
(4)A(多选不给分,小写“a”不给分)
(5)>(见错不给分,写“大于”不给分)( 或者1.8给分)
(6)催化剂活性降低或温度升高副反应增多或M点之后反应(3已平衡,温度升高,平衡逆向移动,使甲醇
产量降低(其他合理答案亦可)
9【详解】
定共面的碳原子最多的是苯环平面,与苯环相连的3个碳原子一定在苯环平面内,所以一定共面的碳原子最
多有9个,故①正确;
②该物质含有羟基、羧基、酯基、碳碳双键共四种官能团,故②错误;
③碳碳双键与溴水发生加成反应,与酸性 溶液发生氧化反应,故③错误;
④ 该有机物分别与足量 或 反应,可生成 氢气、 二氧化碳,故④错误;
⑤碳碳双键能发生加成反应、加聚反应,羟基、羧基、酯基能发生取代反应,羟基、碳碳双键能发生氧化反
应,酯基能发生水解反应,故⑤正确
12【详解】
A.反应②能自发反应,放出能量,反应①不能自发反应,需要吸收能量,反应②释放的能量可以用于反应
①,故A正确;
B.由电子的流向可知,右边电极为正极,电极反应式: ,故B正确;
C.当消耗 时,根据电子得失守恒可知,必然消耗 ,正极电极反应式为
,溶液增重的质量等于 的质量与 的质量之和,为 故C正确;
D.负极区发生 和 ,正极区发生
,当脱除 时,转移 ,负极区消耗 ,双极膜中的水电离出
进入负极区,负极区 溶液碱性减弱,正极区消耗 ,双极膜中的水电离出
进入正极区,正极区 溶液酸性不变,故D错误;
15【详解】
A.由图2可知,该反应是气体体积不变的反应,由图1可知从开始到平衡A减少 ,C增加
,则B为生成物且增加 ,所以起始B的浓度为 ,故A正确;
B. 时刻,平衡逆向移动,平衡时反应物的转化率最小,故B正确;
C. 时刻 ,可能是降低温度 和 都下降,也可能是减小反应物浓度, 降低而 不变,故C错误;
D.A、B、C为气体,只有A一种反应物且反应体积不变,但由于起始三种物质并非按计量数投料,再充入
A时,与原平衡不等效,故A的百分含量发生了改变,故D错误;
故选C、D。
16【详解】
(1)本实验装置缺少的仪器是玻璃搅拌器:
(2)四组温度差 分别为 (舍去),则平均值为 ;生成水的物质
的量为 , ;中和热
(3)a.定容时俯视读数,所配盐酸浓度偏高,则盐酸的实际量偏高.放热较多,a错误;
b.把 溶液分多次倒入盛有盐酸的小烧杯,有部分热量散失,测得的热量会变小,b正确;
c.一水合氨是弱电解质,其电离的时候要吸热,故换成氨水后,测得的热量会变小,c正确;
d.本题需要的是温度差,故做本实验的当天室温较高,没有影响,d错误;
故选bc。
(4)忽略加入稀硫酸排出的气体体积
(5)为了较准确地测量氢气的体积,除了必须检查整个装置的气密性之外,在读取反应前后右管中液面的读
数,求其差值的过程中,应注意:①恢复到室温,②读数时要调节图2中左、右的液面使其同一高度;③读
数时视线要与凹液面最低处相平,据此分析解题。
a.视线与凹液面最低处相平,以保证读数准确,a符合题意:
b.等待片刻,待右管液面不再上升时读数,还需调节左、右两管液面相平再读数,b不符合题意;
c.读数时应上、下移动右管,使左、右两管液面相平,以保证内外压强一致,以保证气体的体积更加准确,
c符合题意;
d.反应结束立即读数,由于反应放热,里面气体膨胀,此时读数不准确,d不合题意;故答案为:ac;
(6) 的相对能量为 , 的相对能量为 , 的相对能量为
,因此反应的焓变 。
17【详解】
①n条件下, 的平均反应速率 ,
故本题答案为: ;
②m、n氢气起始物质的量相同,n到达平衡的时间短,说明反应速率大,平衡时氢气的物质的量减小,说明平衡正向移动,但容器体积恒定不变,不能是减小体积增大压强。因此,本题正确答案是:增大 的浓度;
(2)A.合成氨反应放热,升高温度平衡逆向移动,不利于平衡转化率的提高,故A错误:
B.当温度、压强一定时,在原料气( 和 的比例不变)中添加少量惰性气体,相当于减压,平衡逆向
移动,平衡转化率降低,故B错误;
C.基于 有较强的分子间作用力可将其液化,不断将液氨移去,降低氨气浓度,利于反应正向进行,但
生成物浓度减小,化学反应速率减慢故C错误;
D.分离空气可得 ,通过天然气和水蒸气转化可得 ,原料气须经过净化处理,以防止催化剂中毒和安
全事故发生,故D正确;
E.增大体系压强,反应速率加快,同时平衡正向移动,可以提高氨气的百分含量,符合题意;选DE。
(3)①该反应为放热反应,升高温度平衡逆向移动,逆反应平衡常数增大,则b表示逆反应的平衡常数与温
度变化关系;因而a就是正反应的平衡常数与温度变化关系
②平衡时 ,即 , , 时,
,
又因 ,可得 ;
(4)合成氨反应为放热反应,降低温度,反应速率减慢,平衡向正反应方向移动,氨气的体积分数增大,则
降低温度再次达到平衡时,符合题意的点为D,故答案为D:
18【详解】
(1)焙烧1中气体主要成分为 ,其中 会污染空气不能直接排放,故
选C
(2)①根据元素守恒配平可知,浸取 的化学方程式为
②温度控制在 到 低于 故采取水浴加热,采取此温度的原因是温度过低,浸取慢;温度过
高, 受热分解;
(3)抽滤”为减压过滤,与普通过滤相比,“抽滤的优点时过滤速度快,且所得固体较干燥;固液分离较完
全。故答案为AB;
(4)由于胆矾溶于水而不溶于乙醇,故减少了胆矾溶解损失;乙醇的沸点比水的低,故乙醇易挥发,有利于
干燥
(5)根据题意可知,废甲醇催化剂中 的质量为 ,所得产品 中含 的质量为,故 的提取率
19【详解】
由盖斯定律可知,反应①-②得到反应③,则反应 ;
(2)由反应③放热可知,升高温度,平衡常数 减小,则 增大, 增大,反应①和反应②的平
衡常数相等时, ,则反应③的 随的变化图为B,故选B;
(3)根据已知条件可知,平衡时反应的 为 ,生成甲醇为 ,反应①中生成水
蒸气为 ,消耗的 为 ,消耗的 为 ,反应②消耗的 为 ,消耗的
为 ,生成水蒸气和 各为 ,平衡时反应②中 为 , 为 , 为
,水蒸气为 ,求得
(4)①A.若加倍投料,恒容条件,体系压强变大,二氧化碳的平衡转化率增大,故A正确;
B.当 时,不符合化学计量数之比等于速率之比,正逆反应速率不相等,反应未达到平衡状态,
故B错误;
C.开始等物质的量投料, 的体积分数始终保持不变,不能说明反应已达到平衡,故C错误;
D.单位时间内,断开 键的数目和断开 键的数目不相同,因 和 中都有 键,因
此不可以判断反应已经达到平衡状态,D不符合题意;
故选A;
(5)反应②可自发进行, ,则反应②的 ,则 ;
根据题意,该反应平衡常数 ;假设原料气中 为 ,
为 ,由题意列三段式:
起始/ 1 x 0 0
转化/ 0.9 0.9 0.9 0.9平衡/ 0.1 0.9 0.9
则平衡常数 ,解得 ,故 与 的物质的量之比为 。
(6)在催化剂的作用下,温度高于 时,M点后甲醇的产率降低可能是催化剂活性降低,反应速率减
慢,导致产率降低;也可能是温度升高副反应增多,导致产率降低。