文档内容
2007 年上海高考化学真题及答案
第I卷(共66分)
相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32 K:39 Fe:56 Ba:137
一、选择题(本题共10分),每小题2分,只有一个正确选项,答案涂写在答题纸上。
1. 近期我国冀东渤海湾发现储量达10亿吨的大型油田。下列关于石油的说法正确的是
A 石油属于可再生矿物能源 B 石油主要含有碳、氢两种元素
C 石油的裂化是物理变化 D 石油分馏的各馏分均是纯净物
2. 235U是重要的核工业原料,在自然界的丰度很低。235 U的浓缩一直为国际社会关注。下
92 92
列有关235U说法正确的是
92
A 235U原子核中含有92个中子 B 235U原子核外有143个电子
92 92
C 235U与238U互为同位素 D 235235 U与238U互为同素异形体
92 92 92 92 92
3. 下列有关葡萄糖的说法错误的是
A 葡萄糖的分子式是CH O B 葡萄糖能发生银镜反应
6 12 6
C 葡萄糖是人体重要的能量来源 D 葡萄糖属于高分子化合物
4. 下列有关物理量相应的单位表达错误的是
A 摩尔质量g/mol B 气体摩尔体积L/mol
C 溶解度g/100g D 密度g/cm3
5. 请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
二、选择题(本题共36分),每小题3分,只有一个正确选项,答案涂写在答题纸上。
6. 下列过程或现象与盐类水解无关的是
A 纯碱溶液去油污 B 铁在潮湿的环境下生锈
C 加热氯化铁溶液颜色变深 D 浓硫化钠溶液有臭味
7. 离子检验的常用方法有三种:
检验方法 沉淀法 显色法 气体法
含义 反应中有沉淀产生或溶解 反应中有颜色变化 反应中有气体产生
下列离子检验的方法不合理的是
A NH+-气体法 B I--沉淀法 C Fe3+-显色法 D Ca2+-气体法
4
8. 下列反应的离子方程式正确的是
A 氢氧化钠溶液中通入少量二氧化硫:SO+OH-→HSO-
2 3
B 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO-+Ba2++OH-→BaCO↓+HO
3 3 2
C 盐酸滴入氨水中:H++OH-→HO
2
D 碳酸钙溶解于稀硝酸中:CO2-+2H+→CO↑+HO
3 2 2
9. 下列有关实验操作错误的是
A 用药匙取用粉末状或小颗粒状固体 B 用胶头滴管滴加少量液体
C 给盛有2/3体积液体的试管加热 D 倾倒液体对试剂瓶标签面向手心
10. 判断下列有关化学基本概念的依据正确的是
A 氧化还原反应:元素化合价是否变化 B 共价化合物:是否含有共价键
C 强弱电解质:溶液的导电能力大小 D 金属晶体:晶体是否能够导电
第1页 | 共10页11. 有关物质燃烧时火焰颜色描述错误的是
A 氢气在氯气中燃烧-苍白色 B 钠在空气中燃烧——黄色
C 乙醇在空气中燃烧——淡蓝色 D 硫在氧气中燃烧——绿色
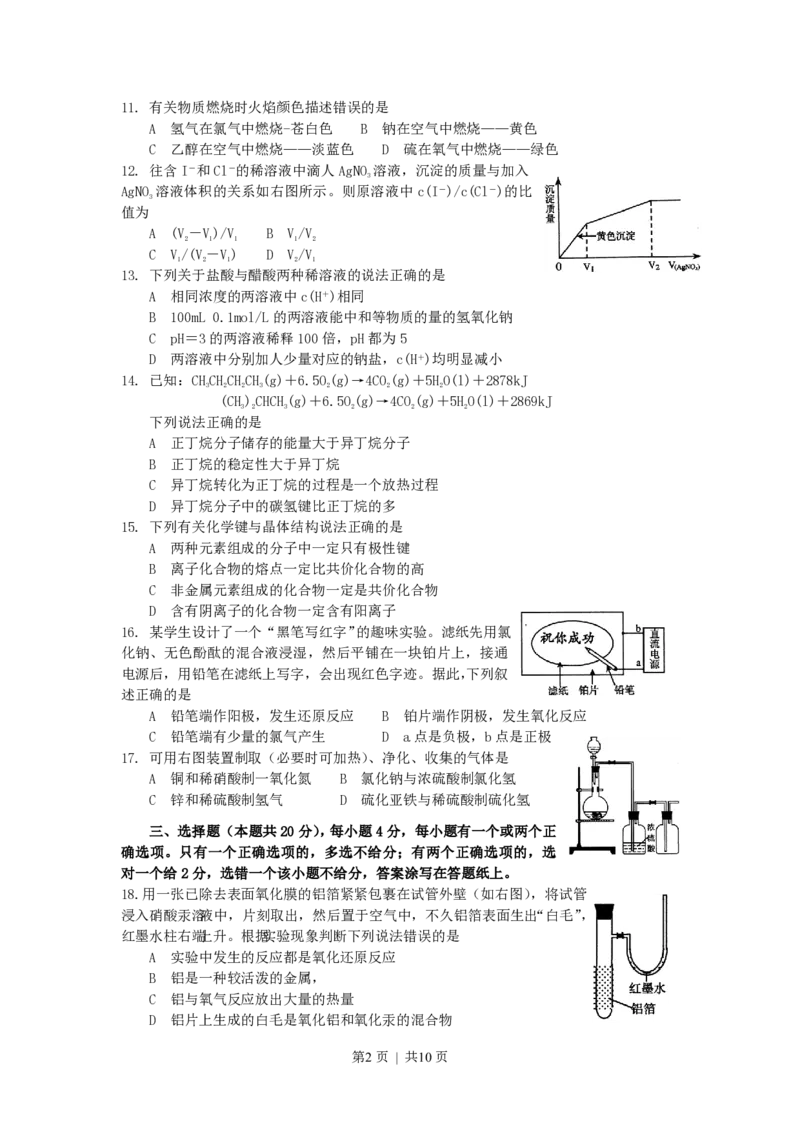
12. 往含I-和Cl-的稀溶液中滴人AgNO 溶液,沉淀的质量与加入
3
AgNO 溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比
3
值为
A (V-V)/V B V/V
2 1 1 1 2
C V/(V-V) D V/V
1 2 1 2 1
13. 下列关于盐酸与醋酸两种稀溶液的说法正确的是
A 相同浓度的两溶液中c(H+)相同
B 100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠
C pH=3的两溶液稀释100倍,pH都为5
D 两溶液中分别加人少量对应的钠盐,c(H+)均明显减小
14. 已知:CHCHCHCH(g)+6.5O(g)→4CO(g)+5HO(l)+2878kJ
3 2 2 3 2 2 2
(CH)CHCH(g)+6.5O(g)→4CO(g)+5HO(l)+2869kJ
3 2 3 2 2 2
下列说法正确的是
A 正丁烷分子储存的能量大于异丁烷分子
B 正丁烷的稳定性大于异丁烷
C 异丁烷转化为正丁烷的过程是一个放热过程
D 异丁烷分子中的碳氢键比正丁烷的多
15. 下列有关化学键与晶体结构说法正确的是
A 两种元素组成的分子中一定只有极性键
B 离子化合物的熔点一定比共价化合物的高
C 非金属元素组成的化合物一定是共价化合物
D 含有阴离子的化合物一定含有阳离子
16. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯
化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通
电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙
述正确的是
A 铅笔端作阳极,发生还原反应 B 铂片端作阴极,发生氧化反应
C 铅笔端有少量的氯气产生 D a点是负极,b点是正极
17. 可用右图装置制取(必要时可加热)、净化、收集的气体是
A 铜和稀硝酸制一氧化氮 B 氯化钠与浓硫酸制氯化氢
C 锌和稀硫酸制氢气 D 硫化亚铁与稀硫酸制硫化氢
三、选择题(本题共20分),每小题4分,每小题有一个或两个正
确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选
对一个给2分,选错一个该小题不给分,答案涂写在答题纸上。
18. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如右图),将试管
浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,
红墨水柱右端上升。根据实验现象判断下列说法错误的是
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属,
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
第2页 | 共10页19. 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下
列关于这两种有机化合物的说法正确的是
A 两种酸都能与溴水反应
B 两种酸遇三氯化铁溶液都显色
C 鞣酸分子与莽草酸分子相比多了两个碳碳双键
D 等物质的量的两种酸与足量金属钠反应产生氢气的量相同
20. 设N 为阿伏加德罗常数,下列叙述中正确的是
A
A 常温下11.2L的甲烷气体含有甲烷分子数为0.5N 个
A
B 14g乙烯和丙烯的混合物中总原子数为3N 个
A
C 0.1mol/L的氢氧化钠溶液中含钠离子数为0.1N 个
A
D 5.6g铁与足量的稀硫酸反应失去电子数为0.3N 个
A
21. 已知0.1mol/L的醋酸溶液中存在电离平衡:CHCOOH CHCOO-+H+要使溶液中c(H
3 3
+)/c(CHCOOH)值增大,可以采取的措施是
3
A 加少量烧碱溶液 B 升高温度 C 加少量冰醋酸 D 加水
22. 今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Cl-、Mg2+、Ba2
4
+、CO2-、SO2-,现取三份100mL溶液进行如下实验:
3 4
(1)第一份加入AgNO 溶液有沉淀产生
3
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl 溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀
2
质量为2.33g。根据上述实验,以下推测正确的是
A K+一定存在 B 100mL溶液中含0.01mol CO2-
3
C Cl-可能存在 D Ba2+一定不存在,Mg2+可能存在
第3页 | 共10页第II卷(共84分)
四、(本题共24分)
考生注意:23题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
23. (A)现有部分短周期元素的性质或原子结构如下表:
元素编号 元素性质或原子结构
T M层上有2对成对电子
X 最外层电子数是次外层电子数的2倍
Y 常温下单质为双原子分子,其氢化物水溶液呈碱性
Z 元素最高正价是+7价
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可
测定文物年代,这种同位素的符号是
(2)元素Y与氢元素形成一种离子YH+,写出该微粒的电子式 (用
4
元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表
述中能证明这一事实的是
a 常温下Z的单质和T的单质状态不同 b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧
化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是
。
(B)现有部分短周期元素的性质或原子结构如下表:
元素编号 元素性质或原子结构
T 单质能与水剧烈反应,所得溶液呈弱酸性
X L层p电子数比s电子数多2个
Y 第三周期元素的简单离子中半径最小
Z L层有三个未成对电子
(1)写出元素X的离子结构示意图 。
写出元素Z的气态氢化物的电子式 (用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是 (用元素符号表示),下列
表述中能证明这一事实的是
a 常温下氯气的颜色比T单质的颜色深
b T的单质通入氯化钠水溶液不能置换出氯气
c 氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之—。T、X、Y、Z四种元素的单质中化
学性质明显不同于其他三种单质的是 ,理由 。
24. 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO-+4H++3e→NO+2HO
3 2
KMnO、NaCO、CuO、Fe(SO) 四种物质中的一种物质(甲)能使上述还原过程发生。
4 2 3 2 2 4 3
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
第4页 | 共10页(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
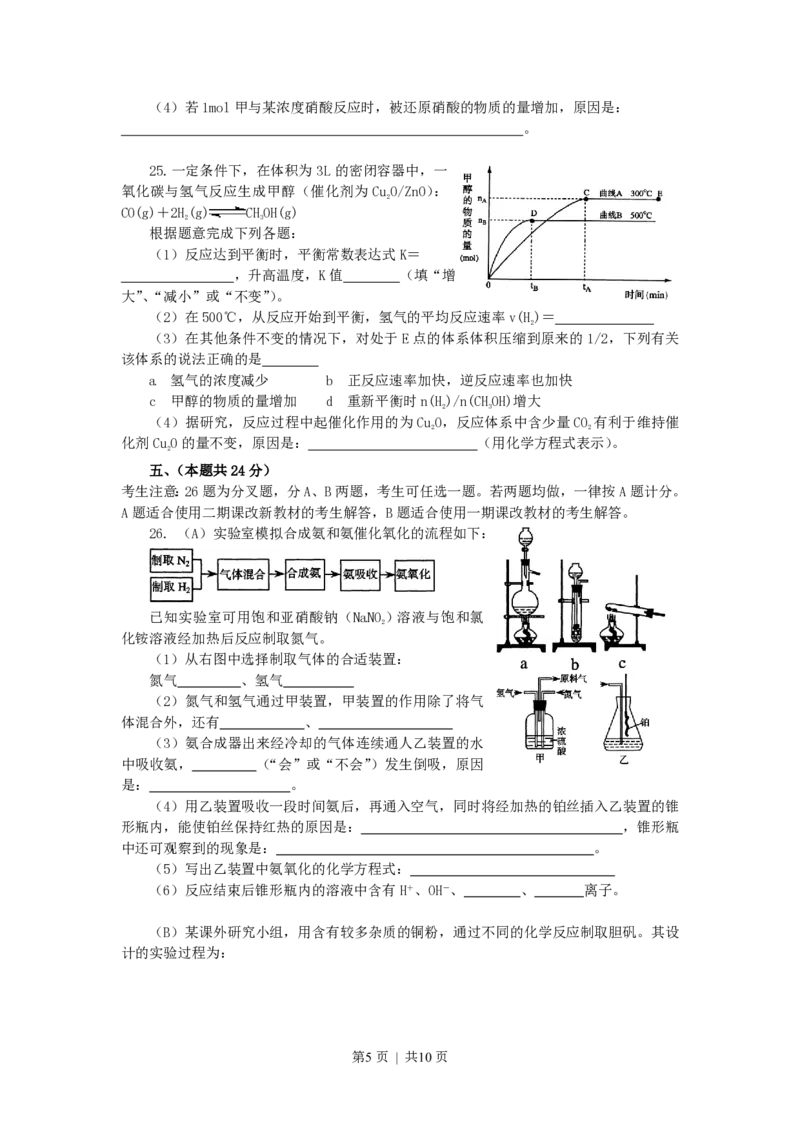
25. 一定条件下,在体积为3 L的密闭容器中,一
氧化碳与氢气反应生成甲醇(催化剂为CuO/ZnO):
2
CO(g)+2H(g) CHOH(g)
2 3
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=
,升高温度,K值 (填“增
大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H)=
2
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关
该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H)/n(CHOH)增大
2 3
(4)据研究,反应过程中起催化作用的为CuO,反应体系中含少量CO 有利于维持催
2 2
化剂CuO的量不变,原因是: (用化学方程式表示)。
2
五、(本题共24分)
考生注意:26题为分叉题,分A、B两题,考生可任选一题。若两题均做,一律按A题计分。
A题适合使用二期课改新教材的考生解答,B题适合使用一期课改教材的考生解答。
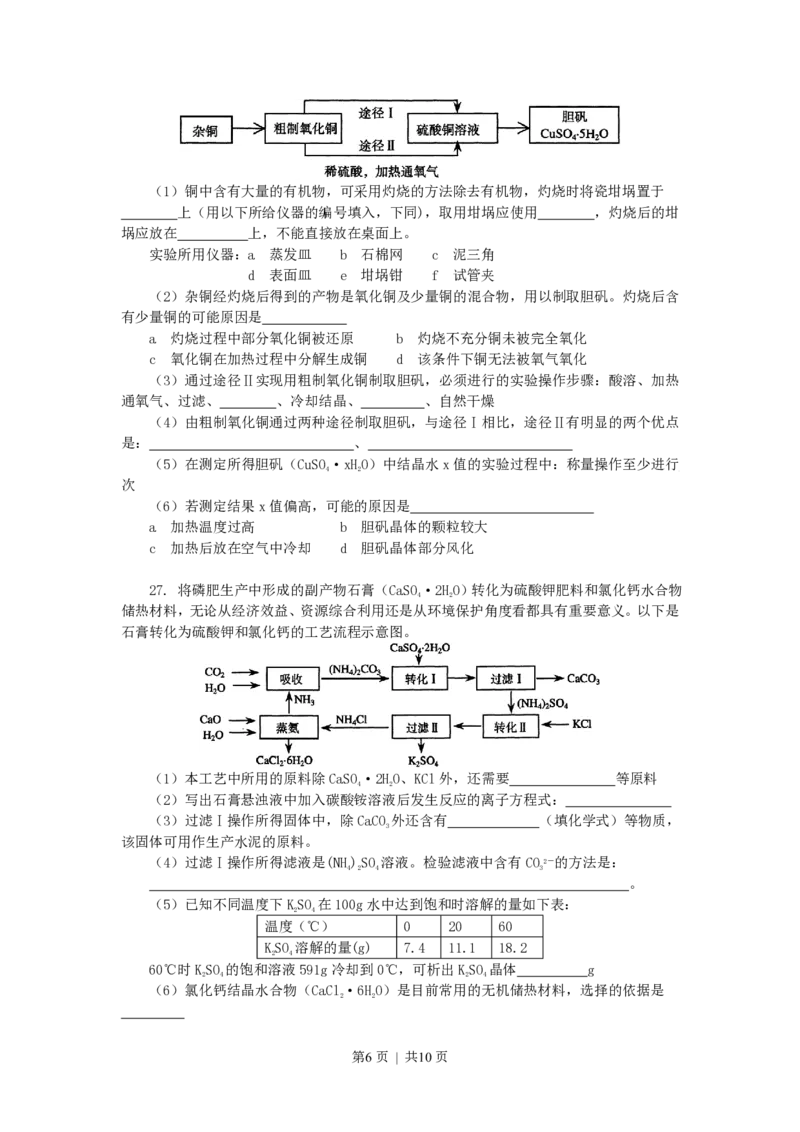
26. (A)实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO )溶液与饱和氯
2
化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:
氮气 、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气
体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的水
中吸收氨, (“会”或“不会”)发生倒吸,原因
是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥
形瓶内,能使铂丝保持红热的原因是: ,锥形瓶
中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
(B)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设
计的实验过程为:
第5页 | 共10页(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩
埚应放在 上,不能直接放在桌面上。
实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角
d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含
有少量铜的可能原因是
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热
通氧气、过滤、 、冷却结晶、 、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点
是: 、
(5)在测定所得胆矾(CuSO·xHO)中结晶水x值的实验过程中:称量操作至少进行
4 2
次
(6)若测定结果x值偏高,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 胆矾晶体部分风化
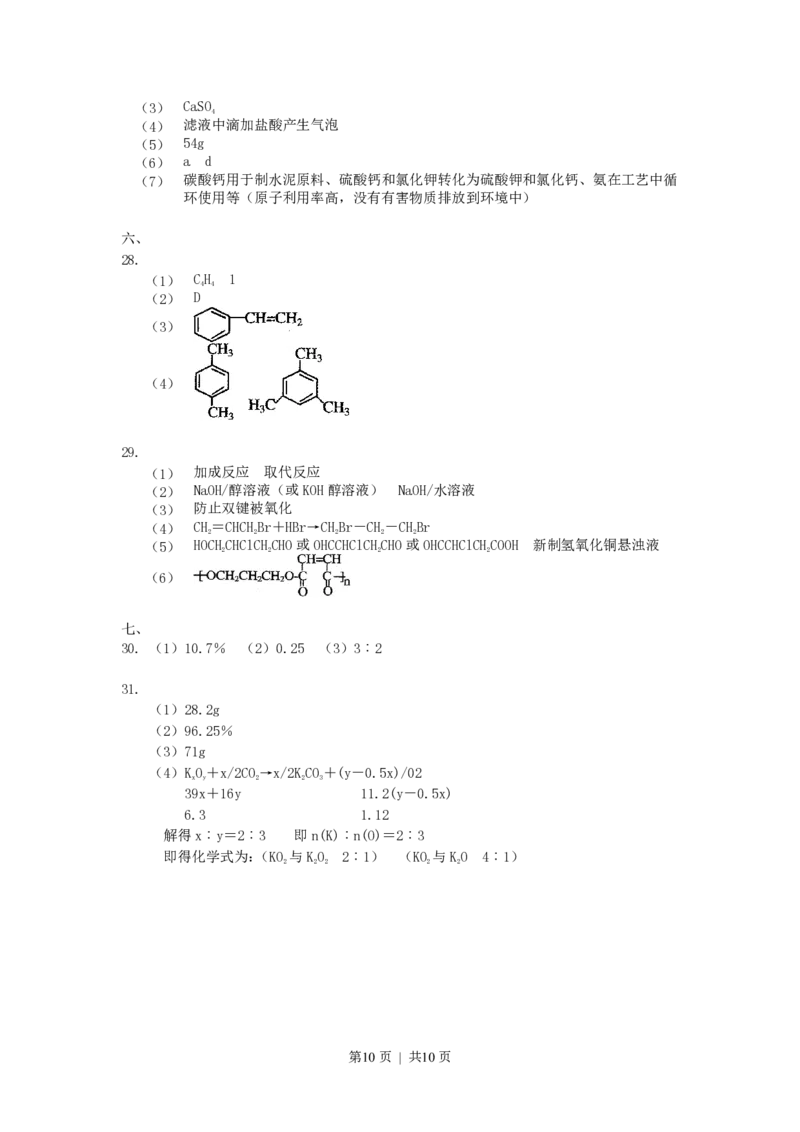
27. 将磷肥生产中形成的副产物石膏(CaSO·2HO)转化为硫酸钾肥料和氯化钙水合物
4 2
储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是
石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO·2HO、KCl外,还需要 等原料
4 2
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO 外还含有 (填化学式)等物质,
3
该固体可用作生产水泥的原料。
(4)过滤Ⅰ操作所得滤液是(NH)SO 溶液。检验滤液中含有CO2-的方法是:
4 2 4 3
。
(5)已知不同温度下KSO 在100g水中达到饱和时溶解的量如下表:
2 4
温度(℃) 0 20 60
KSO 溶解的量(g) 7.4 11.1 18.2
2 4
60℃时KSO 的饱和溶液591g冷却到0℃,可析出KSO 晶体 g
2 4 2 4
(6)氯化钙结晶水合物(CaCl·6HO)是目前常用的无机储热材料,选择的依据是
2 2
第6页 | 共10页a 熔点较低(29℃熔化) b 能导电 c 能制冷 d 无毒
(7)上述工艺流程中体现绿色化学理念的是: 。
六、(本题共20分)
28. 乙炔是一种重要的有机化工原料,以乙炔
为原料在不同的反应条件下可以转化成以下化合
物。完成下列各题:
(1)正四面体烷的分子式为 ,其二
氯取代产物有 种
(2)关于乙烯基乙炔分子的说法错误的是:
a 能使酸性KMnO 溶液褪色
4
b 1摩尔乙烯基乙炔能与3摩尔Br 发生加成反应
2
c 乙烯基乙炔分子内含有两种官能团
d 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):
、
29. 以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
请完成下列各题:
(1)写出反应类型:反应① 反应④
(2)写出反应条件:反应③ 反应⑥
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写
出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
七、(本题共16分)
30. 一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为
1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl):n(H)= 。
2 2
31. 钾是活泼的碱金属,钾和氧有氧化钾(KO)、过氧化钾(KO)和超氧化钾(KO)
2 2 2 2
等多种化合物。
(1)钾和硝酸钾反应可制得KO(10K+2KNO→6KO+N),39.0g钾与10.1g硝酸钾充
2 3 2 2
分反应生成KO的质量为 g。
2
第7页 | 共10页(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中KO 的质量分
2 2
数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO+2CO→2KCO+3O),在医院、矿井、
2 2 2 3 2
潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO 和KO 反应后,气体体积变为18.8L (标
2 2
准状况),计算反应消耗的KO 的质量。
2
(4)KO 加热至600℃部分分解得到产物A。6.30g产物A充分吸收二氧化碳生成碳酸
2
钾并产生氧气1.12L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含
有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。
第8页 | 共10页参考答案
一、1. B 2. C 3. D 4. C 5. B 6. B 7. D 8. B 9. C 10. A
二、11. D 12. C 13. B 14. A 15. D 16. D 17. B
三、18. D 19. AD 20. B 21. BD 22. AC
四、
23.
(A)(1)6 14C
6
(2)[ ]+
(3)Cl b
(4)HCO 弱酸性或非氧化性酸
2 3
(B)(1)
(2)H++AlO-+HO Al(OH) A13++3OH-
2 2 3
(3)F c
(4)Al 具有金属性
24. (1)14HNO+3CuO→6Cu(NO)+2NO↑+7HO
3 2 3 2 2
(2)酸性 氧化性
(3)0.6mol
(4)使用了较浓的硝酸,产物中有部分二氧化氮生成
25. (1)K=c(CHOH)/c(CO)·c2(H) 减小
3 2
(2)2n/3tmol·(L·min)-1
B B
(3)b c
(4)CuO+CO 2Cu+CO
2 2
五、
26. (A)(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH 十5O 4NO+6HO
3 2 2
(6)NH+ NO-
4 3
(B)(1)c e b
(2)a b
(3)蒸发 过滤
(4)产生等量胆矾途径Ⅱ消耗硫酸少 途径Ⅱ不会产生污染大气的气体
(5)4
(6)a
27.
(1) CaCO NH HO
3 3 2
(2) CaSO+CO2-→CaCO↓+SO2-
4 3 3 4
第9页 | 共10页(3) CaSO
4
(4) 滤液中滴加盐酸产生气泡
(5) 54g
(6) a d
(7) 碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循
环使用等(原子利用率高,没有有害物质排放到环境中)
六、
28.
(1) CH 1
4 4
(2) D
(3)
(4)
29.
(1) 加成反应 取代反应
(2) NaOH/醇溶液(或KOH醇溶液) NaOH/水溶液
(3) 防止双键被氧化
(4) CH=CHCHBr+HBr→CHBr-CH-CHBr
2 2 2 2 2
(5) HOCHCHClCHCHO或OHCCHClCHCHO或OHCCHClCHCOOH 新制氢氧化铜悬浊液
2 2 2 2
(6)
七、
30. (1)10.7% (2)0.25 (3)3︰2
31.
(1)28.2g
(2)96.25%
(3)71g
(4)KO+x/2CO→x/2KCO+(y-0.5x)/02
x y 2 2 3
39x+16y 11.2(y-0.5x)
6.3 1.12
解得x︰y=2︰3 即n(K)︰n(O)=2︰3
即得化学式为:(KO 与KO 2︰1) (KO 与KO 4︰1)
2 2 2 2 2
第10页 | 共10页