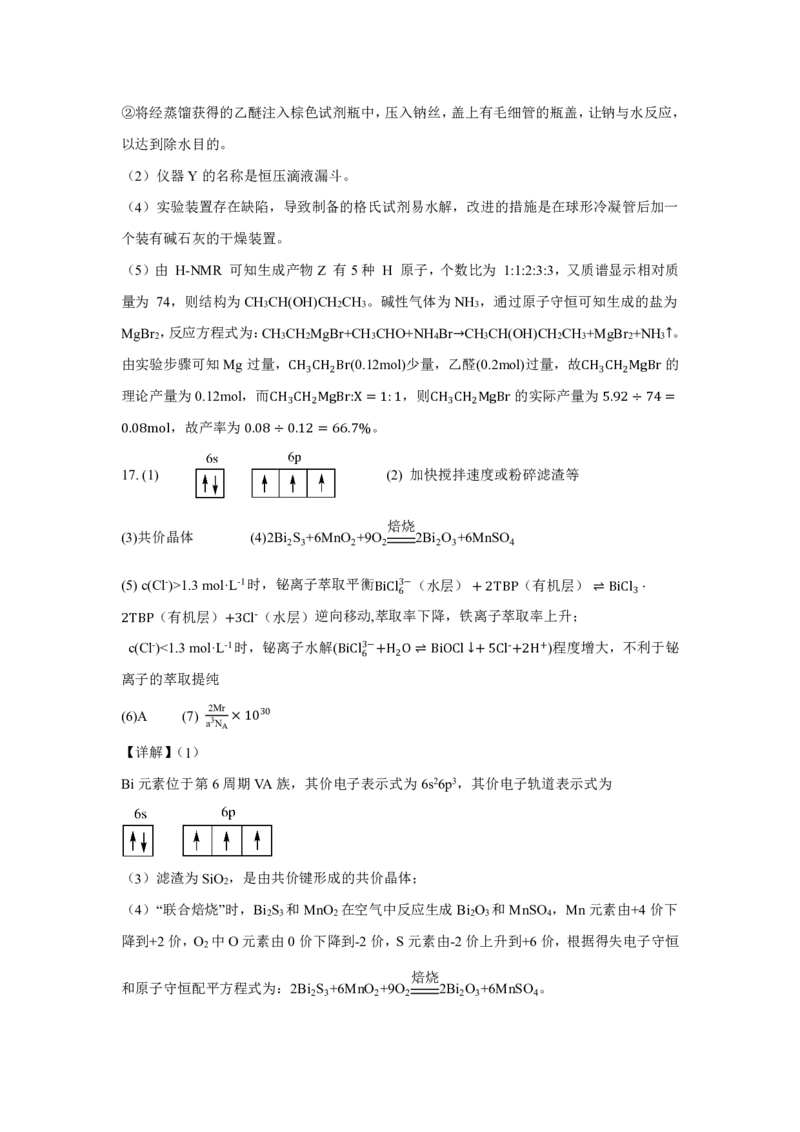文档内容
湖北省“腾•云”联盟2024-2025学年度上学期8月联考
高三化学试卷
1.B
【详解】A.淀粉在无氧环境下发酵生成乙醇,可用富含淀粉的谷物来酿酒,而淀粉水解是
生成葡萄糖,不能水解得到乙醇,故A错误;
B.铁发生吸氧腐蚀时,正极上O 得电子结合水生成氢氧根离子,清洗铁锅后及时擦干,
2
除去了铁锅表面的水分,没有了电解质溶液,能减缓铁锅因发生吸氧腐蚀而生锈,B正确;
C.食用纯碱主要成分为Na CO ,制作面点时加入食用纯碱,利用了Na CO 中和发酵过程
2 3 2 3
产生的酸,C错误;
C.真丝织品的主要成分是蛋白质,加酶洗衣粉不宜洗涤真丝织品,是因为酶使真丝中的蛋
白质水解,选项D错误;
故选:B。
2.B
答案:B
解析A.CCl 分子是正四面体结构,且Cl原子半径大于C,其空间填充模型为 ,
4
故A错误;
B.氢键的表示方法为X-HY,X和Y都应该是电负性强的原子,用氢键表示法表示邻羟
基苯甲醛分子内氢键为 ,B正确;
C.用电子式表示MgCl 的形成过程为: ,
2
C错误;
D.一个维纶的链节需要2个聚乙烯醇的链节和1分子甲醛发生缩合,脱去1分子水,所以
反 应 的 方 程 式 为 : +nHCHO
一定条件
+nH O,D项错误
2
3.D
【详解】A.酚醛树脂是由酚类和甲醛缩聚成的,不含酯基,不属于聚酯,A错误。
B.合金熔点一般低于成分金属而硬度大于成分金属,钢的熔点比铁低,B错误;C.碳纳米管属于碳单质,不是胶体分散系,C错误;
D.稀土金属能大大改善合金的性能,使得合金性能更为优良,因而稀土元素又被称为“冶
金工业的维生素,D正确;
故选:D。
4.D
B.表面活性剂在水面形单分子膜,破坏了水分子间的氢键,所以表面活性剂可以降低水的
表面张力,故B正确;
C.聚乳酸含有酯基发生水解反应,可用作可降解的材料,可用于免拆型手术缝合线、人造
皮肤支架,故C正确;
D.石墨中层与层之间存在微弱的范德华力,易滑动,起润滑作用,D错误
5.B
【详解】A.AgCl浊液中通入H S变黑,生成硫化银和盐酸,反应的离子方程式为:
2
2AgClH S=Ag S2H 2Cl,选项A正确;
2 2
B.ClF中F为−1价,则ClF与NaOH溶液反应:CIF2OH ClOFH O,故B错误;
2
C.向含Mn2+的溶液中加入足量的NH HCO 溶液沉锰:Mn2++2HCO-=MnCO ↓+CO ↑+H O,
4 3 3 3 2 2
C正确;
D .工业上,可通过电解KF的无水溶液(含F-和HF离子)制取F ,阴极得到电子,发生还
2 2
原反应,因此制F 时HF在阴极放电,电极方程式为:2HF+2e-=H ↑+4F-,D正确;
2 2 2 2
故选:B。
6.C
【详解】A.298K时甲醇是液体,①是焓减熵减的反应,故A错误;
B.淀粉是高分子聚合物,含有的羟基数目不是3N ,B错误
A
C.DHA中sp3杂化的原子为2个亚甲基中的碳原子和2个羟基中的氧原子,共4个原子,
即4N ,C正确;
A
D.CH OH被氧化生成1个HCHO转移2个电子,则生成1molHCHO转移电子数为2mol,
3
即2N ,D错误;
A
故选:C。7.A
【详解】A.在第三能层中最多有9个原子轨道,最多可填充18个电子,故自旋状态相同
的电子最多有9个,故A错误;
B.在元素周期表中,非金属元素不都在p区,如H在s区,故B正确;
C.基态氮原子价电子排布式为2s22p12p12p1,若基态氮原子价电子排布式为2s22p22p1,
x y z x y
则违反洪特规则,故C正确;
D.某元素原子由基态跃迁到激发态得到吸收光谱,故D正确;
故选:A。
8.B
【详解】A.腺嘌噙核苷酸中有磷酸二氢根具有酸性,有氨基具有碱性,故A正确;
B.腺嘌呤核苷酸水解生成的戊糖是核糖,核磁共振氢谱有9组峰,B错误;
C.腺嘌呤核苷酸水解生成的碱基是腺嘌呤,分子式为C H N ,C正确;
5 5 5
D.腺嘌呤核苷酸中的手性碳原子如图所示 ,所以1mol腺嘌
呤核苷酸4mol手性碳原子,故D正确;
故选:C。
9.A
【详解】A.一般情况下,在铁制品上镀铜时用纯铜作阳极,电极反应为:Cu-2e-=Cu2+,电
解质溶液为CuSO 溶液,铁作阴极,电极反应为:Cu2++2e-=Cu,但若用CuSO 和过量氨水
4 4
作电解质溶液,加入氨水可以形成铜氨络离子,使游离的铜离子浓度维持在一个稳定的状态,
此时镀上的镀铜层会更一致,镀层的孔隙率下降,使铁制品上镀致密铜镀层,A正确;
B.容量瓶不宜用于溶解固体,B错误;
C.该反应实验现象不明显,不能用该实验探究浓度对化学反应速率的影响,C错误;
D.过量银氨溶液呈碱性,Br 与OH-反应褪色,而不能说明是碳碳双键的缘故,D错误;
2
故选:A。
10.C【详解】A.该有机物含3个碳碳双键,且每个双键碳原子所连的基团均不同,均存在立体
异构,有顺反异构,且分子结构中含有3种含氧官能团羰基、羧基、羟基,A正确;
B.脱落酸中只有羧基能和NaOH反应,B正确;
C.脱落酸分子结构中存在羟基和羧基,其发生分子内酯化反应构成环状酯,所得结构中存
在一个六元环和一个七元环,C错误;
D.脱落酸分子结构中存在共轭结构,当1mol脱落酸与1mol H 发生加成反应时,可通过
2
1,2-加成的方式得到3种不同的产物,还可通过发生类似1,4-加成的反应得到1种不同于之
前的产物,1个羰基也可以与1mol H 发生加成共得到1种不同的产物,D正确;
2
故答案为:C。
11.D
【详解】A.灼烧固体应在坩埚中,不能用蒸发皿,A错误;
C.分液时,先使下层液体从下口流出,再将上层液体从上口倒出,用苯萃取,苯的密度小
于水,故有机相在上层,水相在下层,故应先从下口放出水相,再从上口倒出有机相,B错
误;
C.过滤时搅拌易捣破滤纸,应使水自然流下,操作不合理,C错误;
D.从有机相蒸馏分离出溴,应选蒸馏烧瓶、直形冷凝管等仪器,球形冷凝管易残留馏分,
D正确:
故选:D。
12.C
【详解】A.氨硼烷属于分子晶体,为极性分子,分子间易形成氢键,故A正确;
B.由反应原理可知,水解过程中B原子所连的H原子被-OH取代,用D O代替H O作反
2 2
应物,有HD生成,故B正确;
C.电负性N>H>B,P>Ni,所以B上所连H带负电性、N上所连H带正电性、P带负电性、
Ni带正电性,因为不同电性间原子相互吸引,所以B、N上所连H只能分别吸附在Ni和P
上 ;C错误;
D.由反应原理可知,水解过程中B原子所连的H原子被-OH取代,最终得到H 和
2
NH
4
BOH
4
,故D正确;
故答案选C。13.B
【详解】A.由图可知,CaF 晶胞中F-填充在相邻4个Ca2+形成的四面体空隙中,A正确;
2
B.由于CaF 晶体中钙离子、氟离子交替排列,所以假设这个晶胞的体心上是Ca2+,那么
2
三个顶点就是F-,则每个F-周围距离相等且最近的F-有6个,故B错误;
C.若A处原子分数坐标为(0,0,0),C点处于四面体填隙,根据立体几何关系,则B处
1 1 3
原子分数坐标为( , , ),故C正确;
4 4 4
D.三种氟化物均为离子晶体,晶体提供自由氟离子的能力越强,阴阳离子间形成离子键越
弱,钡离子、钙离子、镁离子的电荷数相同,离子半径依次减小,则BaF 、CaF 、MgF 三
2 2 2
种晶体中的离子键依次增强,晶体提供自由氟离子的能力依次减弱,脱硅能力依次减弱,即
脱硅能力BaF >CaF >MgF ,故D正确;
2 2 2
故选:B。
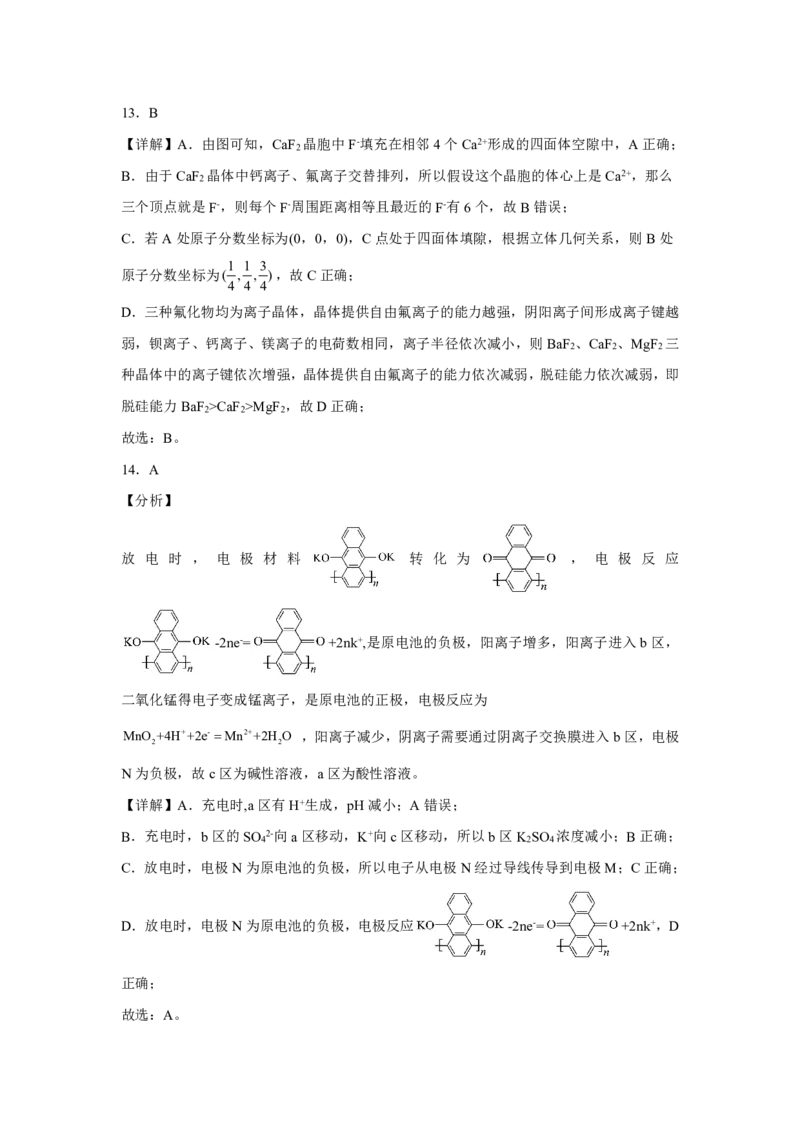
14.A
【分析】
放 电 时 , 电 极 材 料 转 化 为 , 电 极 反 应
-2ne-= +2nk+,是原电池的负极,阳离子增多,阳离子进入b区,
二氧化锰得电子变成锰离子,是原电池的正极,电极反应为
MnO +4H++2e- Mn2++2H O ,阳离子减少,阴离子需要通过阴离子交换膜进入b区,电极
2 2
N为负极,故c区为碱性溶液,a区为酸性溶液。
【详解】A.充电时,a区有H+生成,pH减小;A错误;
B.充电时,b区的SO 2-向a区移动,K+向c区移动,所以b区K SO 浓度减小;B正确;
4 2 4
C.放电时,电极N为原电池的负极,所以电子从电极N经过导线传导到电极M;C正确;
D.放电时,电极N为原电池的负极,电极反应 -2ne-= +2nk+,D
正确;
故选:A。15.B
c
CO2
【详解】A.H CO 的K = 3 ×c(H+),图中pH=8.3时c(H CO )=c(CO2),此时
2 3 a2 c HCO 2 3 3
3
K •K =c2(H+)=(10-8.3)2,得到H CO 的K =10-10.3,A错误;
a1 a2 2 3 a2
B.NH HCO 溶液中电荷守恒关系为c(OH-)+2c(CO2)+c(HCO)=c(NH)+c(H+),物料守恒
4 3 3 3 4
关系为c(H CO )+c(CO2)+c(HCO)=c(NH)+c(NH ⋅ H O),则
2 3 3 3 4 3 2
c(OH-)+c(NH ⋅ H O)+c(CO2)=c(H CO )+c(H+),pH=7.8时,c(OH-)>c(H+),
3 2 3 2 3
c(NH ⋅ H O)+c(CO2)1.3mol·L-1时,铋离子萃取平衡 (水层) (有机层)
3−
(有机层) (水层)逆向移动,B萃iC取l6率下降,铁+离2子T萃BP取率上升; ⇌ BiCl3⋅
-
2cT(BCPl-)<1.3mol·L+-1时3C,l 铋离子水解( )程度增大,不利于铋
3− - +
离子的萃取提纯 BiCl6 +H2O ⇌BiOCl↓+5Cl+2H
2Mr
(6)A (7)
a3NA
30
×10
【详解】(1)
Bi元素位于第6周期VA族,其价电子表示式为6s26p3,其价电子轨道表示式为
(3)滤渣为SiO ,是由共价键形成的共价晶体;
2
(4)“联合焙烧”时,Bi S 和MnO 在空气中反应生成Bi O 和MnSO ,Mn元素由+4价下
2 3 2 2 3 4
降到+2价,O 中O元素由0价下降到-2价,S元素由-2价上升到+6价,根据得失电子守恒
2
焙烧
和原子守恒配平方程式为:2Bi S +6MnO +9O 2Bi O +6MnSO 。
2 3 2 2 2 3 4(6)为使萃取充分,萃取时边搅拌边将有机相溶液滴加到草酸溶液中,答案选A;
(7)根据“均摊法”,晶胞中含 个Bi、6个O,则晶体化学式为Bi O ,密
2 3
1 1
8×8+6×2=4
度为 。
2Mr
NA 30 −3 2Mr 30 −3
3 3
18.(1a) ×10乙基g⋅cm =a N(A2×) 10 4g-⋅羟cm基丁醛 6
催化剂
(3) +O +H O
2 2
→△
(4) 加成反应 取代反应
(5) ① B ②
【详解】(1)甲苯中甲基使苯环上与甲基邻、对位的氢原子活化,硝基苯中硝基使苯环上与
硝基间位的氢原子活化,结合A的结构简式,可知最好先引入乙基
(2)OHC CH CH CH OH主链上有4个碳原子,根据系统命名的方法可知
2 2 2
OHC CH−CH CH OH为4-羟基丁醛。能与NaOH溶液的化合物分为羧酸和酯两类,属于
2 2 2
−
羧酸的有HOOCH CH CH 、 ;属于酯的有HCOOCH CH CH 、
2 2 3 2 2 3
CH COOCH CH 、CH CH COOCH 共有6种。
3 2 3 3 2 3
(3)根据分析可知,F为 ,F在催化剂和加热条件下和氧气发生氧
催化剂
化反应转化为G,化学方程式为: +O +H O。
2 2
→△
(4)由分析可知,D先与H中羰基之间发生加成反应,得到 ,
然后两个羟基之间脱水形成环醚得到P,形成环醚的反应属于取代反应。
(5)①根据分子中所有原子共平面,可知氮原子采取sp2杂化,氮原子上的孤电子未参与
杂化,形成的是p轨道;
②柯氏试剂M的化学式为:C H NO,该步反应的另一种产物是水,对比吲哚、红色的玫
9 11瑰吲哚结构可推知M的结构简式为: 。
19.(1)C H++H O=C H O+ 或 C H++2H O=C H O++H O (2)D
2 5 2 2 7 2 5 2 2 7 2
(3)−72.4kJ/mol
(4)氢酯比大于8,大量的H 吸附在催化剂的表面,阻碍了催化剂吸附乙酸甲酯,导致乙酸
2
甲酯的转化率减小
(5)0.006
(6)C H OH+3H O−12e-=2CO ↑+12H+ 33.33
2 5 2 2
【详解】(1)反应所需活化最小的是第二步,第二步反应速率最快,反应物分子有效碰撞几
率最大,该反应方程式为C H++H O=C H O+,故答案为:第二步;C H++H O=C H O+;(2)
2 5 2 2 7 2 5 2 2 7
若其他条件不变时,降低温度,正逆反应速率均减小,而浓度在那瞬间是不变的,所以k 、
正
k 均减小,再根据能量图,C H (g)H O(g)C H OH(g)反应物总能量大于生成物,为
逆 2 4 2 2 5
放热反应,降低温度,平衡正移,逆反应速率减小的更多,即k 减小的倍数小于k ,d合
正 逆
理。故答案选:D。
(3)燃烧热是1mol物质完全燃烧生成稳定产物的放热,通过盖斯定律,反应①可以由
CH COOCH 燃烧反应+H 燃烧反应×2-C H OH燃烧反应-CH OH燃烧反应得到,故可以算
3 3 2 2 5 3
出ΔH =-1593.4kJ/mol+(−285.8kJ/mol)×2−(−1366.8kJ/mol)−(−725.8kJ/mol)=−72.4kJ/mol。
1
(4)由题目提示,固体催化剂作用下的反应速率与催化剂表面各反应物的吸附率有关,故
氢酯比小于8,乙酸甲酯及H 均有较大的吸附率,增大氢酯比,H 的吸附率增大,使乙酸
2 2
甲酯转化率增大(或增大氢酯比,平衡正向移动,乙酸甲酯转化率增大);氢酯比大于8,大
量的H2吸附在催化剂的表面,阻碍了催化剂吸附乙酸甲酯,导致乙酸甲酯的转化率减小,
故氢酯比为8附近,乙酸甲酯的转化率最大。
(5)由反应①和反应②知,压强减小是反应①造成,设反应①中CH COOCH 反应amol,
3 3
列出三段式:
CH COOCH (g) + 2H (g) C H OH(g) + CH OH(g)
起始 mol 3 3 2 2 5 3
转化 mol a a ⇌ a a
平衡 mol 1 a 3 a 0a 0a
2
1− 3−21-a+3-2a+a+a = 4-a = 90MPa,解得a=0.4,设反应②中CH COOCH 反应bmol,根据反应②的方式
3 3
1+3 4 100MPa
化学计量数,反应②中H 也反应bmol,根据达到平衡时H 的分压为CH COOCH 分压的
2 2 3 3
5倍,1-a-b = ,解得b=0.2,则平衡时CH OH、C H OH、H 、CH COOCH 物质的量分别
3 2 5 2 3 3
3-2a-b
1
为0.4mol、2 5 mol、0.4mol、0.6mol,气体总物质的量为3.6mol,反应①的平衡常数
p p
总 总
K p =0.4 0.6 = MPa 。
3.6p ×3p.6
总 −1
0.4 2 2 0.006
3.6 × 3.6
(6)①燃料电池,燃料通负极,故通入甲醇的一级为负极,失电子转化为CO ,负极反应
2
为C H OH+3H O−12e-=2CO ↑+12H+;
2 5 2 2
②根据负极电极反应,转移12mol电子生成2molCO 和12molH+,氢离子通过质子交换膜
2
进入正极区,减少质量88+12=100g,故转移4mol电子减少质量33.33g。