文档内容
第六章 化学反应与能量
第二节 化学反应速率与限度
第1课时 化学反应的速率
1.下列关于化学反应速率的说法,不正确的是 ( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率的大小主要取决于反应物的性质
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1
2.反应4NH (g)+5O(g)===4NO(g)+6HO(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加
3 2 2
了0.45 mol,则此反应的速率可表示为 ( )
A.v(NH )=0.01 mol·L-1·s-1
3
B.v(O )=0.001 mol·L-1·s-1
2
C.v(NO)=0.001 mol·L-1·s-1
D.v(H O)=0.045 mol·L-1·s-1
2
3.已知某反应的各物质浓度数据如下:
aA(g)+bB(g)2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是 ( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
4.反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol·L-1·min-1;
②v(B)=0.45 mol·L-1·min-1;
③v(C)=0.015 mol·L-1·min-1;
④v(D)=0.45 mol·L-1·min-1
则此反应在不同条件下进行最快的是( )
A.②③ B.①③ C.②④ D.②
5.向四个体积相同的密闭容器中分别充入一定量的 SO 和O ,开始反应时,按反应速率由大到小的排
2 2
列顺序正确的是( )甲:500 ℃,10 mol SO 和5 mol O 反应
2 2
乙:500 ℃,VO 作催化剂,10 mol SO 和5 mol O 反应
2 5 2 2
丙:450 ℃,8 mol SO 和5 mol O 反应
2 2
丁:500 ℃,8 mol SO 和5 mol O 反应
2 2
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
6.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为
结论不正确的是( )
A.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电
池,可看到有氢气生成
B.将除去氧化膜的大小相同、质量相同的镁条和铝条与相同浓度盐酸反应,前者速率大于后者
C.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生
氧气的快慢不同
D.相同条件下等质量的块状和粉末状大理石与相同浓度盐酸反应时,粉末状的反应速率快
7.在2A+B3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
8.反应A+3B===2C+2D在四种不同情况下的反应速率可分别为
①v(A)=0.15 mol/(L·s) ②v(B)=0.6 mol/(L·s)
③v(C)=0.4 mol/(L·s) ④v(D)=0.45 mol/(L·s)
该反应进行的快慢顺序为________。
9.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活
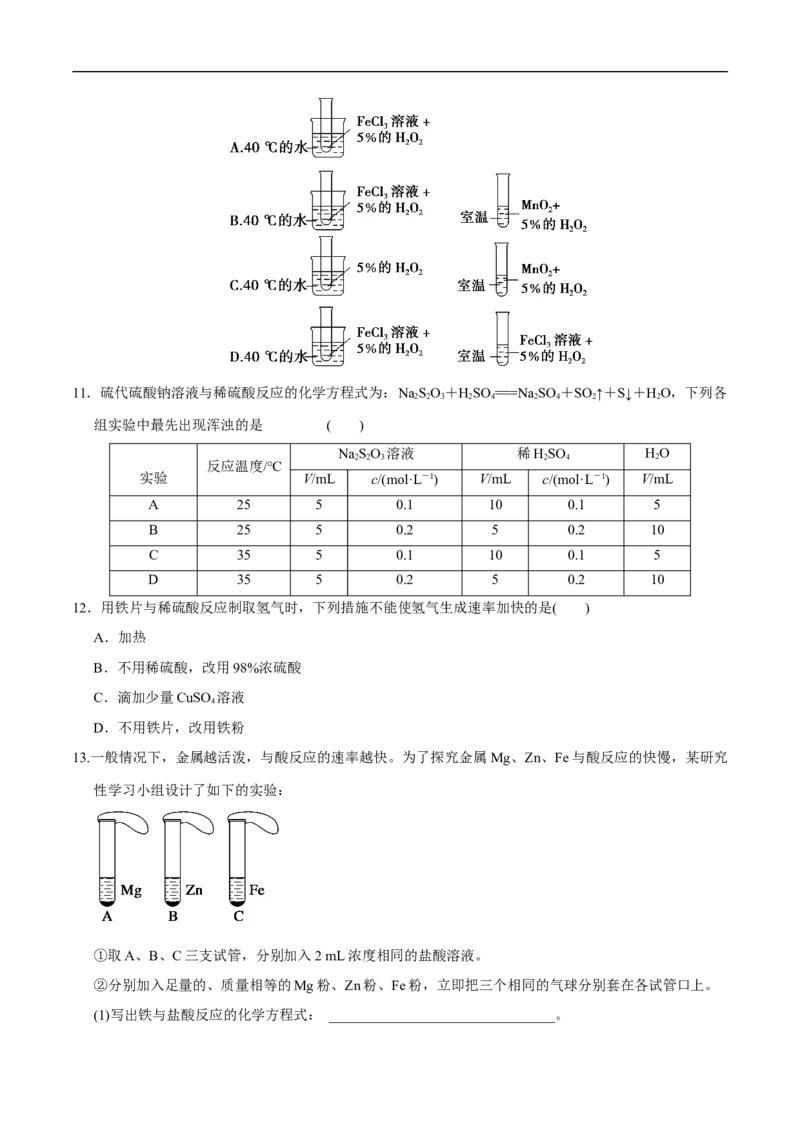
质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是 ( )
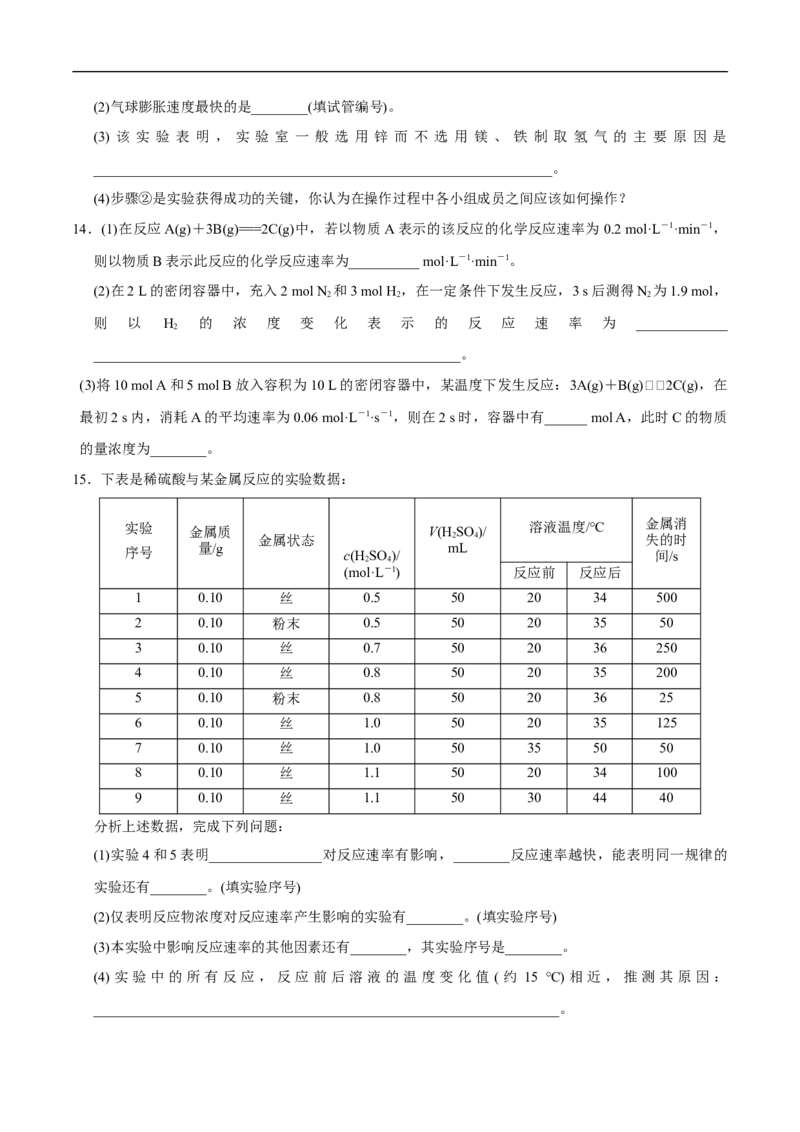
10.为了探究温度对化学反应速率的影响,下列实验方案可行的是 ( )11.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:NaSO+HSO ===Na SO +SO ↑+S↓+HO,下列各
2 2 3 2 4 2 4 2 2
组实验中最先出现浑浊的是 ( )
NaSO 溶液 稀HSO HO
2 2 3 2 4 2
反应温度/℃
实验 V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
12.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO 溶液
4
D.不用铁片,改用铁粉
13.一般情况下,金属越活泼,与酸反应的速率越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究
性学习小组设计了如下的实验:
①取A、B、C三支试管,分别加入2 mL浓度相同的盐酸溶液。
②分别加入足量的、质量相等的Mg粉、Zn粉、Fe粉,立即把三个相同的气球分别套在各试管口上。
(1)写出铁与盐酸反应的化学方程式: ________________________________。(2)气球膨胀速度最快的是________(填试管编号)。
(3) 该 实 验 表 明 , 实 验 室 一 般 选 用 锌 而 不 选 用 镁 、 铁 制 取 氢 气 的 主 要 原 因 是
_________________________________________________________________。
(4)步骤②是实验获得成功的关键,你认为在操作过程中各小组成员之间应该如何操作?
14.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示的该反应的化学反应速率为 0.2 mol·L-1·min-1,
则以物质B表示此反应的化学反应速率为__________ mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N 和3 mol H ,在一定条件下发生反应,3 s后测得N 为1.9 mol,
2 2 2
则 以 H 的 浓 度 变 化 表 示 的 反 应 速 率 为 _____________
2
____________________________________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在
最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有______ mol A,此时C的物质
的量浓度为________。
15.下表是稀硫酸与某金属反应的实验数据:
实验 金属质 V(H SO )/ 溶液温度/℃ 金属消
金属状态 2 4 失的时
序号 量/g c(H SO )/ mL 间/s
2 4
(mol·L-1) 反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 36 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 100
9 0.10 丝 1.1 50 30 44 40
分析上述数据,完成下列问题:
(1)实验4和5表明________________对反应速率有影响,________反应速率越快,能表明同一规律的
实验还有________。(填实验序号)
(2)仅表明反应物浓度对反应速率产生影响的实验有________。(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化 值 (约 15 ℃) 相近,推测其原因:
__________________________________________________________________。