文档内容
6.2.1 化学反应的速率 练习(解析版)
1.下列关于化学反应速率的说法,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.单位时间内某物质的浓度变化大,则该物质反应就快
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1
【答案】C
【详解】
A、化学反应速率是衡量化学反应进行快慢程度的物理量,正确;
B、化学反应速率是用单位时间物质的浓度变化来表示,故浓度变化大则该物质反应就快,正确;
C. 反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示,而不是物质的质量,C不正
确;
D. 化学反应速率是浓度除以时间,所以常用单位有mol·L-1·s-1和mol·L-1·min-1,正确。故答案选C。
2.在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,
则10s内生成硫酸铝的平均反应速率是( )
A.0.02 mol/(L•min) B.1.2 mol/(L•min)
C.1.8mol/(L•min) D.0.18 mol/(L•min)
【答案】B
【详解】
铝与稀硫酸的反应方程式为:2Al+3H SO =Al(SO )+3H ↑,10s末硫酸的浓度减少了0.6mol•L-1,则
2 4 2 4 3 2
v(H SO )= =0.06mol/(L•s),速率之比等于化学计量数之比,故v[Al(SO )]= v(H SO )=
2 4 2 4 3 2 4
×0.06mol/(L•s)=0.02mol/(L•s),即v[Al(SO )]=0.02mol/(L•s)=1.2mol/(L•min),故选B。
2 4 3
3.下列方法对2SO (g)+O(g) 2SO (g)的反应速率没有影响的是
2 2 3
A.加入SO B.容积不变,充入N
3 2
C.压强不变,充入N D.降低温度
2
【答案】B
【详解】
A选项,加入SO ,生成物浓度增大,反应速率增大,故A错误;B选项,容积不变,充入N,反应体系
3 2中各物质浓度不变,则反应速率不变,故B正确;C选项,压强不变,充入N,反应体系的体积增大,相
2
当于压强减小,则反应速率减小,故C错误;D选项,降低温度,反应速率减小,故D错误;故选B。
4.反应A(g)+3B(g) 4C(g)+2D(g),在不同条件下反应,其平均反应速率v(X)如下,其中反应速率最快
的是( )
A.v(C)=0.2mol/(L·s) B.v(D)=6mol/(L·min)
C.v(B)=8mol/(L·min) D.V(A)=4mol/(L·min)
【答案】D
【详解】
在速率单位统一的情况下,反应速率与化学计量数的比值越大,反应速率越快,则:A. =3;B.
=3;C. =2.6;D. =4;显然D中比值最大,反应速率最快,故答案为D。
5.下列各组实验中,过氧化氢分解最快的是( )
HO 的浓度 温度 催化剂
2 2
A 5% 5 使用MnO
2
B 8% 5 不使用
C 10% 40 使用MnO
2
D 10% 40 不使用
A.A B.B
C.C D.D
【答案】C
详解:根据反应速率的影响因素:温度越高、浓度越大、使用催化剂都有利于化学反应速率的提高;二氧
化锰是双氧水分解反应的催化剂,反应速率提高的较大,正确选项C。
6.关于A(g)+2B(g)=3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·min-1
C.v(C)=1.2 mol·L-1·min-1 D.v(B)=0.03 mol·L-1·s-1
【答案】D
【详解】A. v(A)=0.6 mol·L-1·min-1;
B. v(B)=1.2 mol·L-1·min-1,转化成用A表示的速率为1.2 mol·L-1·min-1÷2=0.6 mol·L-1·min-1;
C. v(C)=1.2 mol·L-1·min-1,转化成用A表示的速率为1.2 mol·L-1·min-1÷3=0.4 mol·L-1·min-1;
D. v(B)=0.03 mol·L-1·s-1,统一单位:v(B)=0.03 mol·L-1·s-1×60s/min=1.8 mol·L-1·min-1,转化成用A表示的速
率为1.8 mol·L-1·min-1÷2=0.9 mol·L-1·min-1;所以速率最快的是D;
7.下列关于化学反应速率的说法正确的是( )
A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是1s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
【答案】C
【详解】
A.化学反应速率适用于溶液或气体,不适用于固体或纯液体,故A错误;
B.化学反应速率为“0.8mol/(L•s)”表示的意思是:时间段为1s时,某物质的浓度增加或减少0.8mol/L,故
B错误;
C.化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故C正确;
D.反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故
D错误;
故选C。
8.恒温恒容密闭容器中发生反应2A(g)+B(g) 2C(g),若反应物A的浓度由0.1 mol·L-1降到0.06
mol·L-1需20 s,那么由0.06 mol·L-1降到0.036 mol·L-1所需的时间为( )
A.等于10 s B.等于12 s
C.大于12 s D.小于12 s
【答案】C
【详解】
在恒温恒容的容器中进行反应2A(g)+B(g) 2C(g),若反应物浓度由0.1mol•L-1降到0.06mol•L-1需
20s,此时: =(0.1mol/L−0.06mol/L)/20s=0.002mol/(L•s),如反应速率不变,则由0.06mol•L-1降到
0.036mol•L-1,需要反应的时间是t= c/v=0.024mol/L÷0.002mol/(L•s)=12s,但随着反应的进行,反应物浓度
逐渐减小,反应速率逐渐减小,所以△需要的时间大于12s。
9.在恒温、体积为2L的密闭容器中进行反应:2A(g) 3B(g)+C(g),若反应物在前20s由3mol
降为1.8mol,则前20s的平均反应速度为A.υ(B)=0.045mol/(L·s) B.υ(B)=0.03mol/(L·s)
C.υ(C)=0.03mol/(L·s) D.υ(C)=0.06mol/(L·s)
【答案】A
【详解】
前20s用A表示的平均反应速率υ(A)= = =0.03mol/(L·s),则前20s的
平均反应速率υ(B)= υ(A)=0.045 mol/(L·s),υ(C)= υ(A)=0.015 mol/(L·s),答案选A。
10.一定条件下,在2 L密闭容器中发生反应:A(g)+3B(g) === 2C(g) + 4D(g),测得5 min内,A的物质的
量减小了10 mol,则5 min内该反应的化学反应速率是
A.υ(A) = 1 mol/(L·min)
B.υ(B) = 1 mol/(L·min)
C.υ(C) = 1 mol/(L·min)
D.υ(D) = 1 mol/(L·min)
【答案】A
【详解】
A.υ(A) = =1 mol/(L·min),故A正确;
B.υ(B) =3υ(A) =3 mol/(L·min),故B错误;
C.υ(C) =2υ(A) =2mol/(L·min), 故C错误;
D.υ(D) = 4υ(A) =4mol/(L·min),故D错误;
答案选A。
11.在一定温度下,10mL0.40mol/L H O 发生催化分解。不同时刻测定生成O 的体积(已折算为标准状
2 2 2
况)如下表。
t/min 0 2 4 6 8 10
V(O )/mL 0.0 9.9 17.2 22.4 26.5 29.9
2
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(HO) mol/(L·min)
2 2B.6~10min的平均反应速率:v(HO)< mol/(L·min)
2 2
C.反应至6min时,c(HO)=0.3mol/L
2 2
D.反应至6min时,HO 分解了50%
2 2
【答案】C
【详解】
A.0~6min时间内,△c(HO)=0.002mol÷0.01L=0.2mol/L,所以v(HO)=0.2mol/L÷6min
2 2 2 2
mol/(L·min), A正确;
B.随着反应的进行,HO 的浓度逐渐减小,反应速率减慢,B正确;
2 2
C.6min时,c(HO)=0.002mol÷0.01L=0.2mol/L, C错误;
2 2
D.6min时,HO 分解率为: =50%, D正确。
2 2
12.下列关于化学反应速率的说法正确的是 ( )
A.化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol/(L·s)是指1s 时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
【答案】C
【详解】
A.化学反应速率用单位时间内反应物物质的量浓度的减少或生成物物质的量浓度的增加来表示,固体和纯
液体不可以,故A错误;
B.化学反应速率为0.8 mol/(L·s)是指单位时间内浓度的变化量为0.8 mol/L,故B错误;
C.根据化学反应速率的大小可以知道化学反应进行的快慢,故C正确;
D.决定反应速率的主要因素是反应物自身的性质,故D错误;
13.某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中
数据分析求得:(1)该反应的化学方程式为________________;
(2)前4分钟,A的速率为__________________,平衡时A的转化率是_________
(3)第4min时,正、逆反应速率的大小关系为:v (正)__ v (逆);(填“>”、“<”或“=”)
(4)以下措施能加快反应速率的是___________。
A 恒温恒容充入He使压强增大 B 缩小体积,使压强增大
C 恒温恒压充入He D 平衡后加入催化剂
【答案】2A B 0.2mol/(L·min) 75﹪ > BD AB
【详解】
(1)由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至
4min时,A减少0.8mol-0.4mol=0.4mol,B增加0.4mol-0.2mol=0.2mol,由反应速率之比等于化学计量数之
比可知,A、B的化学计量数比为2:1,且后来达到平衡状态,则反应为2A B;
(2)反应开始至4min时,A的平均反应速率为 =0.2mol/(L·min) ;平衡时A的物质的量为
0.2mol,则A的转化率为 =75%;
(3)第4min时,反应尚未达到平衡,仍向正反应方向进行,则正、逆反应速率的大小关系为:v (正)> v
(逆);
(4)A.恒温恒容充入He使压强增大,但不改变反应物和生成物的浓度,不影响反应速率,故A错误;
B.缩小体积,使压强增大,反应物和生成物的浓度均瞬间增大,反应速率加快,故B正确;
C.恒温恒压充入He,容积增大,反应物和生成物的浓度均瞬间减小,反应速率减慢,故C错误;
D.平衡后加入催化剂,可加快反应速率,故D正确;
故答案为BD;
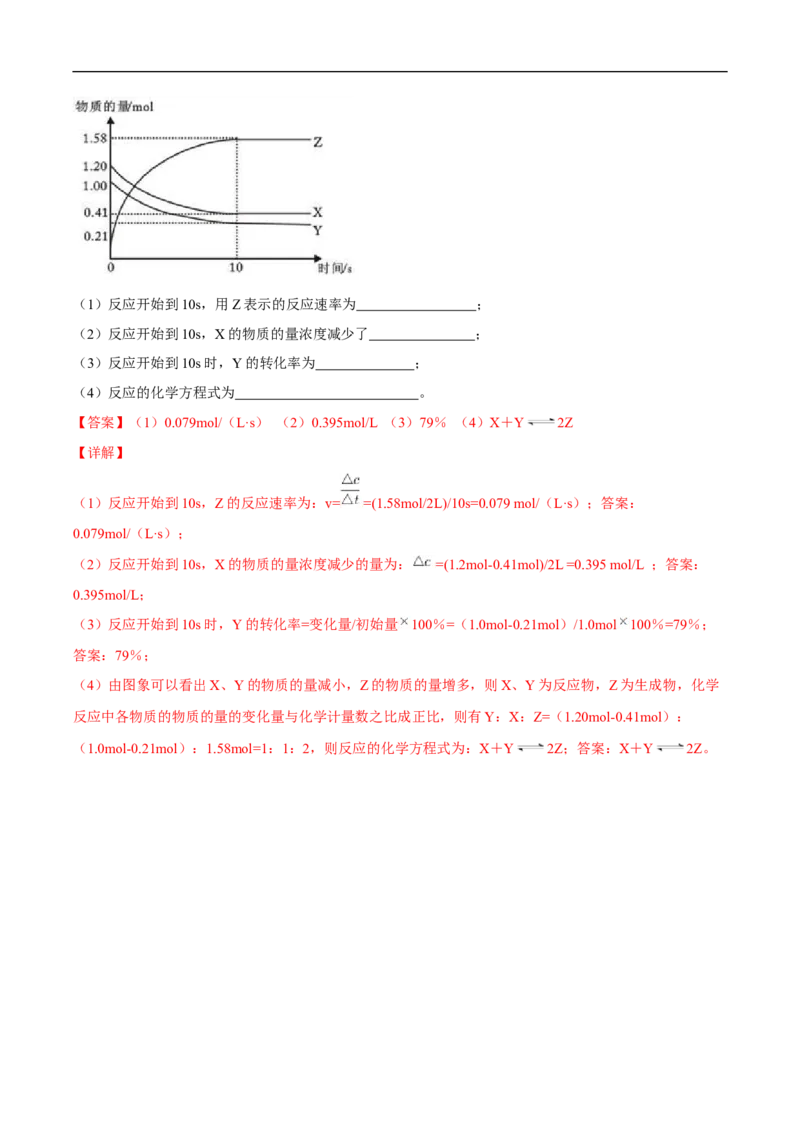
14.(8分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图
所示。回答下列问题:(1)反应开始到10s,用Z表示的反应速率为 ;
(2)反应开始到10s,X的物质的量浓度减少了 ;
(3)反应开始到10s时,Y的转化率为 ;
(4)反应的化学方程式为 。
【答案】(1)0.079mol/(L·s) (2)0.395mol/L (3)79% (4)X+Y 2Z
【详解】
(1)反应开始到10s,Z的反应速率为:v= =(1.58mol/2L)/10s=0.079 mol/(L·s);答案:
0.079mol/(L·s);
(2)反应开始到10s,X的物质的量浓度减少的量为: =(1.2mol-0.41mol)/2L =0.395 mol/L ;答案:
0.395mol/L;
(3)反应开始到10s时,Y的转化率=变化量/初始量 100%=(1.0mol-0.21mol)/1.0mol 100%=79%;
答案:79%;
(4)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,化学
反应中各物质的物质的量的变化量与化学计量数之比成正比,则有Y:X:Z=(1.20mol-0.41mol):
(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为:X+Y 2Z;答案:X+Y 2Z。