文档内容
必修第二册 第六章 第一节 化学反应与能量变化 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
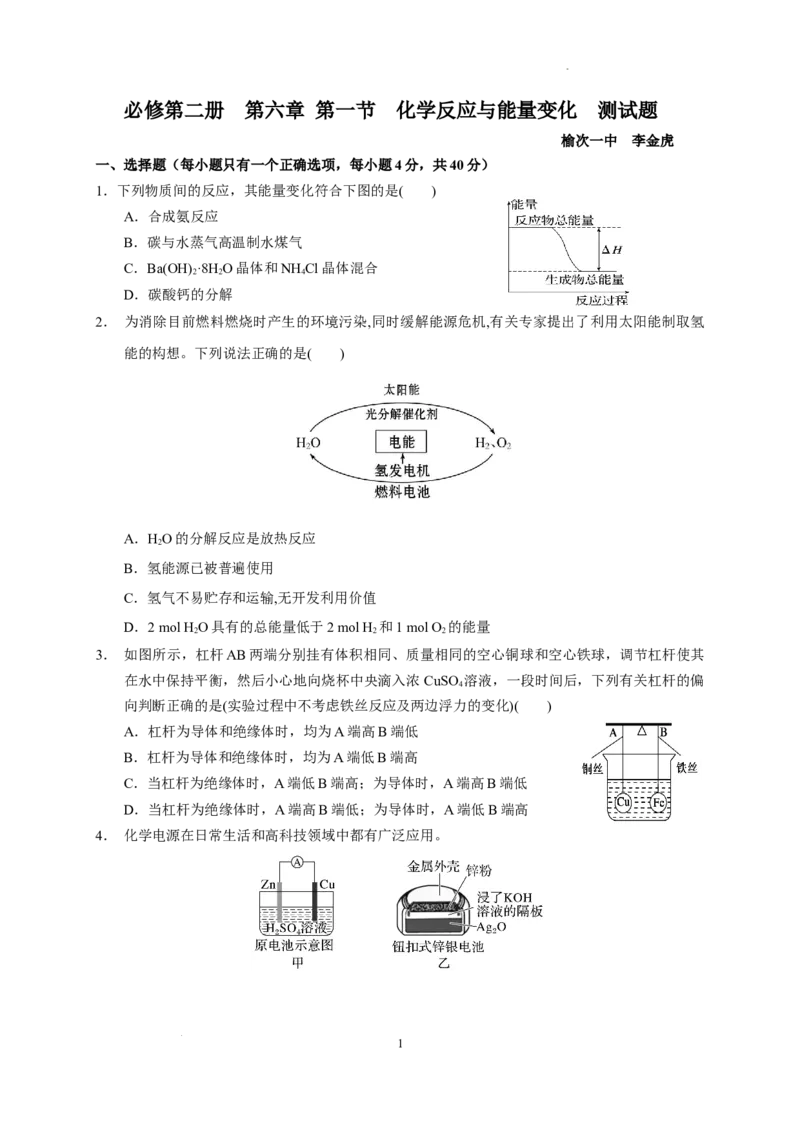
1.下列物质间的反应,其能量变化符合下图的是( )
A.合成氨反应
B.碳与水蒸气高温制水煤气
C.Ba(OH) ·8H O晶体和NH Cl晶体混合
2 2 4
D.碳酸钙的分解
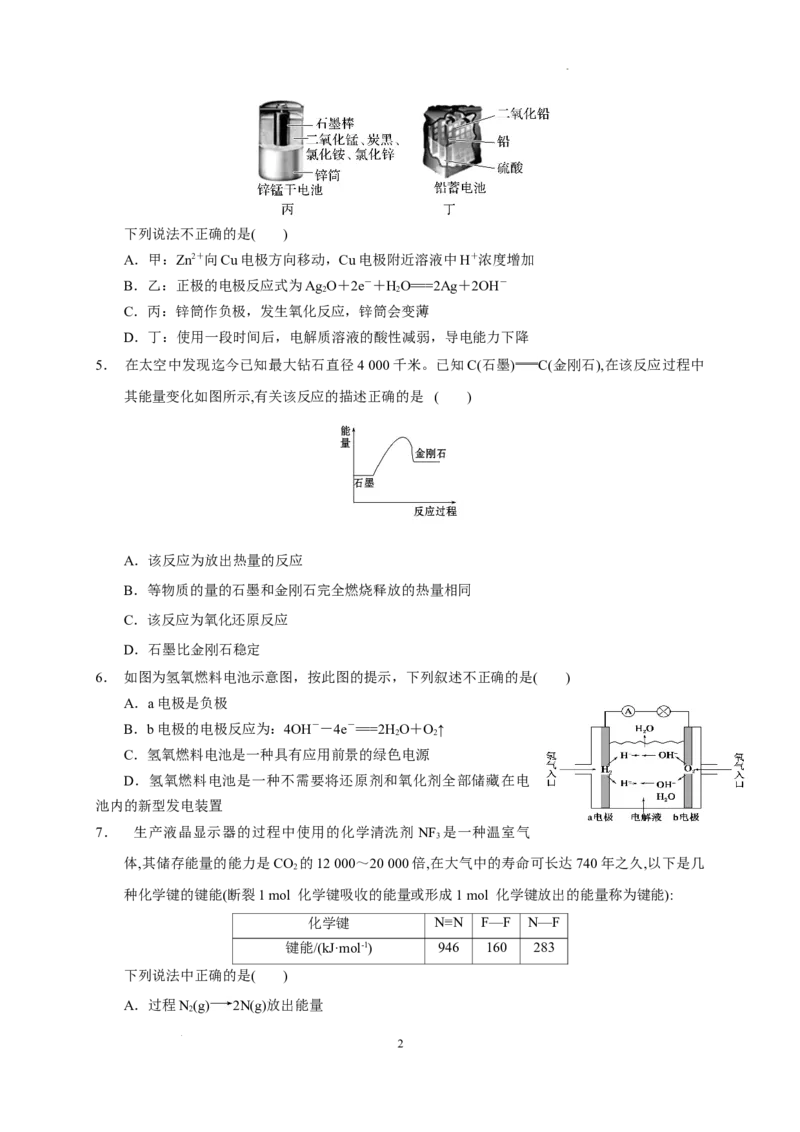
2. 为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢
能的构想。下列说法正确的是( )
A.HO的分解反应是放热反应
2
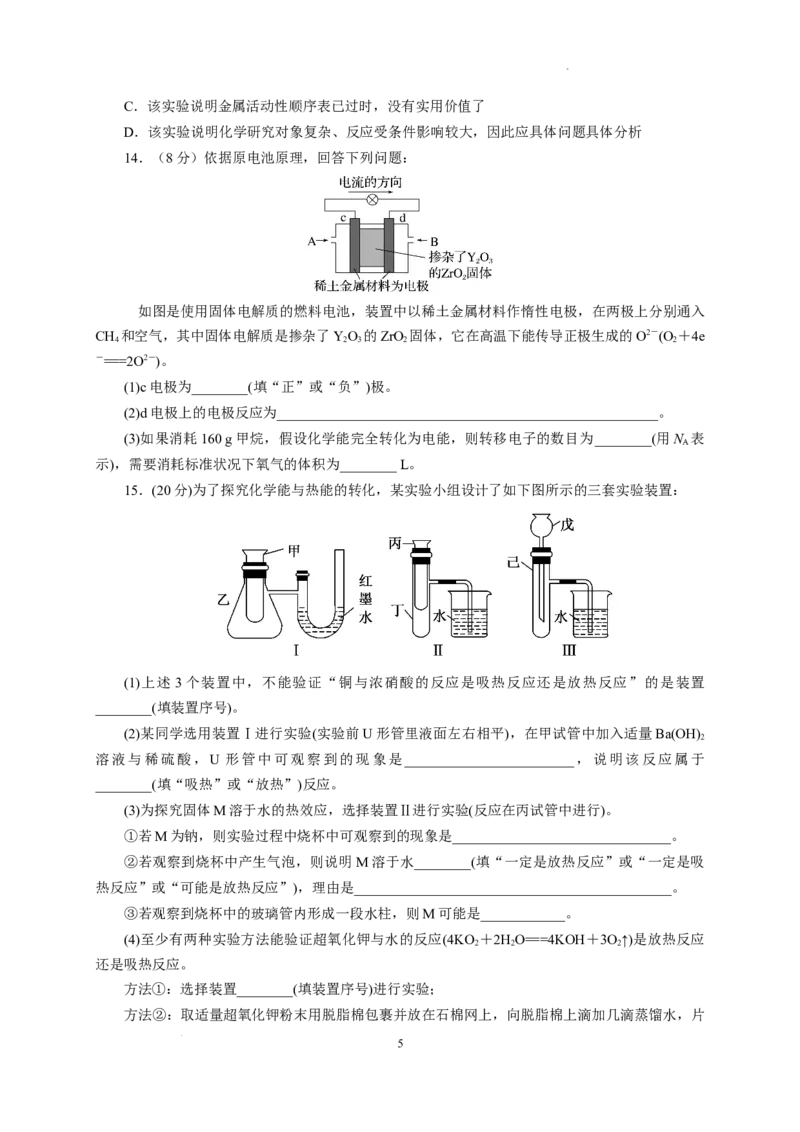
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H O具有的总能量低于2 mol H 和1 mol O 的能量
2 2 2
3. 如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其
在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO 溶液,一段时间后,下列有关杠杆的偏
4
向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
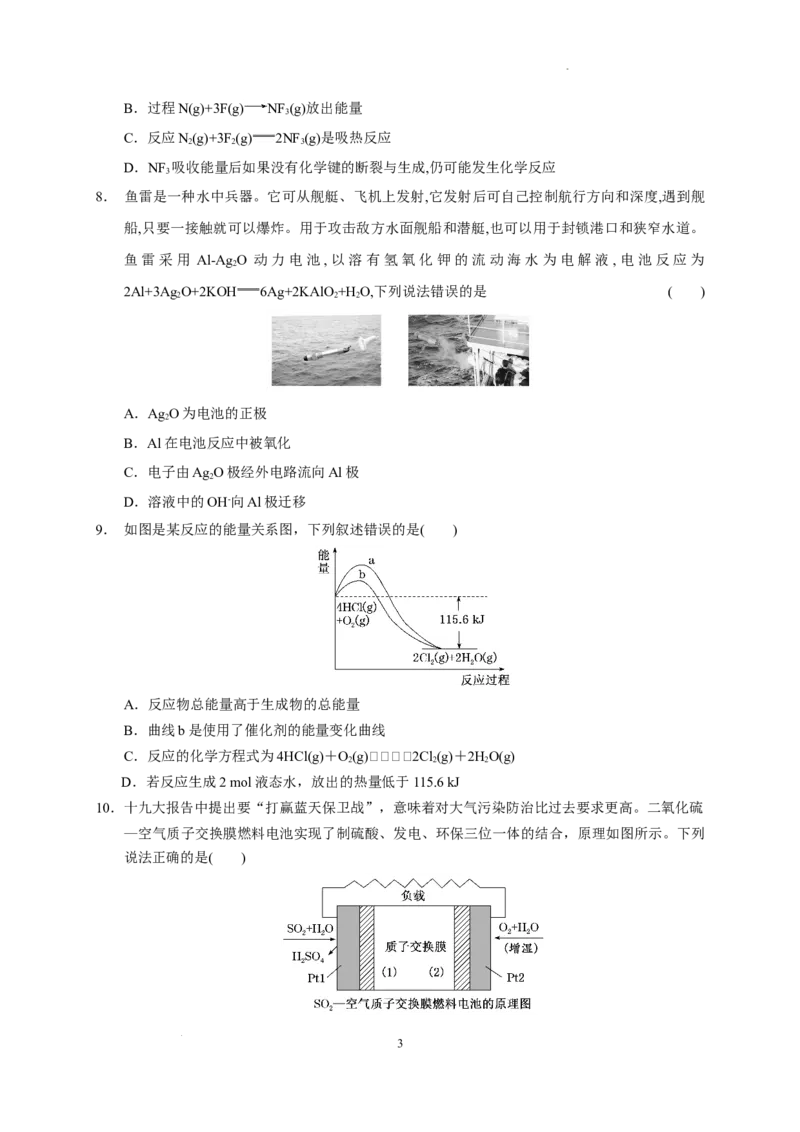
4. 化学电源在日常生活和高科技领域中都有广泛应用。
1
学科网(北京)股份有限公司下列说法不正确的是( )
A.甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.乙:正极的电极反应式为Ag O+2e-+HO===2Ag+2OH-
2 2
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
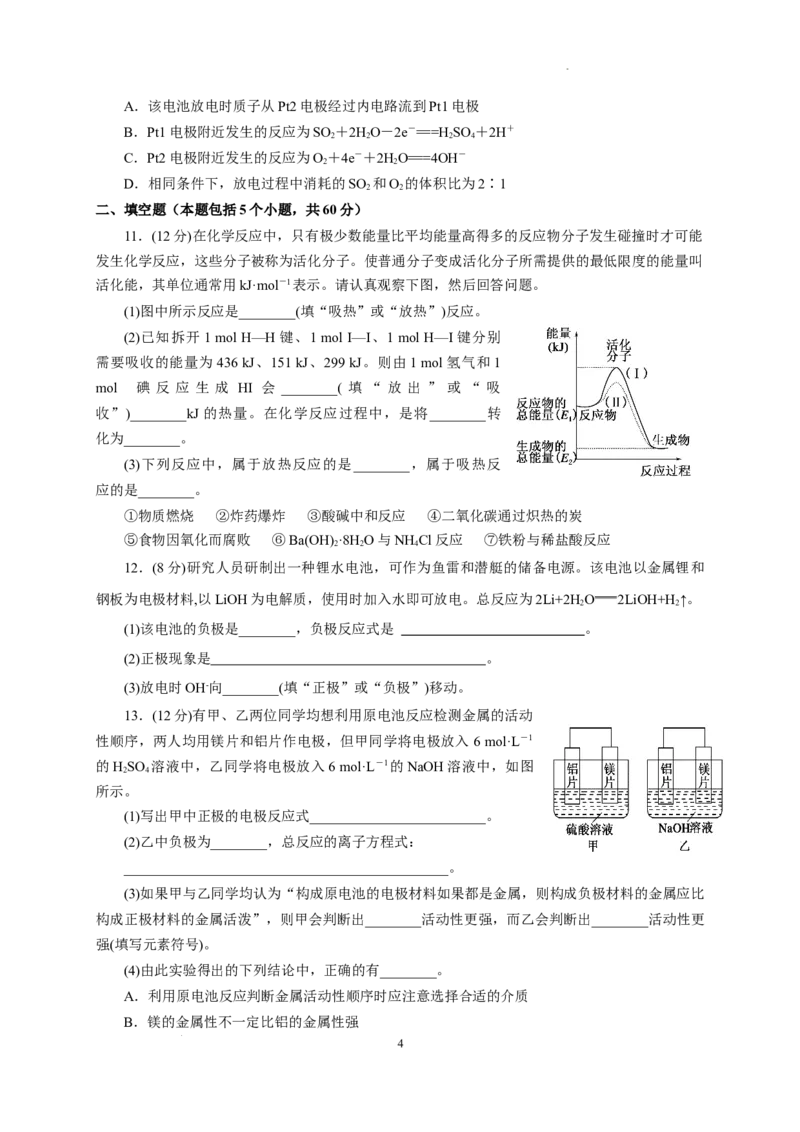
5. 在太空中发现迄今已知最大钻石直径4 000千米。已知C(石墨) C(金刚石),在该反应过程中
其能量变化如图所示,有关该反应的描述正确的是 ( )
A.该反应为放出热量的反应
B.等物质的量的石墨和金刚石完全燃烧释放的热量相同
C.该反应为氧化还原反应
D.石墨比金刚石稳定
6. 如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应为:4OH--4e-===2H O+O↑
2 2
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电
池内的新型发电装置
7. 生产液晶显示器的过程中使用的化学清洗剂 NF 是一种温室气
3
体,其储存能量的能力是CO 的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几
2
种化学键的键能(断裂1 mol 化学键吸收的能量或形成1 mol 化学键放出的能量称为键能):
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 946 160 283
下列说法中正确的是( )
A.过程N(g) 2N(g)放出能量
2
2
学科网(北京)股份有限公司B.过程N(g)+3F(g) NF (g)放出能量
3
C.反应N(g)+3F (g) 2NF (g)是吸热反应
2 2 3
D.NF 吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
3
8. 鱼雷是一种水中兵器。它可从舰艇、飞机上发射,它发射后可自己控制航行方向和深度,遇到舰
船,只要一接触就可以爆炸。用于攻击敌方水面舰船和潜艇,也可以用于封锁港口和狭窄水道。
鱼雷采用 Al-Ag O 动力电池,以溶有氢氧化钾的流动海水为电解液,电池反应为
2
2Al+3Ag O+2KOH 6Ag+2KAlO +H O,下列说法错误的是 ( )
2 2 2
A.Ag O为电池的正极
2
B.Al在电池反应中被氧化
C.电子由Ag O极经外电路流向Al极
2
D.溶液中的OH-向Al极迁移
9. 如图是某反应的能量关系图,下列叙述错误的是( )
A.反应物总能量高于生成物的总能量
B.曲线b是使用了催化剂的能量变化曲线
C.反应的化学方程式为4HCl(g)+O(g)2Cl(g)+2HO(g)
2 2 2
D.若反应生成2 mol液态水,放出的热量低于115.6 kJ
10.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。二氧化硫
—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。下列
说法正确的是( )
3
学科网(北京)股份有限公司A.该电池放电时质子从Pt2电极经过内电路流到Pt1电极
B.Pt1电极附近发生的反应为SO +2HO-2e-===H SO +2H+
2 2 2 4
C.Pt2电极附近发生的反应为O+4e-+2HO===4OH-
2 2
D.相同条件下,放电过程中消耗的SO 和O 的体积比为2∶1
2 2
二、填空题(本题包括5个小题,共60分)
11.(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能
发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫
活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别
需要吸收的能量为436 kJ、151 kJ、299 kJ。则由1 mol氢气和1
mol 碘 反 应 生 成 HI 会 ________( 填 “ 放 出 ” 或 “ 吸
收”)________kJ的热量。在化学反应过程中,是将________转
化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反
应的是________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的炭
⑤食物因氧化而腐败 ⑥Ba(OH) ·8H O与NH Cl反应 ⑦铁粉与稀盐酸反应
2 2 4
12.(8分)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和
钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。总反应为2Li+2HO 2LiOH+H ↑。
2 2
(1)该电池的负极是________,负极反应式是 。
(2)正极现象是 。
(3)放电时OH-向________(填“正极”或“负极”)移动。
13.(12分)有甲、乙两位同学均想利用原电池反应检测金属的活动
性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入 6 mol·L-1
的HSO 溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图
2 4
所示。
(1)写出甲中正极的电极反应式_________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比
构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更
强(填写元素符号)。
(4)由此实验得出的下列结论中,正确的有________。
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
4
学科网(北京)股份有限公司C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
14.(8分)依据原电池原理,回答下列问题:
如图是使用固体电解质的燃料电池,装置中以稀土金属材料作惰性电极,在两极上分别通入
CH 和空气,其中固体电解质是掺杂了YO 的ZrO 固体,它在高温下能传导正极生成的O2-(O +4e
4 2 3 2 2
-===2O2-)。
(1)c电极为________(填“正”或“负”)极。
(2)d电极上的电极反应为______________________________________________________。
(3)如果消耗160 g甲烷,假设化学能完全转化为电能,则转移电子的数目为________(用N 表
A
示),需要消耗标准状况下氧气的体积为________ L。
15.(20分)为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的是装置
________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量Ba(OH)
2
溶液与稀硫酸,U 形管中可观察到的现象是________________________,说明该反应属于
________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_______________________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”或“一定是吸
热反应”或“可能是放热反应”),理由是_____________________________________________。
③若观察到烧杯中的玻璃管内形成一段水柱,则M可能是____________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO +2HO===4KOH+3O↑)是放热反应
2 2 2
还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片
5
学科网(北京)股份有限公司刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
1.答案 A
2.答案 D
解析 水的分解是吸热反应,A错误;氢能源由于受贮存和运输等因素的限制,还未普遍使用,但有巨
大的开发利用价值,B、C错误;2 mol H 可以在1 mol O 中完全燃烧生成2 mol H O,并放出大量的热,
2 2 2
D正确。
3.答案D
解析 根据题意,若杠杆为绝缘体,滴入CuSO 溶液后,Cu在铁球表面析出,铁球质量增大,B端
4
下沉;若杠杆为导体,滴入CuSO 溶液后,形成原电池,Cu在铜球表面析出,A端下沉。
4
4.答案 A
解析 Zn较Cu活泼,作负极,Zn失电子变Zn2+,Zn2+和H+迁移至铜电极,H+得电子变为H ,
2
因而c(H+)减小,A项错误;Ag O作正极,得到来自Zn失去的电子,被还原成Ag,结合KOH溶
2
液作电解液,故电极反应式为Ag O+2e-+HO===2Ag+2OH-,B项正确;Zn为较活泼电极,作
2 2
负极,发生氧化反应,锌溶解,因而锌筒会变薄,C项正确;铅蓄电池总反应式为PbO (s)+Pb(s)
2
+2HSO (aq)2PbSO (s)+2HO(l),放电一段时间后,HSO 不断被消耗,因而电解质溶液的
2 4 4 2 2 4
酸性减弱,导电能力下降,D项正确。
5.答案D
解析 由图可知,金刚石的能量高于石墨,故C(石墨) C(金刚石)为吸收热量的反应,故A错误;
由图可知,1 mol石墨的能量低于1 mol金刚石的能量,二者在O 中完全燃烧都只生成CO ,因此
2 2
释放的热量不相同,故B错误;C(石墨) C(金刚石) ,碳元素的化合价在反应前后都是0,没有化
合价的变化,则不属于氧化还原反应,故C错误;由图可知,石墨的能量低,石墨稳定,故D正确。
6.答案 B
7.答案 B
解析 A项不正确,N (g) 2N(g)表示断裂化学键的过程,应吸收能量。B 项正确,N(g)+3F(g)
2
NF (g)表示形成化学键的过程,应放出能量。C项不正确,根据键能的数值,分别计算旧化学键断裂
3
时吸收的总能量与新化学键形成时释放的总能量,比较二者的大小确定反应的热量变化,吸收能量
(946 kJ+160 kJ×3)<放出能量(283 kJ×6),故为放热反应。D项不正确,化学反应一定有化学键的断裂与
生成,若NF 吸收能量后没有化学键的断裂与生成,则一定不发生化学变化,可能发生物理变化。
3
8.答案 C
解析 A项,根据原电池工作原理,化合价升高,失电子的作负极,即铝单质作负极,则Ag O作电池的
2
正极,正确;B项,根据电池总反应,铝的化合价升高,被氧化,正确;C项,根据原电池工作原理,外电
6
学科网(北京)股份有限公司路电子从负极流向正极,由铝流向氧化银,错误;D项,根据原电池工作原理,阳离子移向正极,阴离
子移向负极,即OH-移向Al极,正确。
9.答案 D
解析:D 由图看出反应物总能量高,生成物总能量低,反应物总能量高于生成物总能量,故 A正
确;使用催化剂能降低反应所需活化能,则b为使用催化剂的图像,a为未使用催化剂的图像,故
B 正确;反应物为 4HCl(g)+O(g),生成物为 2Cl(g)+2HO(g),所以化学方程式为 4HCl(g)+
2 2 2
O(g)2Cl(g)+2HO(g),故C正确;若生成2 mol液态水,液态水比气态水能量低,放热会
2 2 2
更多,放出的热量高于115.6 kJ,故D错误。
10.答案 D
解析:放电时为原电池,质子向正极移动,Pt1电极为负极,则该电池放电时质子从Pt1电极移向
Pt2电极,A错误;Pt1电极为负极,发生氧化反应,SO 被氧化为硫酸,电极反应式为SO +2HO
2 2 2
-2e-===SO+4H+,硫酸应当拆写成离子形式,B错误;酸性条件下,氧气得电子生成水, C错
误;相同条件下,放电过程中:负极发生氧化反应:2SO +4HO-4e-===2SO+8H+,正极发生还
2 2
原反应:O +4e-+4H+===2H O,根据转移电子数相等可知,放电过程中消耗的SO 和O 的体积
2 2 2 2
比为2∶1,D正确。
11.答案:(1)放热 (2)放出 11 化学能 热能
(3)①②③⑤⑦ ④⑥
解析:(1)由图可知反应物的总能量高于生成物的总能量,故该反应为放热反应。
(2)H (g)+I(g)===2HI(g),断裂1 mol H—H键和1 mol I—I 需要吸收436 kJ+151 kJ=587 kJ热
2 2
量,生成2 mol HI放出2×299 kJ=598 kJ热量,所以1 mol 氢气和1 mol碘反应生成HI放出11 kJ
的热量;在化学反应过程中,将化学能转化为热能。
(3)应熟悉常见的吸热反应和放热反应:中和反应、燃料的燃烧、有氧参与的氧化还原反应、多
数化合反应等属于放热反应;多数分解反应(H O 分解除外)、二氧化碳通过炽热的炭、
2 2
Ba(OH) ·8H O与NH Cl反应等属于吸热反应。
2 2 4
12.答案:(1)锂 Li-e- Li+ (2)有无色气体产生 (3)负极
解析 金属锂比铁活泼,作原电池的负极,电极反应式为Li-e- Li+,LiOH溶液中的阳离子有Li+和H+,
由于氧化性:H+>Li+,所以正极反应是2H++2e- H↑,正极产生无色气体;在原电池的放电过程中,阳离
2
子向正极移动,阴离子向负极移动,所以OH-向负极移动。
13.答案: (1)2H++2e-===H ↑(2)Al 2Al+2OH-+2HO===2AlO+3H↑(3)Mg Al(4)AD
2 2 2
解析:甲同学依据的化学反应原理是Mg+HSO ===MgSO +H↑,乙同学依据的化学反应原理是
2 4 4 2
2Al+2NaOH+2HO===2NaAlO +3H↑。但是由于Al与碱的反应是一特例,不可作为判断金属性
2 2 2
强弱的依据。所以判断一个原电池的正负极应依据实验事实。
14.答案 (1)正 (2)CH +4O2--8e-===CO +2HO (3)80N 448
4 2 2 A
解析 (1)根据图中电流方向可知,c电极是正极。(3)160 g CH 的物质的量为10 mol,根据电极反
4
应式可知,反应中转移 80 mol 电子,则正极消耗 O 应为 20 mol,在标准状况下的体积为 20
2
7
学科网(北京)股份有限公司mol×22.4 L·mol-1=448 L。
15.答案(1)Ⅲ (2)左端液面降低,右端液面升高 放热
(3)①产生气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱 ②可能是放热反
应 某些物质(如NaOH固体)溶于水放热,但不是放热反应 ③硝酸铵(或其他合理答案)
(4)Ⅰ(或Ⅱ) 放热
解析:装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ只是一
个铜与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。
(2)Ba(OH) 溶液与稀硫酸的反应属于中和反应,中和反应都是放热反应。(3)NaOH固体、硝酸铵等
2
溶于水时有热量的变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
8
学科网(北京)股份有限公司9
学科网(北京)股份有限公司