文档内容
《化学能与热能》小测验
限时:45分钟 总分:100分
一、选择题(每小题4分,共48分,每小题有1个正确选项)
1.下列变化中属于吸热反应的是( )
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气
⑤生石灰与水反应生成熟石灰 ⑥干冰升华
A.①④ B.②④ C.③⑤ D.④⑥
2.将盛有NH HCO 粉末的小烧杯放入盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应
4 3
剧烈,醋酸逐渐凝固。下列说法中不正确的是( )
A.NH HCO 和盐酸的反应是放热反应 B.该反应中,热能转化为产物内部的能量
4 3
C.反应物的总能量低于生成物的总能量 D.NH HCO 和盐酸的反应是吸热反应
4 3
3.下列说法中正确的是( )
A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化
学键形成时放出的能量多
D.因为3O===2O 是吸热反应,所以臭氧比氧气的化学性质更活泼
2 3
4.北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮。奥运火炬采用的是环保型燃料——丙烷,
其燃烧时发生反应的化学方程式为C H+5O――→3CO+4HO。下列说法中不正确的是( )
3 8 2 2 2
A.火炬燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C H 和5 mol O 所具有的总能量大于3 mol CO 和4 mol H O所具有的总能量
3 8 2 2 2
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
5.已知断开1 mol H—H键吸收的能量为436 kJ,形成1 mol H—N键放出的能量为391 kJ,根据化
学方程式N +3H2NH ,反应完1 mol N 放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能
2 2 3 2
量是( )
A.431 kJ B.945.6 kJ C.649 kJ D.869 kJ
6.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B.HO(g)―→HO(l)的过程放出大量的热,所以该过程是化学变化
2 2
C.化学反应中能量的变化都表现为热量的变化
D.如图所示的是吸收能量的过程
7.已知1 g氢气完全燃烧生成水蒸气时放出121 kJ的能量,且氧气 中 1
mol O===O键完全断裂时需要吸收496 kJ的能量,水蒸气中1 mol H—O键形成时放出463 kJ的能量,则
氢气中1 mol H—H键断裂时吸收的能量为( )
A.920 kJ B.557 kJ C.436 kJ D.181 kJ
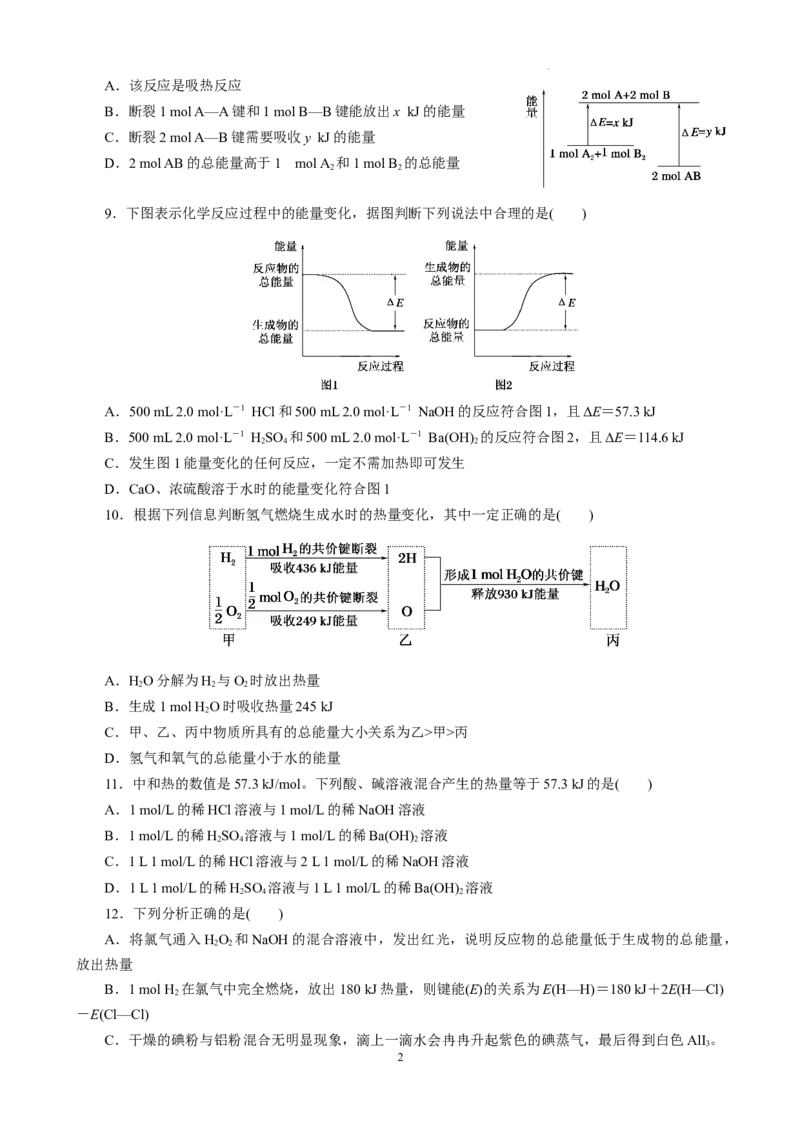
8.化学反应A+B ===2AB的能量变化如图所示,则下列说法正确的是( )
2 2
1
学科网(北京)股份有限公司A.该反应是吸热反应
B.断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C.断裂2 mol A—B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A 和1 mol B 的总能量
2 2
9.下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
A.500 mL 2.0 mol·L-1 HCl和500 mL 2.0 mol·L-1 NaOH的反应符合图1,且ΔE=57.3 kJ
B.500 mL 2.0 mol·L-1 HSO 和500 mL 2.0 mol·L-1 Ba(OH) 的反应符合图2,且ΔE=114.6 kJ
2 4 2
C.发生图1能量变化的任何反应,一定不需加热即可发生
D.CaO、浓硫酸溶于水时的能量变化符合图1
10.根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
A.HO分解为H 与O 时放出热量
2 2 2
B.生成1 mol H O时吸收热量245 kJ
2
C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙
D.氢气和氧气的总能量小于水的能量
11.中和热的数值是57.3 kJ/mol。下列酸、碱溶液混合产生的热量等于57.3 kJ的是( )
A.1 mol/L的稀HCl溶液与1 mol/L的稀NaOH溶液
B.1 mol/L的稀HSO 溶液与1 mol/L的稀Ba(OH) 溶液
2 4 2
C.1 L 1 mol/L的稀HCl溶液与2 L 1 mol/L的稀NaOH溶液
D.1 L 1 mol/L的稀HSO 溶液与1 L 1 mol/L的稀Ba(OH) 溶液
2 4 2
12.下列分析正确的是( )
A.将氯气通入HO 和NaOH的混合溶液中,发出红光,说明反应物的总能量低于生成物的总能量,
2 2
放出热量
B.1 mol H 在氯气中完全燃烧,放出180 kJ热量,则键能(E)的关系为E(H—H)=180 kJ+2E(H—Cl)
2
-E(Cl—Cl)
C.干燥的碘粉与铝粉混合无明显现象,滴上一滴水会冉冉升起紫色的碘蒸气,最后得到白色AlI 。
3
2
学科网(北京)股份有限公司说明碘和铝发生的反应是放热反应
D.精确实验测得HO在常温下也能微弱电离:HOH++OH-,该过程是放热过程
2 2
二、填空题(共52分)
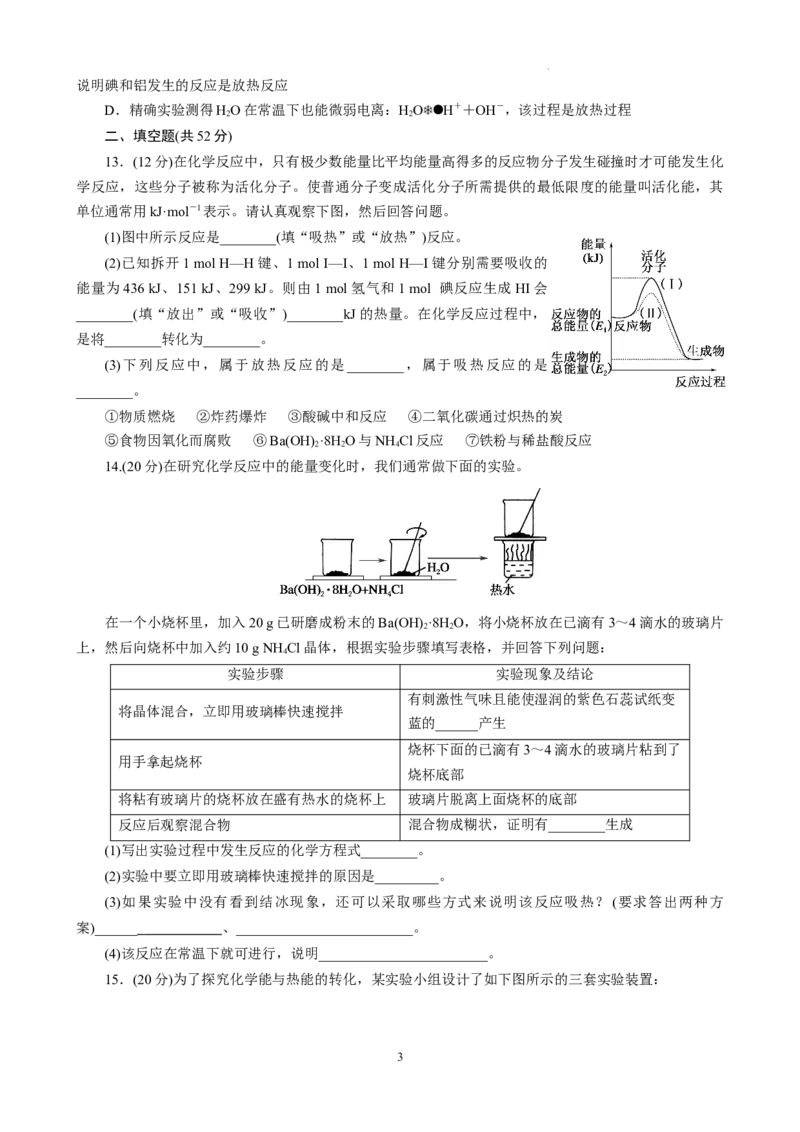
13.(12分)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化
学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其
单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应。
(2)已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的
能量为436 kJ、151 kJ、299 kJ。则由1 mol氢气和1 mol 碘反应生成HI会
________(填“放出”或“吸收”)________kJ的热量。在化学反应过程中,
是将________转化为________。
(3)下列反应中,属于放热反应的是________,属于吸热反应的是
________。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的炭
⑤食物因氧化而腐败 ⑥Ba(OH) ·8H O与NH Cl反应 ⑦铁粉与稀盐酸反应
2 2 4
14.(20分)在研究化学反应中的能量变化时,我们通常做下面的实验。
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH) ·8H O,将小烧杯放在已滴有3~4滴水的玻璃片
2 2
上,然后向烧杯中加入约10 g NH Cl晶体,根据实验步骤填写表格,并回答下列问题:
4
实验步骤 实验现象及结论
有刺激性气味且能使湿润的紫色石蕊试纸变
将晶体混合,立即用玻璃棒快速搅拌
蓝的______产生
烧杯下面的已滴有3~4滴水的玻璃片粘到了
用手拿起烧杯
烧杯底部
将粘有玻璃片的烧杯放在盛有热水的烧杯上 玻璃片脱离上面烧杯的底部
反应后观察混合物 混合物成糊状,证明有________生成
(1)写出实验过程中发生反应的化学方程式________。
(2)实验中要立即用玻璃棒快速搅拌的原因是_________。
(3)如果实验中没有看到结冰现象,还可以采取哪些方式来说明该反应吸热?(要求答出两种方
案)______ 、_________________________。
(4)该反应在常温下就可进行,说明________________________。
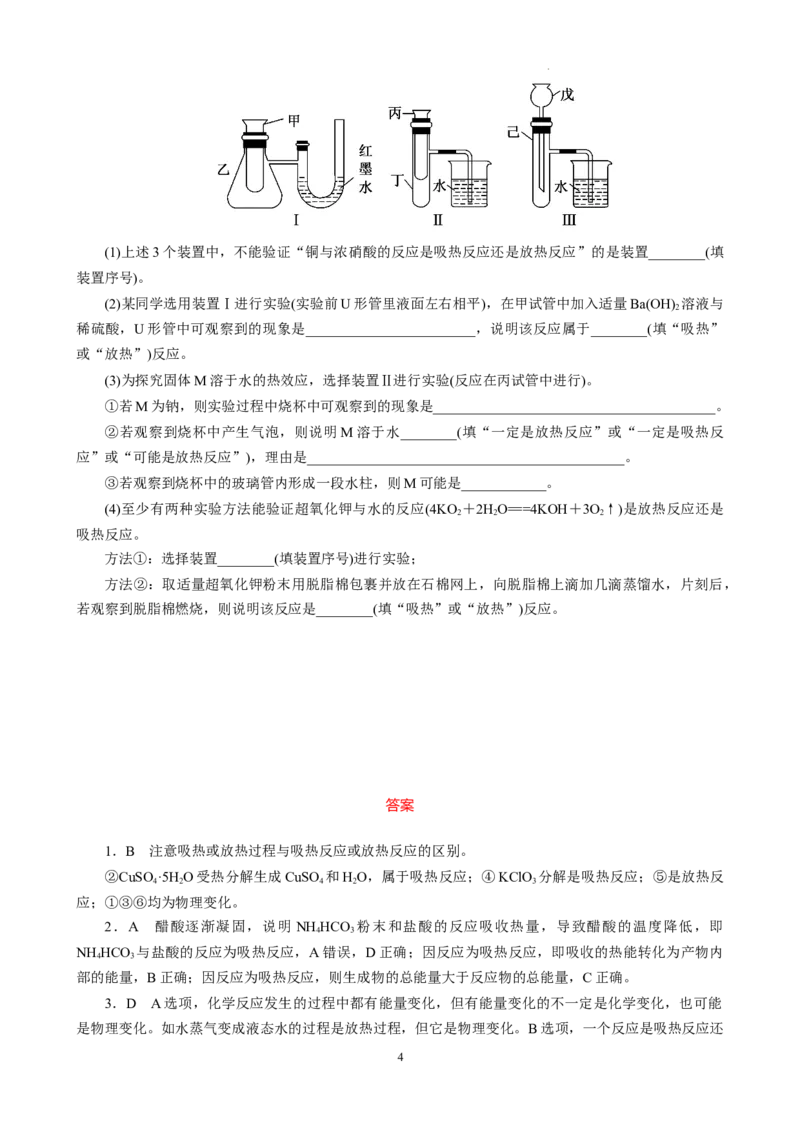
15.(20分)为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
3
学科网(北京)股份有限公司(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的是装置________(填
装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量Ba(OH) 溶液与
2
稀硫酸,U形管中可观察到的现象是________________________,说明该反应属于________(填“吸热”
或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是________________________________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”或“一定是吸热反
应”或“可能是放热反应”),理由是_____________________________________________。
③若观察到烧杯中的玻璃管内形成一段水柱,则M可能是____________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO +2HO===4KOH+3O↑)是放热反应还是
2 2 2
吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,
若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
答案
1.B 注意吸热或放热过程与吸热反应或放热反应的区别。
②CuSO ·5H O受热分解生成CuSO 和HO,属于吸热反应;④KClO 分解是吸热反应;⑤是放热反
4 2 4 2 3
应;①③⑥均为物理变化。
2.A 醋酸逐渐凝固,说明 NH HCO 粉末和盐酸的反应吸收热量,导致醋酸的温度降低,即
4 3
NH HCO 与盐酸的反应为吸热反应,A错误,D正确;因反应为吸热反应,即吸收的热能转化为产物内
4 3
部的能量,B正确;因反应为吸热反应,则生成物的总能量大于反应物的总能量,C正确。
3.D A选项,化学反应发生的过程中都有能量变化,但有能量变化的不一定是化学变化,也可能
是物理变化。如水蒸气变成液态水的过程是放热过程,但它是物理变化。B选项,一个反应是吸热反应还
4
学科网(北京)股份有限公司是放热反应和反应条件没有必然的联系。如碳燃烧需要加热,但此反应为放热反应;氢氧化钡与氯化铵
的反应是吸热反应,不需加热也能自发进行。C选项,一个反应是吸热反应,从宏观来看,说明反应物的
总能量比生成物的总能量低;从微观来看,旧键断裂吸收的能量比新键形成放出的能量多。D选项,因
为3O===2O 为吸热反应,臭氧具有的总能量比氧气的总能量高,所以臭氧比氧气活泼。
2 3
4.A 火炬燃烧时还有化学能与光能的转化,A错;燃烧都是放热反应,B对;因为丙烷燃烧为放
热反应,所以据反应的化学方程式可知,C对;丙烷完全燃烧时产物为CO 与HO,故对环境无污染,D
2 2
对。
5.B 设断开1 mol N≡N键需吸收的能量为x,根据反应放出的能量=形成新键放出的能量-断开
旧键吸收的能量,代入数据:92.4 kJ=6×391 kJ-3×436 kJ-x,x=945.6 kJ。
6.A 任何化学反应都有能量的变化,但有能量变化的过程不一定是化学变化,如物质的三态变化,
虽然存在能量变化,但没有新物质生成,故不是化学变化,所以A项正确,B项错误;化学反应中能量
变化的形式有多种,除热能外,还有光能、电能等,C项错误;由图知,该过程中反应物的总能量大于生
成物的总能量,故该过程中放出能量,D项错误。
7.C 由“1 g氢气完全燃烧生成水蒸气时放出121 kJ的能量”可知,2 g H (含1 mol H—H键)完全
2
燃烧生成水蒸气时放出的能量为121 kJ×2=242 kJ。由化学方程式H(g)+O(g)=====HO(g),可设1
2 2 2
mol H—H键断裂吸收的能量为Q,则Q+×496 kJ-2×463 kJ=-242 kJ,解得Q=436 kJ。
8.C 由图象知,1 mol A 和1 mol B 的总能量高于2 mol AB的能量,所以该反应放热。
2 2
9.A 图1表示放热反应,图2表示吸热反应。选项B是放热反应,故错误;选项A,1 mol H+与1
mol OH-反应放出57.3 kJ热量,正确;选项C,一些放热反应需加热才能发生,故错误;选项D,浓硫酸
溶于水虽然会放出热量,但不属于化学反应,故错误。
10.C 根据能量变化可知,1 mol H 与 mol O 断键时吸收685 kJ能量,而生成1 mol H O放出930
2 2 2
kJ能量,所以H 燃烧生成HO的反应是放热反应,则HO的分解是吸热反应。
2 2 2
11.C 中和热是指酸碱发生中和反应生成 1 mol H O时所放出的热量,它是一个固定值,为 57.3
2
kJ/mol。A项,由于未明确盐酸和NaOH溶液的体积,故1 mol/L的稀HCl溶液与1 mol/L的稀NaOH溶
液混合产生HO的物质的量不确定,故A项错误。同理,可以得出B项也错误。C项,1 L 1 mol/L的稀
2
HCl溶液与2 L 1 mol/L的稀NaOH反应,HCl不足,NaOH过量,计算得生成的HO的物质的量为1
2
mol,故C项正确。D项,反应生成的HO的物质的量为2 mol,产生的热量应等于114.6 kJ,同时SO与
2
Ba2+结合生成BaSO 会放出热量,即总热量应大于114.6 kJ,故D项错误。
4
12.C A项,反应物的总能量应该高于生成物的总能量;B项,正确的关系式是E(H—H)=2E(H—
Cl)-E(Cl—Cl)-180 kJ,注意是键能和能量的关系;D项,电离是吸热的。
答案
13.(1)放热 (2)放出 11 化学能 热能
(3)①②③⑤⑦ ④⑥
解析:(1)由图可知反应物的总能量高于生成物的总能量,故该反应为放热反应。
(2)H (g)+I(g)===2HI(g),断裂1 mol H—H键和1 mol I—I 需要吸收436 kJ+151 kJ=587 kJ热量,
2 2
生成2 mol HI放出2×299 kJ=598 kJ热量,所以1 mol 氢气和1 mol碘反应生成HI放出11 kJ的热量;在
化学反应过程中,将化学能转化为热能。
(3)应熟悉常见的吸热反应和放热反应:中和反应、燃料的燃烧、有氧参与的氧化还原反应、多数化
5
学科网(北京)股份有限公司合反应等属于放热反应;多数分解反应(H O 分解除外)、二氧化碳通过炽热的炭、Ba(OH) ·8H O与
2 2 2 2
NH Cl反应等属于吸热反应。
4
14.NH 水
3
(1)Ba(OH) ·8H O+2NH Cl===BaCl +2NH ↑+10HO
2 2 4 2 3 2
(2)使反应物迅速混合而充分反应,使温度迅速下降
(3)①用手触摸烧杯壁,感觉很凉;②用温度计测量,发现反应后的温度比反应前的温度低
(4)有的吸热反应不需要加热也能发生
解析:本实验旨在研究常温下Ba(OH) ·8H O与NH Cl晶体反应过程中的能量变化,实验成功的关键
2 2 4
是在短时间内使反应充分进行,体系温度快速降低。因为该反应属于固体之间的反应,且要求反应时间
短,所以一定要将Ba(OH) ·8H O研磨成粉末,以便与NH Cl充分接触;另外,晶体混合后,要立即用玻
2 2 4
璃棒快速搅拌。要想证明该反应是吸热反应,不一定要通过“结冰”现象,还可以利用“人的感觉”、
“温度计”等。该实验同时说明了并非所有的吸热反应都需要加热才能发生。
15.(1)Ⅲ (2)左端液面降低,右端液面升高 放热
(3)①产生气泡,反应完毕后,冷却至室温,烧杯中的导管内形成一段水柱 ②可能是放热反应 某
些物质(如NaOH固体)溶于水放热,但不是放热反应 ③硝酸铵(或其他合理答案)
(4)Ⅰ(或Ⅱ) 放热
解析:装置Ⅰ可通过U形管中红墨水液面的变化判断铜与浓硝酸的反应是放热反应还是吸热反应;
装置Ⅱ可通过烧杯中是否产生气泡判断铜与浓硝酸的反应是放热反应还是吸热反应;装置Ⅲ只是一个铜
与浓硝酸反应并将生成的气体用水吸收的装置,不能验证该反应是放热反应还是吸热反应。(2)Ba(OH) 溶
2
液与稀硫酸的反应属于中和反应,中和反应都是放热反应。(3)NaOH固体、硝酸铵等溶于水时有热量的
变化,但发生的是物理变化,不属于化学反应,故不是放热或吸热反应。
6
学科网(北京)股份有限公司7
学科网(北京)股份有限公司