文档内容
人教版(2019)必修一第四章第一节 原子结构与元素周期表
测试卷一
学校:___________姓名:___________班级:___________考号:___________
一、单选题
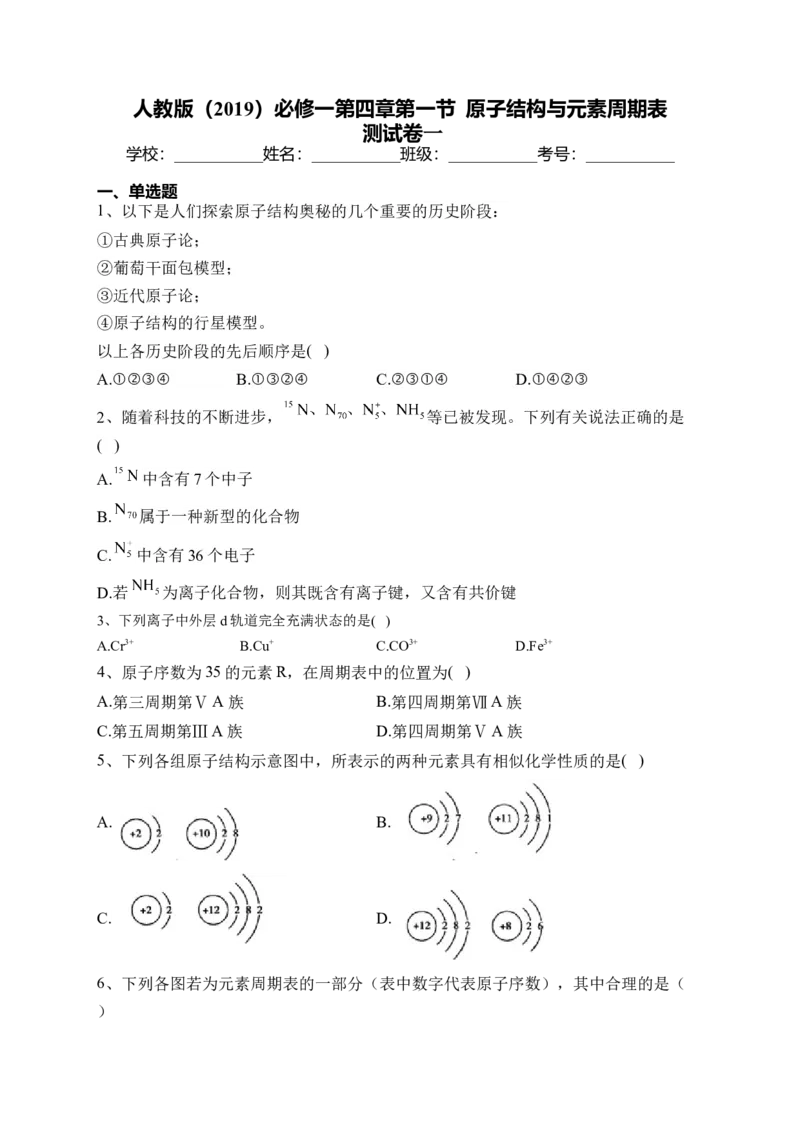
1、以下是人们探索原子结构奥秘的几个重要的历史阶段:
①古典原子论;
②葡萄干面包模型;
③近代原子论;
④原子结构的行星模型。
以上各历史阶段的先后顺序是( )
A.①②③④ B.①③②④ C.②③①④ D.①④②③
2、随着科技的不断进步, 等已被发现。下列有关说法正确的是
( )
A. 中含有7个中子
B. 属于一种新型的化合物
C. 中含有36个电子
D.若 为离子化合物,则其既含有离子键,又含有共价键
3、下列离子中外层d轨道完全充满状态的是( )
A.Cr3+ B.Cu+ C.CO3+ D.Fe3+
4、原子序数为35的元素R,在周期表中的位置为( )
A.第三周期第ⅤA族 B.第四周期第ⅦA族
C.第五周期第ⅢA族 D.第四周期第ⅤA族
5、下列各组原子结构示意图中,所表示的两种元素具有相似化学性质的是( )
A. B.
C. D.
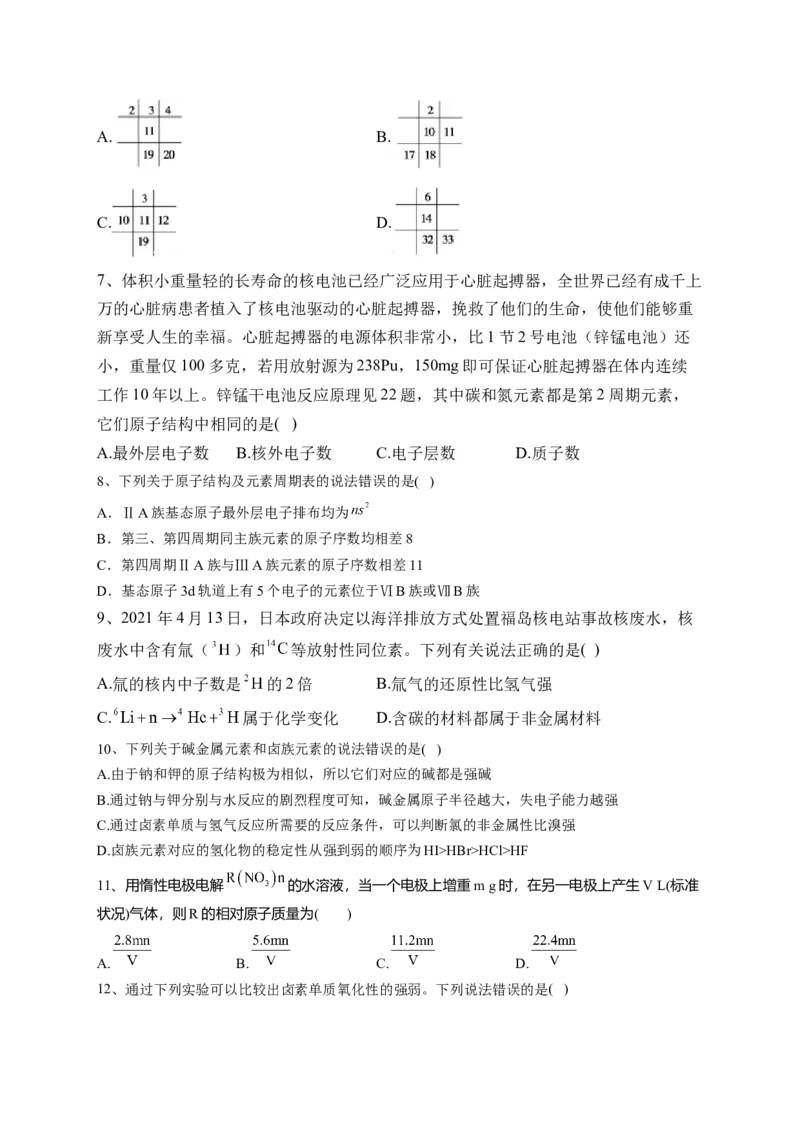
6、下列各图若为元素周期表的一部分(表中数字代表原子序数),其中合理的是(
)A. B.
C. D.
7、体积小重量轻的长寿命的核电池已经广泛应用于心脏起搏器,全世界已经有成千上
万的心脏病患者植入了核电池驱动的心脏起搏器,挽救了他们的生命,使他们能够重
新享受人生的幸福。心脏起搏器的电源体积非常小,比1节2号电池(锌锰电池)还
小,重量仅100多克,若用放射源为238Pu,150mg即可保证心脏起搏器在体内连续
工作10年以上。锌锰干电池反应原理见22题,其中碳和氮元素都是第2周期元素,
它们原子结构中相同的是( )
A.最外层电子数 B.核外电子数 C.电子层数 D.质子数
8、下列关于原子结构及元素周期表的说法错误的是( )
A.ⅡA族基态原子最外层电子排布均为
B.第三、第四周期同主族元素的原子序数均相差8
C.第四周期ⅡA族与ⅢA族元素的原子序数相差11
D.基态原子3d轨道上有5个电子的元素位于ⅥB族或ⅦB族
9、2021年4月13日,日本政府决定以海洋排放方式处置福岛核电站事故核废水,核
废水中含有氚( )和 等放射性同位素。下列有关说法正确的是( )
A.氚的核内中子数是 的2倍 B.氚气的还原性比氢气强
C. 属于化学变化 D.含碳的材料都属于非金属材料
10、下列关于碱金属元素和卤族元素的说法错误的是( )
A.由于钠和钾的原子结构极为相似,所以它们对应的碱都是强碱
B.通过钠与钾分别与水反应的剧烈程度可知,碱金属原子半径越大,失电子能力越强
C.通过卤素单质与氢气反应所需要的反应条件,可以判断氯的非金属性比溴强
D.卤族元素对应的氢化物的稳定性从强到弱的顺序为HI>HBr>HCl>HF
11、用惰性电极电解 的水溶液,当一个电极上增重m g时,在另一电极上产生V L(标准
状况)气体,则R的相对原子质量为( )
A. B. C. D.
12、通过下列实验可以比较出卤素单质氧化性的强弱。下列说法错误的是( )A. 起到萃取、富集 的作用
B.a中下层无色,说明转化为
C.步骤Ⅱ中发生反应的离子方程式为
D.依据a、b中现象,可以证明 的氧化性比 强
13、2016年IUPAC将第117号元素命名为Ts(中文名“ ”,音tion),Ts的最外
层电子数是7。下列说法中,不正确的是( )。
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的电子数
C.Ts在同族元素中非金属性最弱
D.中子数为176的Ts,其核素符号是
14、下列关于氟、氯、溴、碘四种元素的性质比较,正确的是( )
A.单质密度依次增大,颜色逐渐变浅
B.氢化物的稳定性随核电荷数的增加而增强
C. 可以从KI溶液中置换出
D.它们位于第ⅦA族,最高正价均为+7价
二、填空题
15、用周期表中特殊位置的短周期元素符号填空:
(1)族序数等于周期数3倍的元素:_______;
(2)周期数是族序数3倍的元素是:_______;
中,
(3)_______和_______互为同位素;
(4)_______和_______的质量数相等,但不能互称同位素;
16、氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答
下列问题。(1)砷原子核外电子排布式为________________________________________。
(2) 晶体中 与 之间的键型为_________________,该化学键能够形成的原
因是 ______________________________________。
(3)已知:
CH
4
101. 239.
沸点(K) 161.2 185.4
7 7
分解温度(K) 873 773 1073 713.2
分析上表中四种物质的相关数据,请回答:
① 和 比较, 和 比较,沸点高低的原因是__________________________。
② 和 比较, 和 比较,分解温度高低的原因是_______________________。
17、钠和钾是极活泼的金属元素,钠和钾及化合物在生产和生活中有广泛的应用。
(1)写出两种可以食用的含钠化合物的化学式:________。将0.01mol下列物质(①Na O;
2 2
②NaO;③NaCO;④NaCl)分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度
2 2 3
由大到小的顺序是(溶液体积变化忽略不计)_______。
(2)由于钾比钠更活泼,制备KO一般是用单质钾还原对应的过氧化物、硝酸盐或亚硝酸盐,试
2
写出用钾与硝酸钾反应制取KO的化学方程式(还有一种单质生成):______________________。
2
KO 也有强氧化性,试写出其与SO 发生反应的化学方程式:_______________________。
2 2 2
(3)某学生用NaCO 和 KHCO 组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度
2 3 3
相等且不考虑HCl的挥发)
实验序号 ① ② ③ ④
盐酸体积/mL 50 50 50 50
固体质量/g 3.06 6.12 9.18 12.24
生成气体体积/L(标况) 0.672 1.344 1.568 1.344
根据数据计算所用盐酸的物质的量浓度为___________
原混合物样品中n(Na CO)∶n(KHCO)=__________
2 3 3
18、下列几组物质中,互为同位素的有__________,互为同素异形体的有__________,互为同系物的
有__________,互为同分异构体的有__________,属于同种物质的有__________
35 37
①O 和O ② Cl和 Cl ③CH CH 和CH CH CH ④CH CH CH(CH )CH CH 和CH CH CH(CH )CH(CH )CH
2 3 3 3 3 2 3 3 2 3 2 3 3 2 3 3 3
⑤ ⑥CH (CH ) CH 和(CH ) CHCH ⑦CH CH(CH )CH 和CH(CH )
3 2 2 3 3 2 3 3 3 3 3 3
19、原子核外电子的运动特点。
-31
1.电子的质量__________(9.1095×10 kg),带负电荷。
2.相对于原子和电子的体积而言,电子运动的空间__________。
8 -1
3.电子运动的速度__________,接近光速(3.0×10 m·s )。20、Ⅰ.某化学小组在学习元素周期律后,对卤素单质和拟卤素 的性质递变规律进行探究,
利用如图装置可验证它们的性质规律。
(1)仪器A的名称为__________;干燥管D的作用为________。
(2)若A中加浓HSCN,B中加 ,已知
,C中加淀粉碘化钾混合溶液,如果试管C
中溶液变蓝,即可证明还原性 _________ (填“<”、“=”、“>”)。
写出试管C中发生反应的离子方程式: ___________________。
Ⅱ.在探究 的性质实验时,做了以下3个实验:
实验
试剂 实验步骤 实验现象
序号
试管1中加2mL 0.05
1 加入1mL KSCN溶液 溶液变为血红色
溶液
黄色溶液变为澄清透明的
i.加入0.15g铜粉
试管2中加2mL 0.05 浅蓝色
2
溶液 ii 再加入1滴0.1 液滴接触上方变为红色,
KSCN溶液 下方有白色沉淀生成
试管3中加2mL 0.1
3 加入1mL KSCN溶液 溶液变成绿色
溶液
(3)试管1中反应的离子方程式为__________________。
(4)实验2前,小组同学预测经过步骤ii后溶液不应该呈现红色,依据是____(结合方程式说
明)。
(5)实验小组对白色沉淀的产生进行了深入探究,
查阅资料:i. CuSCN为难溶于水的白色固体;
ii. 被称为拟卤素离子,性质与卤素离子相似。
经过实验测定白色固体为CuSCN,查阅资料后小组同学猜测CuSCN的生成有如下两种可能:
猜测①: 与KSCN发生了氧化还原反应,该反应的离子方程式________;猜测②:亚铁离子将其还原 ,
(6)根据实验3,得知猜测①是错误的。小组查阅资料并讨论后得出:溶液中离子在反应时所表
现的氧化性强弱与相应还原产物的价态和状态有关。由此分析生成CuSCN沉淀使 的氧化性增
强,根据学过的原电池原理设计成以下原电池装置,在左侧烧杯中滴入________溶液,若电流计
_____,则可以证明以上分析正确。
三、推断题
21、下表是元素周期表的一部分,针对表中的a~g元素,回答下列问题:
(1)d元素位于金属与非金属的分界线处,常用作_______材料。
(2)f的元素符号为As,其最高价氧化物的化学式为_______。
(3)a、b、c三种元素的最高价氧化物对应水化物的碱性逐渐减弱,试从原子结构的角度解释上述变
化规律_______。
(4)e元素的非金属性强于g,请写出一个离子方程式证明_____________________。
22、下表给出的是原子序数小于20的16种元素的电负性x数值:
元素 H Li Be B C N O F
电负性 2.1 1.0 1.5 2.0 2.5 3.0 3.5 4.0
元素 Na Mg Al Si P S Cl K
电负性 0.9 1.2 1.5 1.8 2.1 2.5 3.0 0.8
请仔细分析,试回答下列有关问题:
(1)根据所给数据分析推测:同主族的不同元素的x值的变化规律是_____________,x值与原子半
径的关系是_____________。
(2)预测周期表中电负性最大的元素应为________(填元素符号),估计钙元素的电负性的取值范围:
_______________。
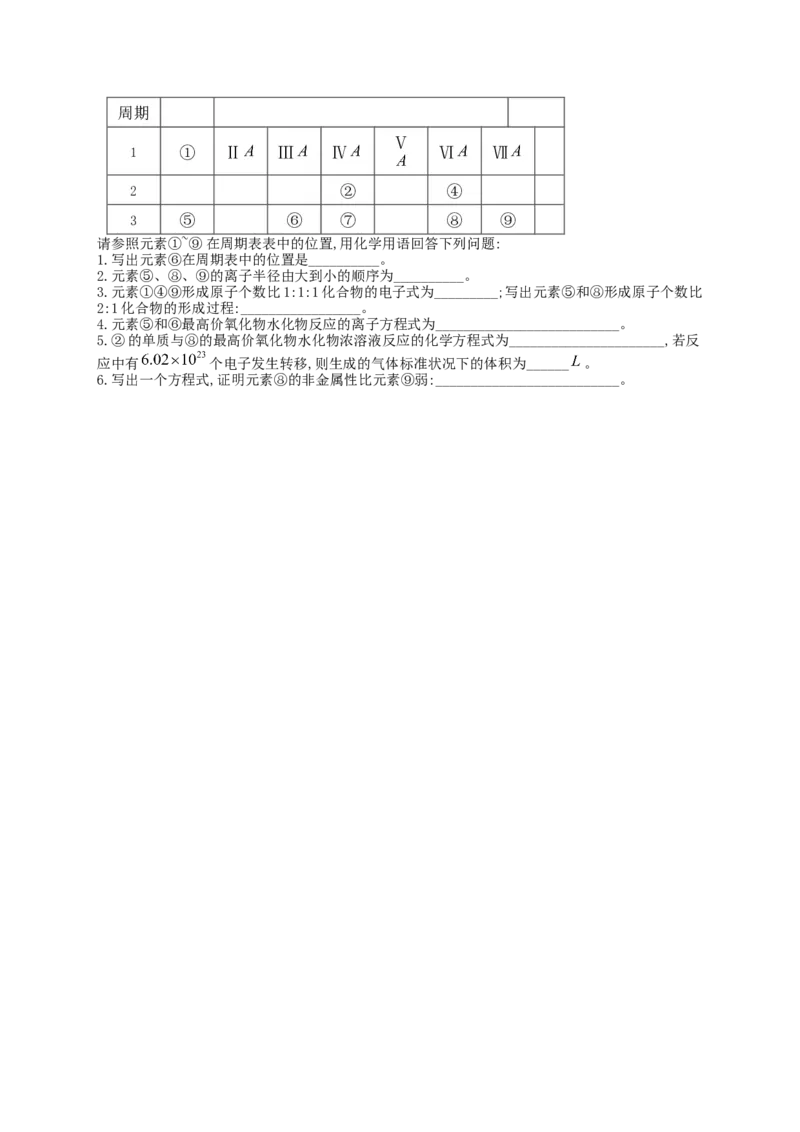
23、下表为元素周期表的一部分:
族 Ⅰ 0周期
Ⅴ
1 ① Ⅱ Ⅲ Ⅳ Ⅵ Ⅶ
2 ② ④
3 ⑤ ⑥ ⑦ ⑧ ⑨
请参照元素①~⑨在周期表表中的位置,用化学用语回答下列问题:
1.写出元素⑥在周期表中的位置是__________。
2.元素⑤、⑧、⑨的离子半径由大到小的顺序为__________。
3.元素①④⑨形成原子个数比1:1:1化合物的电子式为_________;写出元素⑤和⑧形成原子个数比
2:1化合物的形成过程:_________________。
4.元素⑤和⑥最高价氧化物水化物反应的离子方程式为__________________________。
5.②的单质与⑧的最高价氧化物水化物浓溶液反应的化学方程式为______________________,若反
应中有 个电子发生转移,则生成的气体标准状况下的体积为______ 。
6.写出一个方程式,证明元素⑧的非金属性比元素⑨弱:__________________________。参考答案
1、答案:B
解析:①德谟克里特(约公元前460−公元前370)提出的古典原子论;
②1897年汤姆生发现了电子1897年汤姆生发现了电子,提出的葡萄干面包原子摸型;
③1808年,英国科学家道尔顿提出了原子论;
④1911年卢瑟福提出原子结构行星模型;
先后顺序为①③②④,故选B。
2、答案:D
解析:A. 中含有中子数=15-7=8,选项A错误;B. 属于一种新型的单质,选项
B错误;C. 中含有电子数=5×7-1=34,选项C错误;D.化学式为, 是氢离子和
铵根离子间形成的离子化合物,存在离子键,铵根离子中氮原子和氢原子间存在共价
键,选项D正确;答案选D。
3、答案:B
解析:
4、答案:B
解析:
5、答案:A
解析: 分别是氦和氖元素,属于稀有气体元素,化学性质相似,
故A正确; 分别是氟和钠元素,氟属于卤素,容易得到一个电
子达到稳定结构,具有很强的非金属性,钠属于碱金属元素,容易失去一个电子达到
稳定结构,具有很强的金属性,化学性质不相似,故B错误; 分
别是氦和镁元素,氦属于稀有气体元素,化学性质稳定,镁属于碱土金属元素,具有
较强的金属性,化学性质不相似,故C错误; 分别是镁和氧元
素镁属于碱土金属元素,具有较强的金属性,氧属于氧族元素,有较强的非金属性,化学性质不相似,故D错误。
6、答案:D
解析:根据2号、10号稀有气体元素应在周期表的最右侧和3号元素在周期表的最左
侧,排除A、B、C三项。
7、答案:C
解析:元素周期表是将具有相同核外电子层数的元素,按照核电荷数递增从左往右排
成一个横行即为一个周期,故碳和氮元素都是第2周期元素,它们原子结构中相同的
是电子层数,故选C。
8、答案:B
解析:
9、答案:A
解析: 核内2个中子,2H核内1个中子,A项正确;氚气和氢气的化学性质相同,
B项错误;核反应不属于化学变化,C项错误;生铁含碳,属于合金,D项错误。
10、答案:D
解析:钠和钾的原子结构极为相似,NaOH、KOH均为强碱,A正确;碱金属元素原子半径越大,
Cl、Br
越易失电子,和水反应越剧烈,B正确;元素非金属性越强,越易与 反应,结合 2 2与
的反应条件可知非金属性:Cl>Br,C正确;卤化氢的稳定性顺序与卤素单质的氧化性顺序一致,
即稳定性:HF>HCl>HBr>HI,D错误。
11、答案:B
解析:
12、答案:B
CCl
解析:碘单质易溶于四氯化碳,根据“下层紫红色”可知 4起到莘取、富集 的作用,A项正
确。四氯化碳不溶于水且密度比水大,碘单质在四氯化碳中的溶解度大于在水中的溶解度,四氯
化碳层为紫红色,上层溶液中的溶质主要是氯化钾,继续滴加氯水后, 被 氧化成 ,下层
由紫红色变成无色,B项错误。溴单质的氧化性强于碘单质,所有溴单质能将碘离子氧化成碘单质,
故步骤Ⅱ中发生反应的离子反应方程式为 ,C项正确。继续滴加氯水能将碘
单质氧化成无色的 ,而继续滴加溴水,下层仍呈紫红色,说明氯气的氧化性强于溴单质,D项
错误。
13、答案:D
解析:A对,117号元素位于第七周期,最外层电子数是7,位于第ⅦA族;B对,同
位素原子具有相同的质子数和电子数;C对,Ts是卤素中原子序数最大的非金属元素,
同族元素原子序数越大,元素的非金属性越弱;D错,中子数为176的Ts,其核素符号为293Ts。
117
14、答案:C
解析:A.单质密度依次增大,颜色逐渐变深,A错误;
B.氢化物的稳定性与其元素的非金属性有关,非金属性越强,其氢化物的稳定性越强,
则氢化物的稳定性随核电荷数的增加而减弱,B错误;
C.非金属性越强,其单质的氧化性越强,所以氧化性: ,即 可以从KI溶液
中置换出 ,C正确;
D.它们位于第ⅦA族,F无正价,所以除F以外,其元素最高正价均为+7价,D错误;
故选C。
15、答案:(1)O
(2)Na
(3) ;
(4) ;
解析:(1)族序数等于周期数3倍的元素是:第二周期第ⅥA族的O元素;
(2)周期数是族序数3倍的元素是:第三周期第ⅠA族的Na元素;
(3)同位素是指质子数相同,中子数不同的原子之间,故 、 互为同位素,故
答案为: ; ;
(4) 和 的质量数相等,但二者的质子数不同,不能互称同位素,故答案为:
; 。
16、答案:(1)
(2)配位键; 能提供孤对电子, 能接受孤对电子(或 有空轨道)
(3)① 结构相似时,相对分子质量越大,分子间作用力越大,因此 沸点高于 ; 分
子间还存在氢键作用,因此 的沸点高于 。
② C-H键键能大于Si-H键,因此 分解温度高于 ;N-H键键能大于P-H键,因此
分解温度高于 。
解析:
17、答案:(1)NaHCO 、NaCl; ①=②>③>④
3
(2)10K+2KNO=6K O+N↑; KO+SO =KSO
3 2 2 2 2 2 2 4
(3)2mol·L-1; 1:2解析:
18、答案:②; ①; ③④; ⑥; ⑤⑦
解析:
19、答案:1.很小; 2.很大; 3.很快
解析:
20、答案:(1)分液漏斗;防倒吸
(2)>;
(3)
(4)根据 铜粉过量,不应有 存在
(5)
(6)硫氰化钾;示数变化增大
解析:(1)根据仪器构造可知,仪器A的名称为分液漏斗,装置D的作用是防止倒吸,故答案为:
分液漏斗;防倒吸;
(2)C中加淀粉碘化钾混合溶液,如果试管C中溶液变蓝,则 被 氧化为 ,方程
式为: ,根据还原性:还原剂>还原产物,则还原性: ,故
答案为:>, ;
(3)试管1中 和KSCN反应生成 和硫酸钾,离子方程式为:
,故答案为: ;
(4)铜粉可以和 反应生成铜离子和亚铁离子,且铜粉过量, 反应完全,方程式为:
,故答案为:根据 铜粉过量,不应有
存在;
(5) 与KSCN发生了氧化还原反应,即 把 氧化为 ,自身被还原为 ,
该反应的离子方程式为 ,故答案为:
;
(6)根据题意可知, 在反应中表现出氧化性,化合价降低,被还原为 , 表现出还原
性,化合价升高,被氧化为 ,所以在左侧烧杯中滴入KSCN溶液,生成CuSCN沉淀,故答案
为:KSCN。
21、答案:(1)半导体(2)As O(3)电子层数相同,核电荷数增加,原子半径减小,失电子能力减弱,金属性
2 5
减弱(4)Cl +2Br-=Br +2Cl-
2 2解析:(1)d为硅元素,位于金属与非金属的分界线处,常用作半导体材料;
(2)As位于元素周期表第四周期ⅤA族,最外层电子数为5,所以最高正价为+5价,最高价氧化物为
As O;
2 5
(3)a为钠元素,b为镁元素,c为铝元素,位于同周期,电子层数相同,核电荷数增加,原子半径减小,失电子
能力减弱,金属性减弱;
(4)e为氯元素,g为溴元素,两者位于同主族, 氯原子的得电子能力强于溴原子,化学方程式Cl+2Br-
2
=Br +2Cl-可以证明。
2
22、答案:(1)同一主族,从上到下,x值逐渐减小;反比
(2)F;0.8~1.2
解析:
2- - +
23、答案:1.第三周期第ⅢA族 ; 2.S >Cl >Na
3. ;
4.
5. ;16.8
(浓)
6.
解析: