文档内容
2022-2023 学年高一期末测试
化学试题
一、单选题(42分,每小题3分)
1. 下列有关湘江流域的治理和生态修复的措施中,没有涉及到化学变化的是
A. 河道中的垃圾回收分类后,进行无害化处理
B. 化工企业“三废”处理后,达标排放
C. 利用微生物降解水域中的有毒有害物质
D. 定期清淤,疏通河道
【答案】D
【解析】
【详解】A.垃圾无害化处理,由有害物质变为无害物质,有新物质生成,属于化学变化,A错误;
B.处理“三废”,是将“三废”转化成无毒无害物质,有新物质生成,属于化学变化,B错误;
C.微生物降解将有毒有害物质转化成无毒无害物质,有新物质生成,属于化学变化,C错误;
D.清淤、疏通河道没有新物质生成,属于物理变化,D正确;
故答案选D。
2. 阿司匹林具有抗血小板凝聚的作用。其有效成分是乙酰水杨酸(C HO)。乙酰水杨酸属于
9 8 4
A. 单质 B. 氧化物 C. 氢化物 D. 有机化合物
【答案】D
【解析】
【详解】单质中只含1种元素,乙酰水杨酸含有3种元素,不属于单质,故A错误;氧化物只含氧元素和
另外一种元素,乙酰水杨酸含有3种元素,不属于氧化物,故B错误;氢化物只含氢元素和另外一种元素,
乙酰水杨酸含有3种元素,不属于氢化物,故C错误;乙酰水杨酸含有碳元素,属于有机化合物,故D正
确。
3. 常温下,下列溶液可用铁质容器盛装的是
A. 稀硝酸 B. 稀硫酸 C. 浓硝酸 D. 浓盐酸
【答案】C
【解析】
【分析】能用铁质容器盛装的物质不能溶解铁。
【详解】A. 稀硝酸可将铁溶解为硝酸盐溶液,因此不能用铁质容器盛装,A项错误;
B. 铁可以被稀硫酸溶解,反应生成硫酸亚铁溶液和氢气,因此不能用铁质容器盛装,B项错误;
C. 浓硝酸能使铁钝化,化学反应只发生在铁表面,但不是将铁溶解,因此能用铁质容器盛装,C项正确;
第1页/共12页
学科网(北京)股份有限公司为
D. 浓盐酸可以将铁溶解 氯化亚铁溶液,因此不能用铁质容器盛装,D项错误;
答案选C。
【点睛】解答本题时容易被忽略的是浓硝酸能使金属铁钝化,解答时要格外注意。
4. 关于甲烷的下列说法中,不正确的是
A. 是组成最简单的烷烃
B. 与CHCHCH 互为同系物
3 2 3
C. 是易溶于水的气体
D. 在空气中的燃烧是放热反应
【答案】C
【解析】
【详解】A. 甲烷是组成最简单的烷烃,也是最简单的有机物,A说法正确;
B. 甲烷与CHCHCH 均为烷烃,两者分子中的碳原子数不同,结构相似,在分子组成上相差2个CH,
3 2 3 2
故其互为同系物,B说法正确;
C. 甲烷是难溶于水的气体,C说法不正确;
D. 甲烷在空气中的燃烧是放热反应,所有物质的燃烧都是放热反应,D说法正确。
本题选C。
的
5. 下列说法不正确 是
A. SO 作为食品添加剂时应注意使用范围和使用的最大限量
2
B. 含硫燃料的燃烧是空气中SO 含量增多的主要原因
2
C. 大多数铵盐都易溶于水,受热易分解,与碱反应会放出氨气
D. NH 溶于水显弱碱性,因此可使石蕊溶液变红
3
【答案】D
【解析】
【详解】A.二氧化硫有毒,对人体有害,所以SO 作为食品添加剂时应注意使用范围和使用的最大限量,
2
故A正确;
B.煤、石油中都含有硫,含硫燃料的燃烧是空气中SO 含量增多的主要原因,故B正确;
2
C.大多数铵盐易溶于水,受热易分解,铵根离子能够与OH-反应生成氨气,故C正确;
D.NH 溶于水显弱碱性,因此可使石蕊溶液变蓝,故D错误;
3
故选:D。
6. 将铁粉和硫粉混合后加热,待反应一发生立即停止加热,反应仍可持续进行,直至反应完全,生成新物
质硫化亚铁。该现象说明了
第2页/共12页
学科网(北京)股份有限公司A. 该反应是吸热反应 B. 铁粉和硫粉在常温下可以发生反应
C. 该反应是放热反应 D. 硫化亚铁的能量高于铁粉和硫粉的总能量
【答案】C
【解析】
【分析】
【详解】A.因反应一发生即停止加热,反应仍可持续进行说明本身放热支持反应,则该反应是放热反应,
故A错误;
B.铁粉和硫粉混合后加热才能发生,故B错误;
C.因反应一发生即停止加热,反应仍可持续进行说明本身放热支持反应,则该反应是放热反应,故C正
确;
D.因为是放热反应,所以生成物的总能量低于反应物的总能量,则硫化亚铁的总能量低于铁粉和硫粉的
总能量,故D错误;
故选C。
7. 把纯净的甲烷与氯气混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法
中,不正确的是
A. 用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生
B. 瓶内气体的颜色变浅
C. 该反应的生成物只有四种
D. 集气瓶壁有油状液体生成
【答案】C
【解析】
【分析】纯净的甲烷与氯气混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后会发生
取代反应,生成氯代甲烷和氯化氢气体。
【详解】A.反应产生氯化氢气体,遇到浓氨水挥发出的氨气,发生化合反应形成氯化铵产生白烟,A正
确;
B.甲烷与氯气发生取代反应,黄绿色氯气减少,颜色变浅,B正确;
C.该反应会生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,5种产物,C错误;
D.反应生成氯甲烷为油状液体,D正确;
故选C。
8. 下列反应既属于非氧化还原反应,又是放热反应的是( )
A. 锌粒与稀硫酸的反应
B. 酸碱中和反应
第3页/共12页
学科网(北京)股份有限公司C. 甲烷在氧气中的燃烧反应
D. Ba(OH) ·8H O晶体与NH Cl晶体的反应
2 2 4
【答案】B
【解析】
【详解】A. 锌粒与稀硫酸的反应属于氧化还原反应,故A错误;
B. 酸碱中和反应属于非氧化还原反应,又是放热反应,故B正确;
C. 甲烷在氧气中的燃烧反应属于氧化还原反应,故C错误;
D. Ba(OH) ·8H O晶体与NH Cl晶体的反应属于吸热反应,故D错误;
2 2 4
故答案选:B。
9. 在一定温度下,向a L恒容密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g) + 2Y(g)
2Z(g) +D(g) 此反应达到平衡的标志是
A. 正反应和逆反应的速率都为零
B. Z的物质的量浓度不再改变
C. 单位时间消耗0.1molX同时消耗0.2molY
D. 该反应达到化学平衡状态时,X可100%转化为D
【答案】B
【解析】
【详解】A.正反应和逆反应的速率相等,说明反应达到平衡,A错误;
B.Z的物质的量浓度不再改变,说明反应达到平衡,B正确;
C.单位时间消耗0.1molX同时消耗0.2molY,都是正反应,C错误;
D.该反应是可逆反应,转化率不可能达到100%,D错误;
故选B。
10. 将少量SO 分别加入到含有下列离子的溶液中,下列离子的物质的量不会减少的是
3
A. B. Ba2+ C. OH- D. Cl-
【答案】D
【解析】
【详解】SO 加入到水溶液中,SO 与水反应生成HSO ;
3 3 2 4
A. 与H+反应生成水和二氧化硫而减少;
B.Ba2+与 形成硫酸钡沉淀而减少;
C.OH-与H+结合成水而减少;
第4页/共12页
学科网(北京)股份有限公司D.Cl-不参与反应,不会减少;
答案选D。
11. 下列冶炼金属的原理中,属于热还原法的是
A. 2Ag O 4Ag+O↑ B. Fe O+3CO 2Fe+3CO ↑
2 2 2 3 2
C. Fe+CuSO=FeSO+Cu D. MgC1 Mg+C1 ↑
4 4 2 2
【答案】B
【解析】
【详解】A.因Ag是不活泼金属,故用加热Ag O 分解得到Ag,属于热分解法;
2
B.加热下、用还原剂(C、CO、H、活泼金属等)将金属从其化合物中还原出来是热还原法,在金属活动性
2
顺序表中处于中间位置的金属 (Zn~Cu),常用热还原法治炼;
C. Fe+CuSO=FeSO+Cu——湿法治金,是常温下的置换反应;
4 4
D. MgC1 Mg+C1 ↑是电解法,镁是活泼金属,工业上冶炼镁采用电解熔融氯化镁的方法;
2 2
答案选B。
12. 下列有关物质用途的叙述中,不正确的是
A. 液氨作制冰的冷冻剂 B. SO 常用于漂白食品
2
C. 硅胶可作食品干燥剂 D. SiO 常用于制造光导纤维
2
【答案】B
【解析】
【详解】A.氨气易液化,液氨作制冰的冷冻剂,故A正确;
B.二氧化硫有毒,很多食品不用SO 漂白,故B错误;
2
C.硅胶具有吸水性,硅胶可作食品干燥剂,故C正确;
D.SiO 具有优良的光学特性, SiO 常用于制造光导纤维,故D正确;
2 2
选B。
13. 下列有关氮气的说法正确的是
A. 氮气是由氮原子构成的双原子分子,所以化学性质不活泼
B. 医学常用液氮做冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性
C. H 与N 在一定条件下反应生成NH ,反应中N 体现还原性
2 2 3 2
D. 电闪雷鸣的雨天,雨水中含有一定量硝酸,可能发生的反应有N+O 2NO
2 2
第5页/共12页
学科网(北京)股份有限公司【答案】D
【解析】
的
【详解】A.氮气性质稳定 原因是两个氮原子之间共用三对电子,破坏这种结合时需要很高的能量,所
以化学性质不活泼,A错误;
B.液氮汽化时需要吸收大量的热,使周围环境温度降低,与其化学性质的不活泼无关,B错误;
C.H 与N 在一定条件下反应生成NH ,氮元素的化合价由0价变为-3价,化合价降低是氧化剂,具有氧
2 2 3
化性,C错误;
D.N 和O 在放电条件下生成NO,一氧化氮与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,D
2 2
正确;
故选D。
14. 宇宙飞船的运载火箭的推进器引燃后发生剧烈反应,产生大量高温气体,从火箭尾部喷出。引燃后的
高温气体成分有CO、HO、N、NO等,这些气体均无色,但在卫星发射现场看到火箭喷射出大量的红烟,
2 2 2
产生红烟的原因是
A. 高温下N 遇空气生成NO
2 2
B. NO遇空气反应生成NO
2
C. CO 与NO反应生成NO
2 2
D. NO与HO反应生成NO
2 2
【答案】B
【解析】
【分析】
【详解】A.氮气为空气的主要组成气体,性质稳定,高温下N 遇空气不会直接生成NO ,故A错误;
2 2
B.一氧化氮极易被氧气氧化,NO在常温下能与氧气反应2NO+O=2NO,生成红棕色的NO ,所以B选
2 2 2
项正确;
C.高温条件下一氧化碳在空气中不可能为反应产物,必然被氧气氧化成二氧化碳,所以,CO 与NO在空
2
气中高温条件下不反应,故C错误;
D.一氧化氮和水之间不会发生反应,故D错误
故选B。
二、填空题(58分,每空2分)
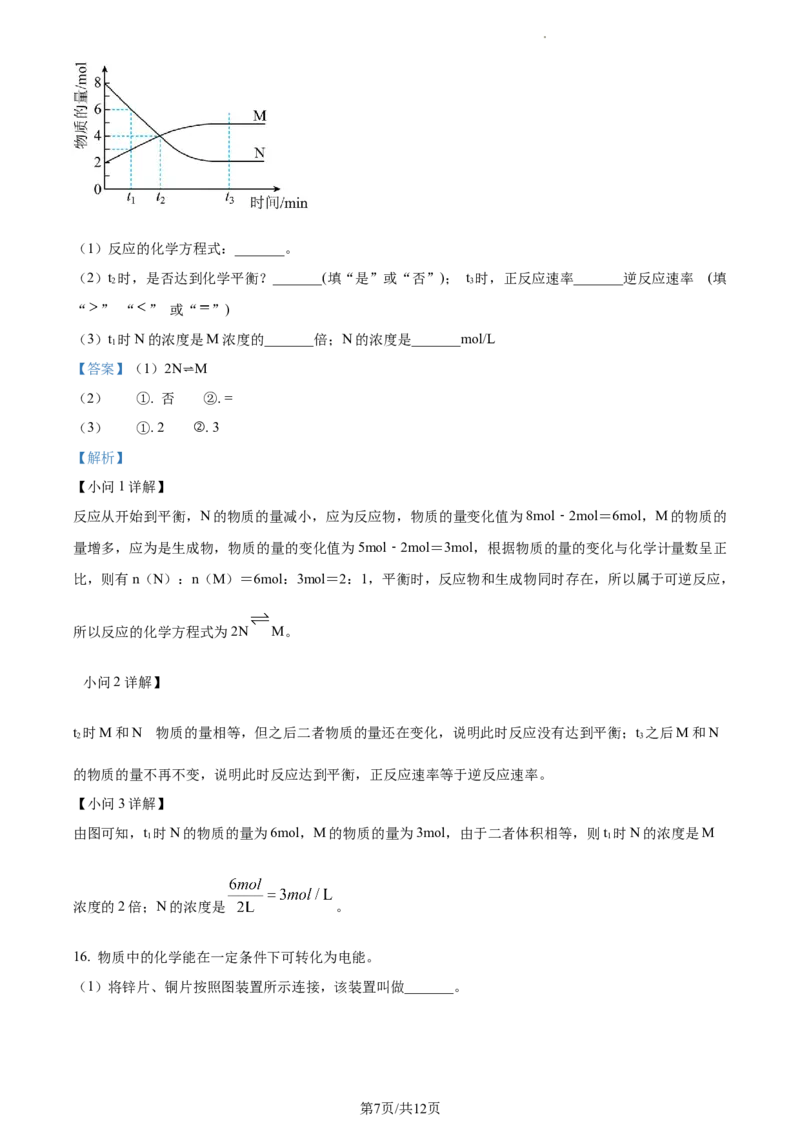
15. 在一定温度下,2L容器内某一反应中M、N的物质的量随反应时间变化的曲线如图:
第6页/共12页
学科网(北京)股份有限公司(1)反应的化学方程式:_______。
(2)t 时,是否达到化学平衡?_______(填“是”或“否”); t 时,正反应速率_______逆反应速率 (填
2 3
“ ” “ ” 或“ ”)
(3)t 时N的浓度是M浓度的_______倍;N的浓度是_______mol/L
1
【答案】(1)2N⇌M
(2) ①. 否 ②. =
(3) ①. 2 ②. 3
【解析】
【小问1详解】
反应从开始到平衡,N的物质的量减小,应为反应物,物质的量变化值为8mol﹣2mol=6mol,M的物质的
量增多,应为是生成物,物质的量的变化值为5mol﹣2mol=3mol,根据物质的量的变化与化学计量数呈正
比,则有n(N):n(M)=6mol:3mol=2:1,平衡时,反应物和生成物同时存在,所以属于可逆反应,
所以反应的化学方程式为2N M。
【
小问2详解】
的
t 时M和N 物质的量相等,但之后二者物质的量还在变化,说明此时反应没有达到平衡;t 之后M和N
2 3
的物质的量不再不变,说明此时反应达到平衡,正反应速率等于逆反应速率。
【小问3详解】
由图可知,t 时N的物质的量为6mol,M的物质的量为3mol,由于二者体积相等,则t 时N的浓度是M
1 1
浓度的2倍;N的浓度是 。
16. 物质中的化学能在一定条件下可转化为电能。
(1)将锌片、铜片按照图装置所示连接,该装置叫做_______。
第7页/共12页
学科网(北京)股份有限公司(2)锌片作:_______极,实验现象是:_______。铜片作:_______极,电极反应式:_______。总反应
式:_______。
(3)下列反应通过原电池装置,可实现化学能直接转化为电能的是_______(填序号)。
① ② ③
【答案】(1)原电池 (2) ①. 负 ②. 不断溶解 ③. 正 ④. 2H++2e-=H ↑ ⑤.
2
Zn+2H+= Zn2++ H ↑
2
(3)②③
【解析】
【小问1详解】
将锌片、铜片按照图装置所示连接,电流表显示有电流通过,将化学能转化为电能,该装置叫做原电池;
【小问2详解】
反应中Zn不断溶解,失去电子变成Zn2+,是负极,铜片上H+得到电子生成H,为正极,电极反应式为
2
2H++2e-=H ,总反应式为Zn+2H+= Zn2++ H ;
2 2
【小问3详解】
自发进行的氧化还原反应,才能将化学能直接转化为电能,①不是氧化还原反应,②③都是氧化还原反应
能实现化学能直接转化为电能,故为②③。
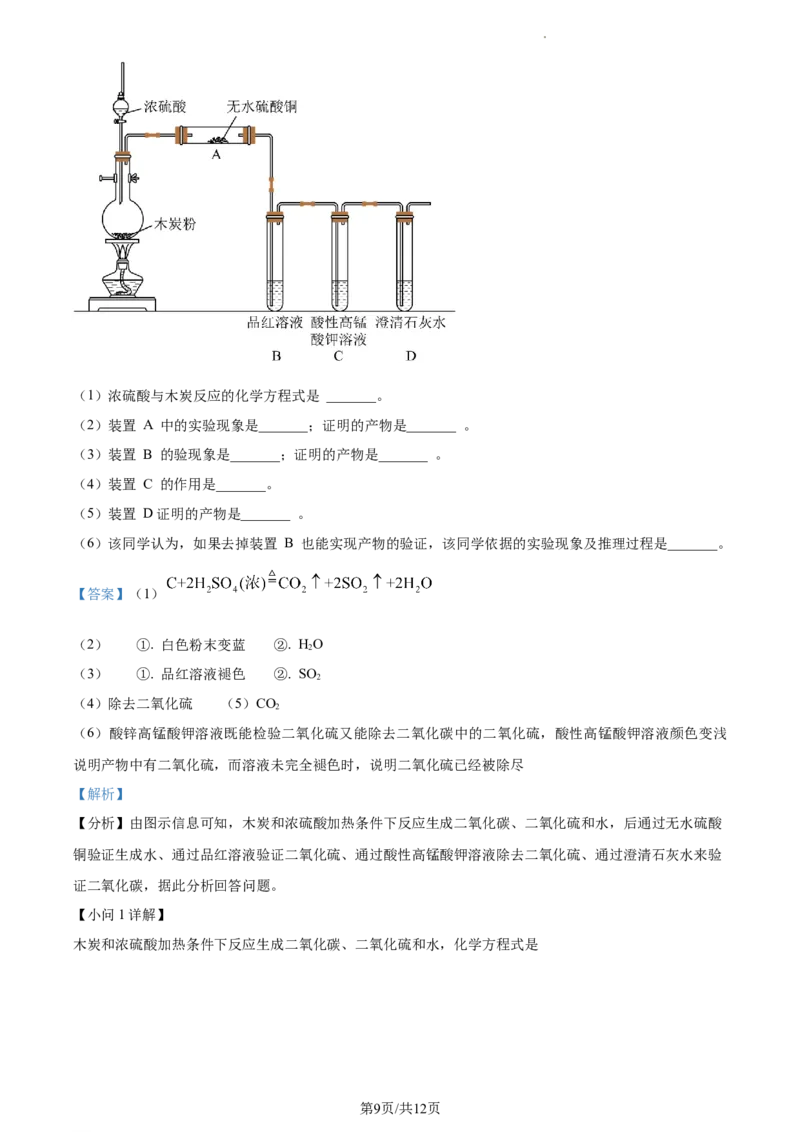
17. 浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验
(部分夹持装置省略)。回答相关问题
第8页/共12页
学科网(北京)股份有限公司(1)浓硫酸与木炭反应的化学方程式是 _______。
(2)装置 A 中的实验现象是_______;证明的产物是_______ 。
(3)装置 B 的验现象是_______;证明的产物是_______ 。
(4)装置 C 的作用是_______。
(5)装置 D证明的产物是_______ 。
(6)该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是_______。
【答案】(1)
(2) ①. 白色粉末变蓝 ②. HO
2
(3) ①. 品红溶液褪色 ②. SO
2
(4)除去二氧化硫 (5)CO
2
(6)酸锌高锰酸钾溶液既能检验二氧化硫又能除去二氧化碳中的二氧化硫,酸性高锰酸钾溶液颜色变浅
说明产物中有二氧化硫,而溶液未完全褪色时,说明二氧化硫已经被除尽
【解析】
【分析】由图示信息可知,木炭和浓硫酸加热条件下反应生成二氧化碳、二氧化硫和水,后通过无水硫酸
铜验证生成水、通过品红溶液验证二氧化硫、通过酸性高锰酸钾溶液除去二氧化硫、通过澄清石灰水来验
证二氧化碳,据此分析回答问题。
【小问1详解】
木炭和浓硫酸加热条件下反应生成二氧化碳、二氧化硫和水,化学方程式是
第9页/共12页
学科网(北京)股份有限公司;
【小问2详解】
白色粉末无水硫酸铜遇水变蓝生成 ,故装置 A 中的实验现象是白色粉末变蓝,证明的产物
是HO;
2
【小问3详解】
二氧化硫可以使品红溶液褪色,装置 B 的实验现象是品红溶液褪色,证明的产物是SO ;
2
【小问4详解】
二氧化硫可以被酸性高锰酸钾溶液氧化,故酸性高锰酸钾溶液的作用是除去二氧化硫;
【小问5详解】
二氧化硫和二氧化碳都能使澄清石灰水变浑浊,用酸性高锰酸钾除去二氧化硫,剩余的二氧化碳可以使澄
清石灰水变浑浊,故装置 D证明的产物是CO;
2
【小问6详解】
二氧化碳不能使酸性高锰酸钾溶液褪色,而二氧化硫可以,二氧化硫使酸性高锰酸钾溶液褪色的过程当中
也吸收二氧化硫,所以酸性高锰酸钾溶液既能检验二氧化硫,又能除去二氧化碳中的二氧化硫。
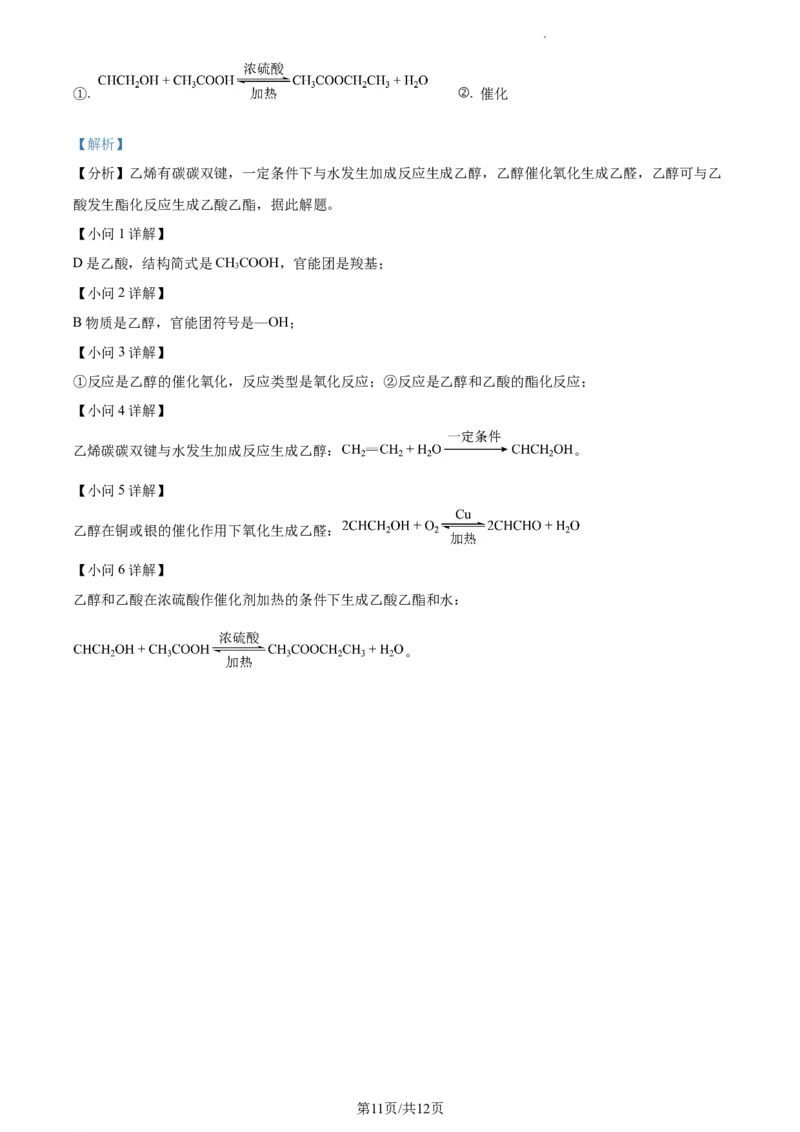
18. 已知乙烯能发生以下转化:
(1)D的结构简式为:_______,官能团的名称:_______。
(2)B中官能团的符号:_______。
(3)①的反应类型:_______。②的反应类型:_______。
(4)乙烯与水反应的化学方程式为:_______。
(5)写出①的化学反应方程式:_______。
(6)写出②的化学反应方程式:_______。浓硫酸的作用:_______剂和吸水剂。
【答案】(1) ①. CHCOOH ②. 羧基
3
(2)—OH (3) ①. 氧化反应 ②. 酯化反应
(4) (5) (6)
第10页/共12页
学科网(北京)股份有限公司①. ②. 催化
【解析】
【分析】乙烯有碳碳双键,一定条件下与水发生加成反应生成乙醇,乙醇催化氧化生成乙醛,乙醇可与乙
酸发生酯化反应生成乙酸乙酯,据此解题。
【小问1详解】
D是乙酸,结构简式是CHCOOH,官能团是羧基;
3
【小问2详解】
B物质是乙醇,官能团符号是—OH;
【小问3详解】
①反应是乙醇的催化氧化,反应类型是氧化反应;②反应是乙醇和乙酸的酯化反应;
【小问4详解】
乙烯碳碳双键与水发生加成反应生成乙醇: 。
【小问5详解】
乙醇在铜或银的催化作用下氧化生成乙醛:
【小问6详解】
乙醇和乙酸在浓硫酸作催化剂加热的条件下生成乙酸乙酯和水:
。
第11页/共12页
学科网(北京)股份有限公司第12页/共12页
学科网(北京)股份有限公司