文档内容
高二下学期期中考试化学试题
化 学
1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
2.选择题必须用2B 铅笔作答;非选择题必须用黑色字迹的签字笔作答。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16
第I卷 选择题
一、选择题(每小题只有一个选项符合题意。)
1. 进行萃取分液操作时一定不会用到以下哪种仪器
A. 冷凝管 B. 分液漏斗 C. 烧杯 D. 铁圈
2. 下列说法不正确的是
A. 原子光谱可以用于定性鉴定元素
B. 霓虹灯能发出五颜六色的光,发光机理与氢原子光谱形成机理基本相同
C. 原子线状光谱的产生是原子核外电子在不同的能级之间跃迁所导致
D. 利用光谱仪只能测得原子的发射光谱
3. 下列各化学键中,极性最小的是
A. H-F B. C-F C. O-F D. Si-F
4. 通过下列操作获得的物质不是晶体的是
A. 液态水急速冷却到-108℃ B. 凝华获得的碘
C. 从硫酸铜饱和溶液中析出的硫酸铜 D. 从熔融态以适当速率凝固获得的硫
5. 在有机化合物的研究过程中,能测出有机化合物相对分子质量的仪器是
A. 红外光谱仪 B. X-射线衍射仪 C. 质谱仪 D. 核磁共振仪
6. 金属的下列性质中,与自由电子无关的是
A. 延展性好 B. 容易导电 C. 密度大小 D. 易导热
7. 下列化合物中,分子间不存在氢键的是
A. NH B. HO C. HNO D. HBr
3 2 3
8. 离子晶体不可能具有的性质是( )
A. 较高的熔沸点 B. 良好的导电性
C. 溶于极性溶剂 D. 坚硬而易粉碎
9. 下列物质中,含有羟基官能团的是
A. CH-O-CH B. CH-CHO
3 3 3C. CH-CH-CH-OH D. CHCOOCH CH
3 2 2 3 2 3
10. 下列关于聚集状态 的叙述中,错误的是()
A. 物质只有气.液.固三种聚集状态
B. 气态是高度无序的体系存在状态
C. 固态中的原子或者分子结合的较紧凑,相对运动较弱
D. 液态物质的微粒间距离和作用力的强弱介于固.气两态之间,表现出明显的流动性
11. 氨分子中,两个N-H键的键角是
.
A 90o B. 107o C. 109o28 D. 120°
12. 下列有关晶胞的叙述,正确的是( )
A. 晶胞的结构是晶体的结构 B. 不同的晶体中晶胞的大小和形状都相同
C. 晶胞中的任何一个粒子都属于该晶胞 D. 已知晶胞的组成就可推知晶体的组成
13. 加热熔化只需破坏范德华力的物质是
A. 干冰 B. SiO C. Na D. MgCl
2 2
14. 氯的含氧酸根离子有 、 、 、 等,关于它们的说法不正确的是
A. 的中心Cl原子采取 杂化
B. 的空间结构为三角锥形
C. 的空间结构为直线形
D. 中Cl原子的杂化类型与 相同
15. 下列关于重结晶的说法,错误的是
A. 被重结晶提纯的物质在溶剂中的溶解度随温度变化大
B. 杂质在溶剂中溶解度很小或溶解度很大
C. 苯甲酸重结晶的步骤:加热溶解、冷却过滤、结晶
D. 重结晶的首要工作是选择适当的溶剂
16. 关于原子轨道,下述观点正确的是
A. 原子轨道是电子运动 的轨道
B. 原子轨道表示电子在空间各点出现的概率
C. 原子轨道表示电子在空间各点出现的概率密度
D. 某一原子轨道是电子的一个空间运动状态17. 甲烷分子不是以碳原子为中心的平面结构,而是以碳原子为中心的正四面体结构,其原因是甲烷的平
面结构解释不了下列事实
A. CHCl不存在同分异构体 B. CHCl 不存在同分异构体
3 2 2
C. CHCl 不存在同分异构体 D. CH 是非极性分子
3 4
18. 在[RuBr (NH )]+中.Ru的化合价和配位数分别是
2 3 4
A. +2和4 B. +2和6 C. +3和4 D. +3和 6
19. 下列说法正确的是
A. 由同一种原子形成的分子可能有极性 B. 非极性分子中无极性键
C. 三原子分子AB 一定为非极性分子 D. 四原子分子AB 一定为非极性分子
2 3
20. 甲烷和丙烷混和气的密度与同温同压下乙烷的密度相同,混和气中甲烷和丙烷的体积比是
A. 2:1 B. 3:1 C. 1:3 D. 1:1
第Ⅱ卷 非选择题
二、非选择题
21. 镓与第VA 族元素形成化合物是重要的半导体材料,应用最广泛的是砷化镓。
(1)基态镓原子的核外电子排布简式为_______
(2)镓失去电子的逐级电离能(kJ·mol-1)数值依次为577、1984.5、2961.8和 6192,由此可推知镓的主要化合
价为_______ 和+3价。砷的电负性比镓_______(填“大”成或”小”)。
(3)①比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因________
镓的卤化物 GaCl GaBr GaI
3 3 3
熔点/℃ 77.75 122.3 211.5
沸点/℃ 201.2 279 346
②GaF 的熔点超过1000℃,可能的原因是_______
3
22. A、D、E、G、J是短周期的五种非金属元素,其中A、D、E的价层电子排布式可表示为A:asa,D:
bsbbpb,E:csccp2c(a、b、c代表数字)(a、b、c代表数字)。A与D在不同周期,G与D同主族,J在E的
下一周期,J是同周期元素中电负性最大的元素。
(1)由以上元素组成的分子:DE、DA 、AJ中,属于极性分子的是_______。(填真实化学式)。
2 4
(2)A E和DJ 是两种常见溶剂,真实化学式分别为 _______ 和_______,DA 在前者中 的溶解度_______(填
2 4 2 4
“大于”或“小于”)在后者中的溶解度。
(3)GA 的沸点_______(填“高于”或“低于”)DA 的沸点,GE 的熔点_______(填“高于”或“低于”)DE 的熔点。
4 4 2 2
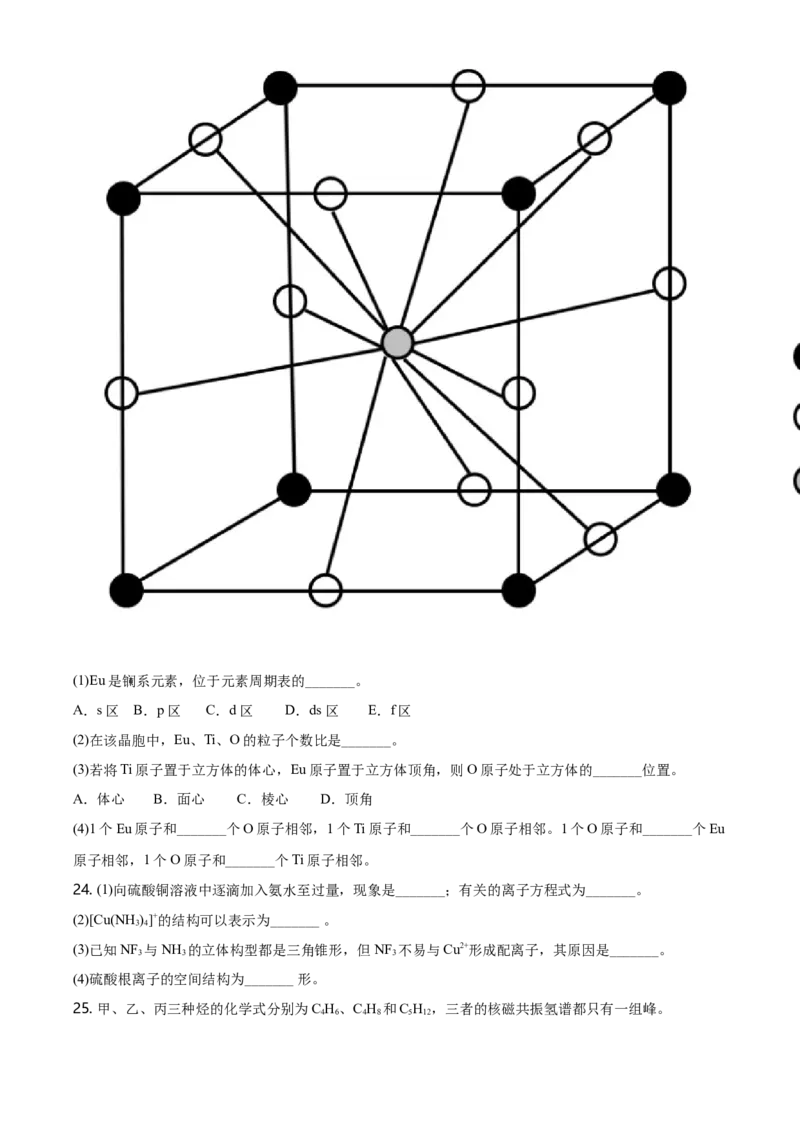
23. Eu、Ti和O形成一种化合物,其晶胞为如图所示的立方体。(1)Eu是镧系元素,位于元素周期表的_______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)在该晶胞中,Eu、Ti、O的粒子个数比是_______。
(3)若将Ti原子置于立方体的体心,Eu原子置于立方体顶角,则O原子处于立方体的_______位置。
A.体心 B.面心 C.棱心 D.顶角
(4)1个Eu原子和_______个O原子相邻,1个Ti原子和_______个O原子相邻。1个O原子和_______个Eu
原子相邻,1个O原子和_______个Ti原子相邻。
24. (1)向硫酸铜溶液中逐滴加入氨水至过量,现象是_______;有关的离子方程式为_______。
(2)[Cu(NH )]+的结构可以表示为_______ 。
3 4
(3)已知NF 与 NH 的立体构型都是三角锥形,但 NF 不易与Cu2+形成配离子,其原因是_______。
3 3 3
(4)硫酸根离子的空间结构为_______ 形。
25. 甲、乙、丙三种烃的化学式分别为C H、C H 和C H ,三者的核磁共振氢谱都只有一组峰。
4 6 4 8 5 12(1)甲的结构简式为_______,从官能团角度分类,甲属于_______烃。
(2)乙的结构简式为_______ 。
(3)丙的结构简式为_______,命名为_______ 。丙的同分异构体有_______种,其中一种异构体的结构简式
为_______,其核磁共振氢谱有_______组峰。