文档内容
下学期高二年
化学科期中测试
第Ⅰ卷(选择题 40分)
一、选择题(本题共有20小题,每小题2分,共40分,每小题只有一个选项符合题意)
1. 氢原子的电子云图中的小黑点表示的意义是 ( )
A. 一个小黑点表示一个电子 B. 黑点的多少表示电子个数的多少
C. 表示电子运动的轨迹 D. 电子在核外空间出现机会的多少
2. 下列分子中,其中心原子杂化轨道类型相同的是
A. 与 B. 与 C. 与 D. 与
3. 下列化合物中含有手性碳原子的是
A. CCl F B. C. CHCHOH D.
2 2 3 2
4. 某同学将P原子 的核外电子排布式写成 ,他违背了
A. 能量守恒原理 B. 泡利不相容原理 C. 能量最低原理 D. 洪特规则
5. 下列各组物质各自形成晶体,均属于分子晶体的化合物是
A. 、 、 B. 、 、
C. 、 、 D. 、 、
6. 许多金属盐都可以发生焰色反应,其原因是激发态 的电从能量高的轨道跃迁到能量低的轨道时,能量以
一定的波长(可见光区域)光的形式释放。下列现象和应用与电子跃迁无关的是A. 激光 B. 石墨导电 C. 霓虹灯 D. 原子光谱
7. 在第4周期元素中,4s轨道半充满的元素有
A. 2种 B. 3种 C. 4种 D. 5种
8. 下列有关微拉性质的比较中,正确的是
A. 原子半径: B. 最高正价:
C. 第一电离能: D. 电负性:
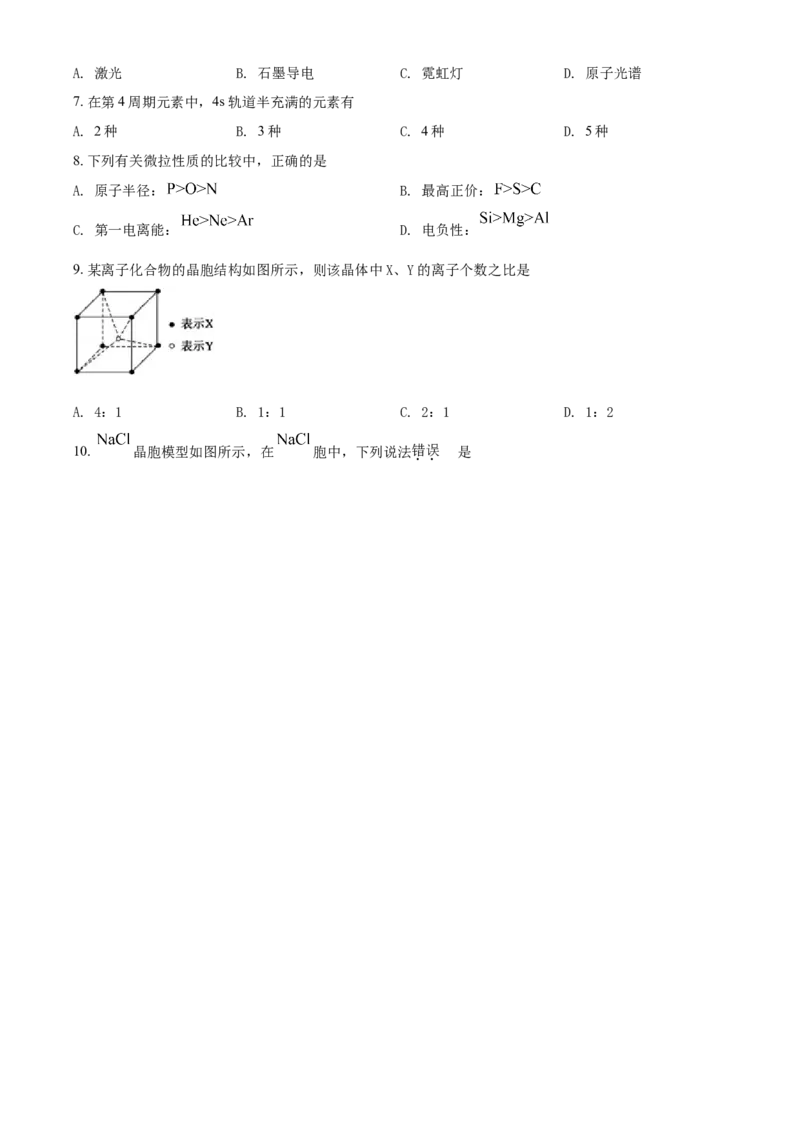
9. 某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是
A. 4:1 B. 1:1 C. 2:1 D. 1:2
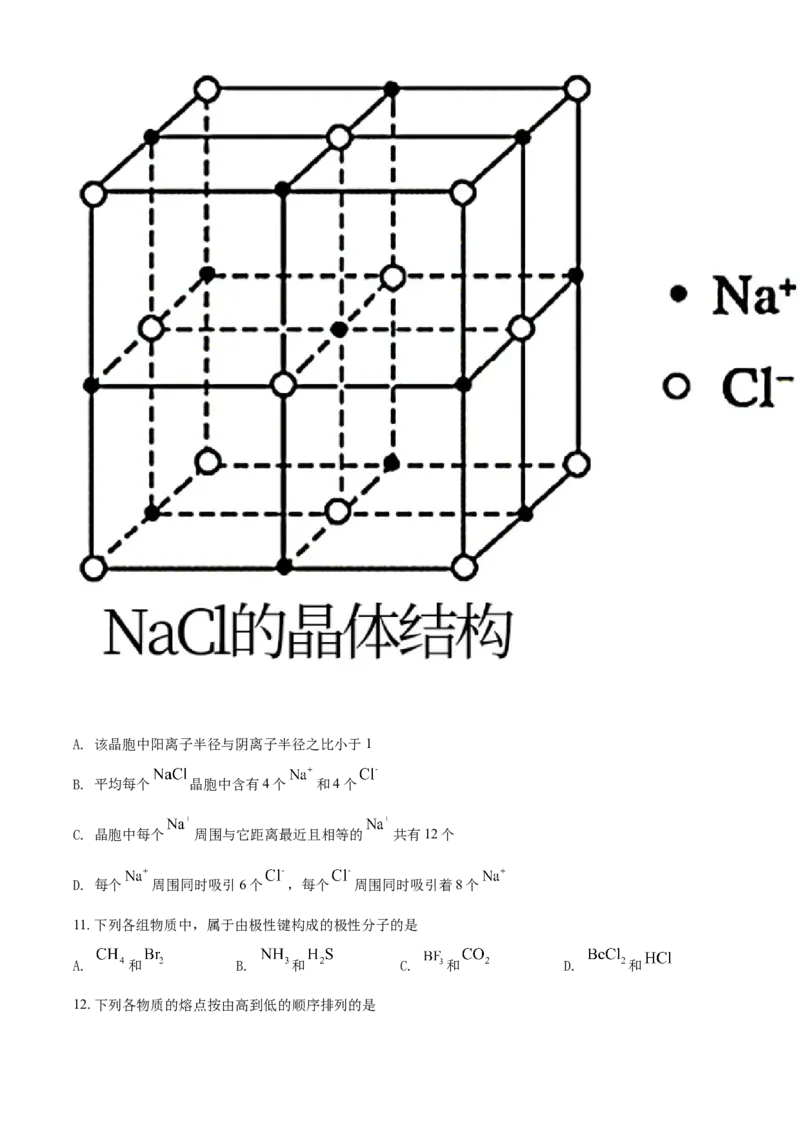
10. 晶胞模型如图所示,在 胞中,下列说法错误 的是A. 该晶胞中阳离子半径与阴离子半径之比小于1
B. 平均每个 晶胞中含有4个 和4个
C. 晶胞中每个 周围与它距离最近且相等的 共有12个
D. 每个 周围同时吸引6个 ,每个 周围同时吸引着8个
11. 下列各组物质中,属于由极性键构成的极性分子的是
A. 和 B. 和 C. 和 D. 和
12. 下列各物质的熔点按由高到低的顺序排列的是A. B. K Ca
C. Si D. 金刚石 硫磺 干冰
13. 甲醛( )在 催化作用下加氢可得甲醇( )。甲醛、甲醇分子内C原子的杂化方式分别为
A. B. C. D. sp
14. 二茂铁 是一种具有芳香族性质的有机金属化合物,熔点为172℃,沸点249℃,100℃以上
能升华。二茂铁属于
A. 原子晶体 B. 分子晶体 C. 金属晶体 D. 离子晶体
15. 下列说法正确的是
物质 氧化铝 氯化铝
沸点/K 2323 455.7
A. 氧化铝、氯化铝沸点相差极大,如表所示,是因为它们的晶体类型不同
B. 晶体中存在Na原子和氯原子
.
C 水从液态变成气态, 键断裂
D. 同一主族的C和Si的最高价氧化物晶体类型相同,熔沸点相差不大
16. 下列说法不正确的是
A. 稀有气体一般难于发生化学反应,是因为分子中键能较大
B. 已知石墨转化为金刚石要吸热,则等量的石墨与金刚石相比总键能大
C. HF、HCl、HBr、HI的热稳定性依次减弱,与共价键的键能大小有关
D. 共价键的键能越大,键长越短
17. 下列事实与氢键无关的是
A. 氨极易溶于水
B. 氧族元素形成的氢化物( 、 、 、 )中, 熔沸点最高
C. 熔沸点比 高
D. 、 、 、 熔点随相对分子质量增大而升高
18. 已知Ti3+可形成配位数为6的配合物。0.01mol 配合物TiCl ·6HO溶于水配成待测水溶液,在水溶液中
3 2加入过量硝酸银溶液,充分反应后,产生 沉淀。此配合物最有可能是
A. B.
C. D.
19. 原子数目和价电子总数都相等的分子或离子互为等电子体,等电子体具有相似的空间构型。下列各组
分子或离子的空间构型不相似的是
A. 和 B. 和 C. 和 D. 和
20. 与石墨结构相似的六方氮化硼(BN)晶体在高温高压下可以转化为立方氮化硼(BN),立方氮化硼的结构
与金刚石相似,硬度与金刚石相当。下列关于该物质的分析中正确的是
A. 六方氮化硼转化为立方氮化硼是物理变化
B. 立方氮化硼(BN)中氮元素的化合价为
C. 和 键相比, 键的键长更长
D. 立方氮化硼比晶体硅的熔点更高,硬度更大
第Ⅱ卷(非选择题 60分)
二、填空题(本题共7大题,共60分)
21. 有下列几种物质:A.晶体氦 B.石墨 C.氢氧化钾 D.晶体硅 E.干冰。请根据要求填空(填序号):
(1)不含化学键 的分子晶体是_______。
(2)属于原子晶体的是_______。
(3)晶体中不含离子键的化合物是_______。
(4)既有离子键又有共价键的是_______。
(5)受热熔化时,破坏两种作用力的是_______。
22. 有五种元素,它们的结构、性质等信息如下表所述:
元素 结构、性质等信息
a 焰色显黄色,该元素的某种合金是原子反应堆的导热剂
b b与a同周期,其最高价氧化物的水化物呈两性
c 元素的气态氢化物极易溶于水,可用作制冷剂
d 该元素所形成的化合物种类最多,其固态氧化物可用于人工降雨
e M层的d轨道上有2个空轨道(1)a元素原子的核外电子排布式为_______。
(2)b元素的元素符号是_______,其原子外有_______种电子运动状态不同的电子。
(3)c元素原子中能量最高的电子为_______轨道上的电子,轨道呈_______形。
(4)d元素有多种氢化物,其中一种分子式为 ,该分子中π键与σ键数目之比为_______。
(5)e元素原子的价电子轨道表示式为_______。
23. 下列是五种常见的短周期元素的电离能数据(单位: ):分析以上数据,回答下列问题:
(1)T元素在周期表中的位置是第_______周期_______族。
(2)已知上述五种元素中,有一种是稀有气体元素,则该元素的元素代号是_______。
(3)写出Y元素的氯化物的化学式_______(用含Y的化学式表示)。
(4)上述五种元素中,在周期表中最有可能处于同一主族的是_______。
A.Q和R B.T和X C.X和Y D.Q和X
两者中原子序数较大的是_______(用元素代号表示)。
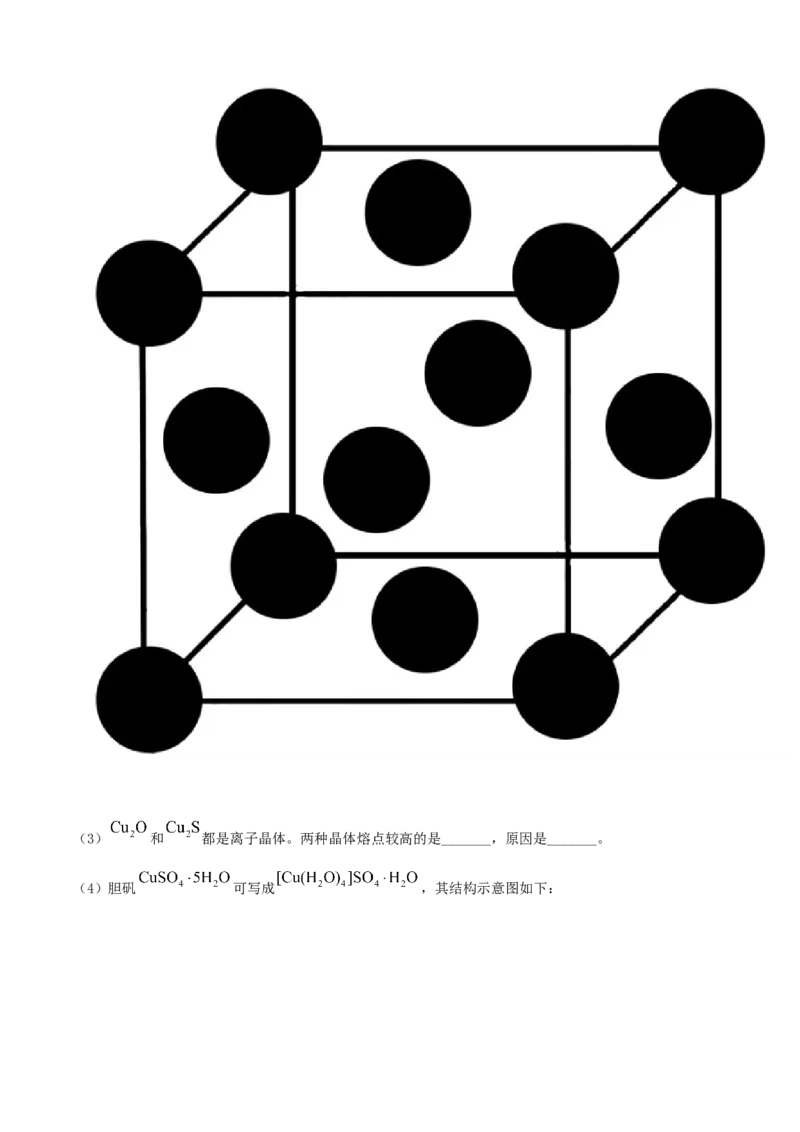
24. 铜的单质及其化合物在电池、合金、催化剂等方面广泛应用。
(1)基态Cu原子的外围电子排布式为_______。
(2)一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则
该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是_______。(3) 和 都是离子晶体。两种晶体熔点较高的是_______,原因是_______。
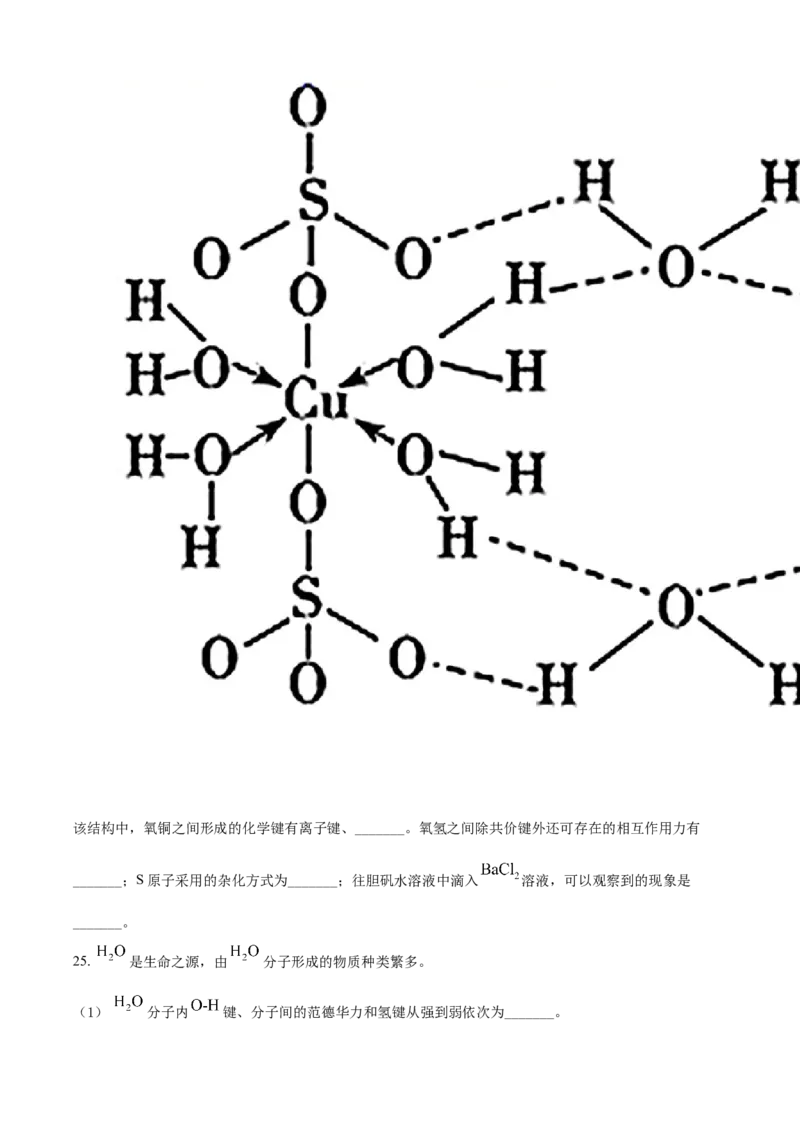
(4)胆矾 可写成 ,其结构示意图如下:该结构中,氧铜之间形成的化学键有离子键、_______。氧氢之间除共价键外还可存在的相互作用力有
_______;S原子采用的杂化方式为_______;往胆矾水溶液中滴入 溶液,可以观察到的现象是
_______。
25. 是生命之源,由 分子形成的物质种类繁多。
(1) 分子内 键、分子间的范德华力和氢键从强到弱依次为_______。(2) 可与 形成 , 是三角锥空间构型。 中O原子采用的杂化方式为_______。
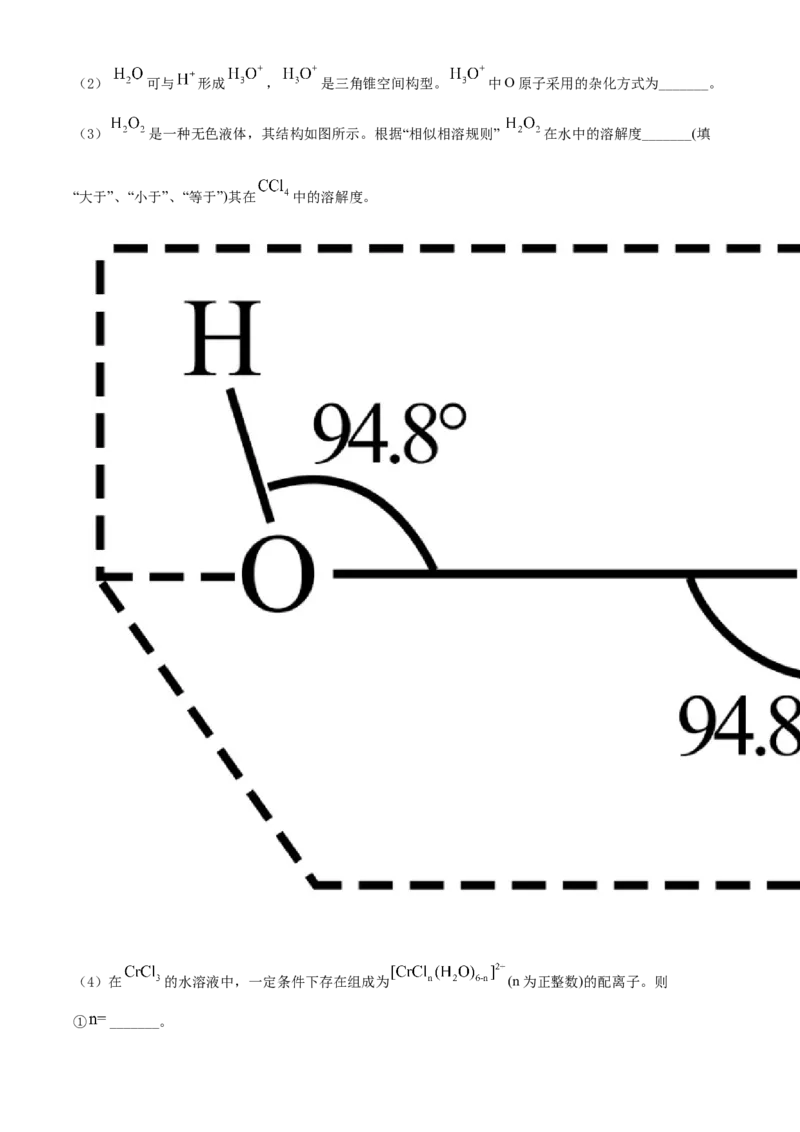
(3) 是一种无色液体,其结构如图所示。根据“相似相溶规则” 在水中的溶解度_______(填
“大于”、“小于”、“等于”)其在 中的溶解度。
(4)在 的水溶液中,一定条件下存在组成为 (n为正整数)的配离子。则
① _______。②在该配离子中,提供空轨道的元素是_______,提供孤电子对的是_______。
A. B.H C.O D.Cr
26. 以下材料在许多领域尤其是高技术产业,都是重要原料,广泛应用于航空航天测控、光纤通讯等领域。
回答下列问题:
(1)硅常用作半导体材料,基态硅原子的外围电子排布式为_______。
(2) 、 、 都是很好的半导体材料,熔点如表所示,分析其变化原因:_______。
熔点 1700℃ 1480℃ 1238℃
(3) 是一种储氢材料, 由 和 构成。
① 的未成对电子数有_______个。
② 离子的结构式为_______(用“→”标出配位键)。
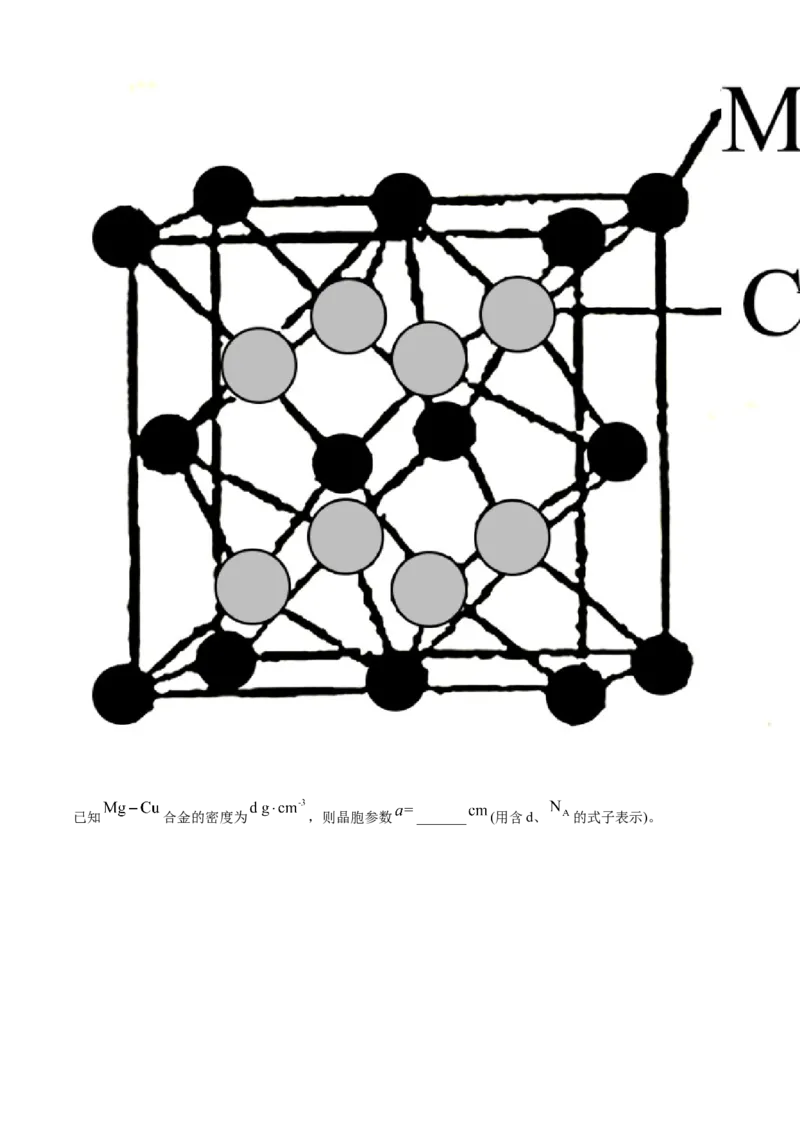
(4) 合金可用作储氢材料,具有大容量、寿命高、耐低温等特点。其晶胞如图所示(相对原子质
量: )已知 合金的密度为 ,则晶胞参数 _______ (用含d、 的式子表示)。