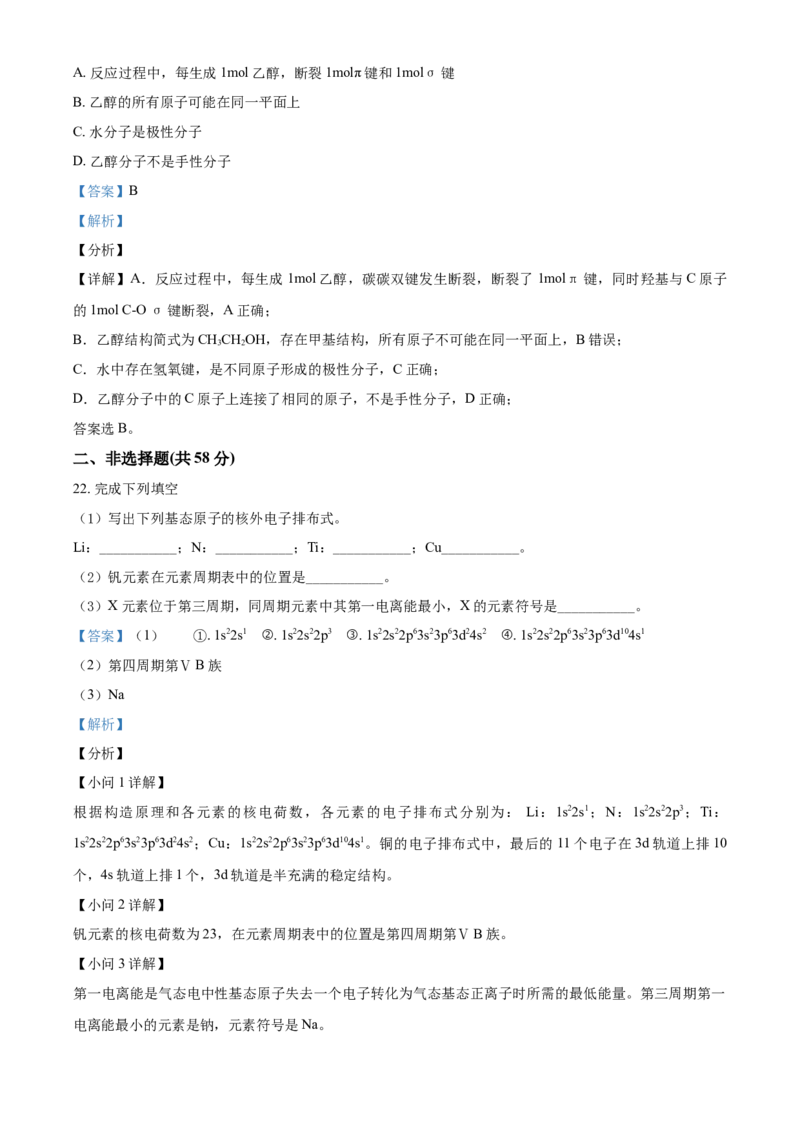文档内容
北京市昌平区 2020-2021 学年高二下学期期末考试
化学试题
一、选择题(共42分)本部分共21道小题,每小题2分,共42分。请在每小题列出的4个选
项中,选出符合题目要求的1个选项。
1. 下列属于烃的衍生物的是
A. 丙三醇 B. 甲烷 C. 甲苯 D. 乙烯
【答案】A
【解析】
【分析】
【详解】烃的衍生物是可以看做烃中的氢原子被其他原子或原子团取代而衍生的一系列有机物,甲烷、甲
苯和乙烯都是仅由碳和氢两元素组成的有机物,都是烃,而丙三醇可以看做是丙烷中的三个氢原子被羟基
取代的衍生物,是烃的衍生物,故选A。
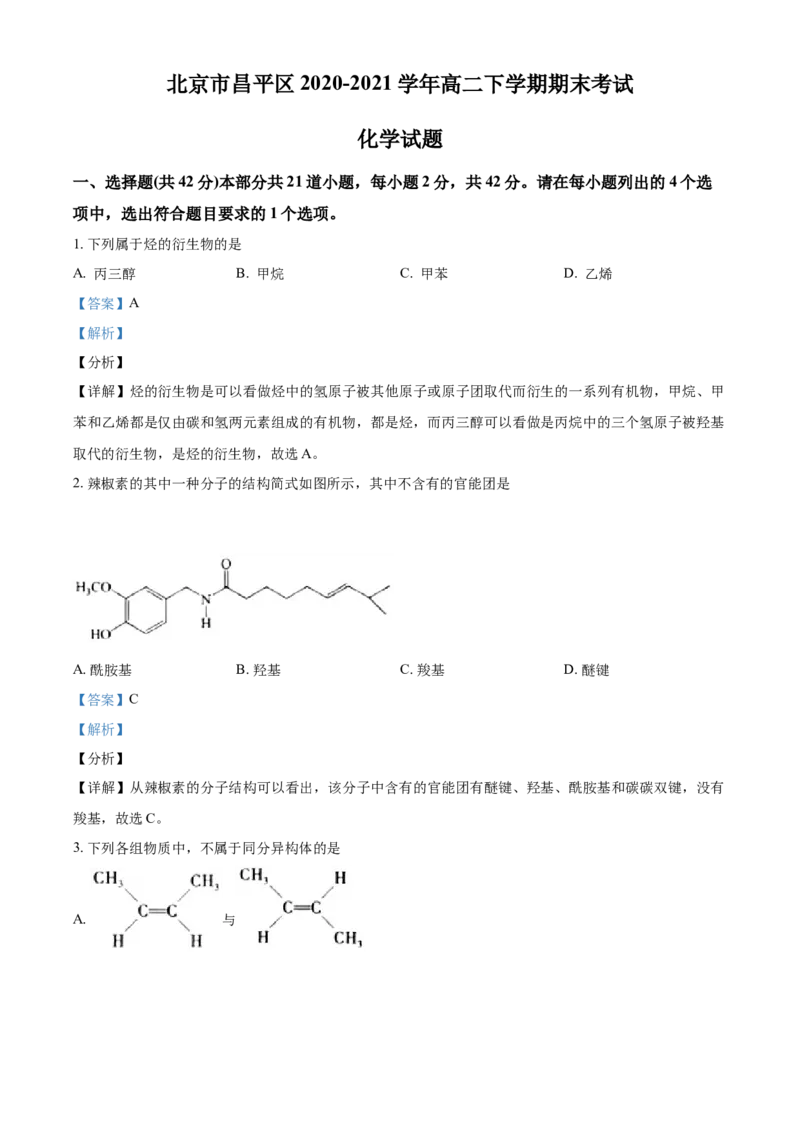
2. 辣椒素的其中一种分子的结构简式如图所示,其中不含有的官能团是
A. 酰胺基 B. 羟基 C. 羧基 D. 醚键
【答案】C
【解析】
【分析】
【详解】从辣椒素的分子结构可以看出,该分子中含有的官能团有醚键、羟基、酰胺基和碳碳双键,没有
羧基,故选C。
3. 下列各组物质中,不属于同分异构体的是
A. 与B. CHCHCHO与
3 2
C. HCC≡CCH 与CH≡CCHCH
3 3 2 3
D. CHCHCHCHCH 与
3 2 2 2 3
【答案】D
【解析】
【分析】分子式相同,结构不同的化合物互称为同分异构体。
【详解】A. 与 分子式相同,由于空间结构不同,互为顺反异
构,互为同分异构体,故A不选;
B.CHCHCHO与 分子式均为C HO,两者分子式相同,结构不同,互为同分异构体,故B
3 2 3 6
不选;
C.CHC CCH 与CH CCHCH 分子式均为C H,两者分子式相同,结构不同,互为同分异构体,故C
3 3 2 3 4 6
不选;
D.CHCHCHCHCH 分子式为C H , 的分子式为C H ,两者分子式不同,不能互
3 2 2 2 3 5 12 4 10
称为同分异构体,故D选;
答案选D。
4. 下列物质中,沸点最高的是
A. CHCHCH B. CHCHCHOH
3 2 3 3 2 2
C. CHOH D. CHCHCHCHOH
3 3 2 2 2
【答案】D
【解析】
【详解】因为醇的分子之间有通过醇羟基相连的氢键,所以稳定性高于 CHCHCH ,一元正醇,C原子数
3 2 3
越多,沸点也越高,沸点越高D为4个碳原子,碳原子最多,相对分子量最大,沸点最高,综上所述故选
D。5. 下列化合物中,能发生酯化、加成、消去三种反应的是
.
A B. CH-CH=CH-COOH
3
C. D.
【答案】C
【解析】
【分析】
【详解】A. 含有醇羟基,能发生酯化反应,连羟基
碳的相邻碳有氢原子,能发生消去反应,但不能发生加成反应,故A不符合题意;
B.CH-CH=CH-COOH含有羧基,能发生酯化反应,含有碳碳双键,能发生加成反应,不能发生消去
3
反应,故B不符合题意;
C. 含有醇羟基,能发生酯化反应,连羟基碳的
相邻碳有氢原子,能发生消去反应,含有醛基,能发生加成反应,故C符合题意;D.含有醇羟基,能发生酯化反应,连羟
基碳的相邻碳没有氢原子,不能发生消去反应,含有醛基和羰基,能发生加成反应,故D不符合题意;
综上所述,答案为C。
6. 下列各组有机物中,不能用酸性高锰酸钾溶液鉴别的是
A. 丙烷、丙烯 B. 苯、苯甲醇 C. 苯、苯甲醛 D. 苯、环己烷
【答案】D
【解析】
【详解】A.丙烯能使高锰酸钾酸性溶液褪色,丙烷不能使高锰酸钾酸性溶液褪色,可以用高锰酸钾酸性
溶液鉴别丙烷和丙烯,故A不符合题意;
B.苯甲醇能使高锰酸钾酸性溶液褪色,苯不能使高锰酸钾酸性溶液褪色,可以用高锰酸钾酸性溶液鉴别
苯和苯甲醇,故B不符合题意;
C.苯甲醛能使高锰酸钾酸性溶液褪色,苯不能使高锰酸钾酸性溶液褪色,可以用高锰酸钾酸性溶液鉴别
苯和苯甲醛,故C不符合题意;
D.苯和环己烷均不能使高锰酸钾酸性溶液褪色,不能用高锰酸钾酸性溶液鉴别苯和环己烷,故D符合题
意;
故答案为D。
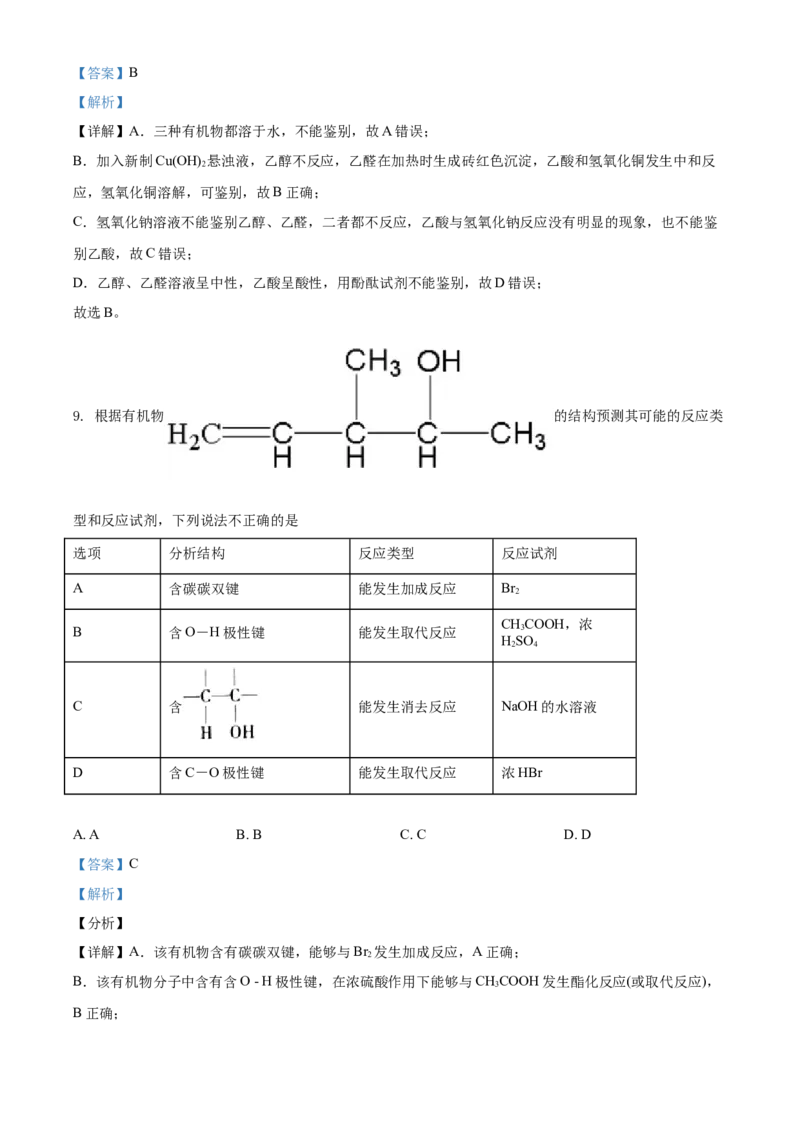
7. 对二甲苯(结构简式 )的核磁共振氢谱吸收峰数目是
A. 1 B. 2 C. 3 D. 4
【答案】B
【解析】
【详解】 有2种等效氢原子,则核磁共振氢谱吸收峰数目是 2,故答
案为B。
8. 可用于鉴别乙醇、乙醛、乙酸三种无色液体的一种试剂是
A. 水 B. 新制Cu(OH) 悬浊液
2
C. NaOH溶液 D. 酚酞溶液【答案】B
【解析】
【详解】A.三种有机物都溶于水,不能鉴别,故A错误;
B.加入新制Cu(OH) 悬浊液,乙醇不反应,乙醛在加热时生成砖红色沉淀,乙酸和氢氧化铜发生中和反
2
应,氢氧化铜溶解,可鉴别,故B正确;
C.氢氧化钠溶液不能鉴别乙醇、乙醛,二者都不反应,乙酸与氢氧化钠反应没有明显的现象,也不能鉴
别乙酸,故C错误;
D.乙醇、乙醛溶液呈中性,乙酸呈酸性,用酚酞试剂不能鉴别,故D错误;
故选B。
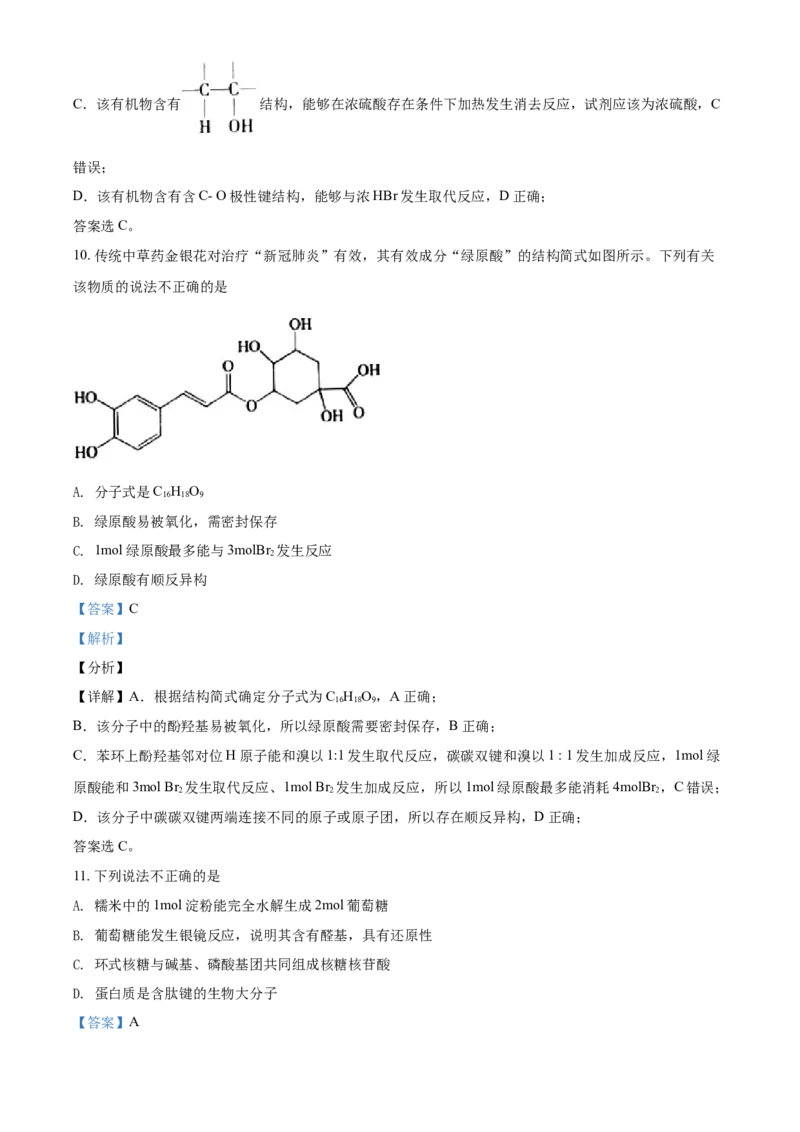
9. 根据有机物 的结构预测其可能的反应类
型和反应试剂,下列说法不正确的是
选项 分析结构 反应类型 反应试剂
A 含碳碳双键 能发生加成反应 Br
2
CHCOOH,浓
B 含O-H极性键 能发生取代反应 3
HSO
2 4
C 含 能发生消去反应 NaOH的水溶液
D 含C-O极性键 能发生取代反应 浓HBr
A. A B. B C. C D. D
【答案】C
【解析】
【分析】
【详解】A.该有机物含有碳碳双键,能够与Br 发生加成反应,A正确;
2
B.该有机物分子中含有含O - H极性键,在浓硫酸作用下能够与CHCOOH发生酯化反应(或取代反应),
3
B正确;C.该有机物含有 结构,能够在浓硫酸存在条件下加热发生消去反应,试剂应该为浓硫酸,C
错误;
D.该有机物含有含C- O极性键结构,能够与浓HBr发生取代反应,D正确;
答案选C。
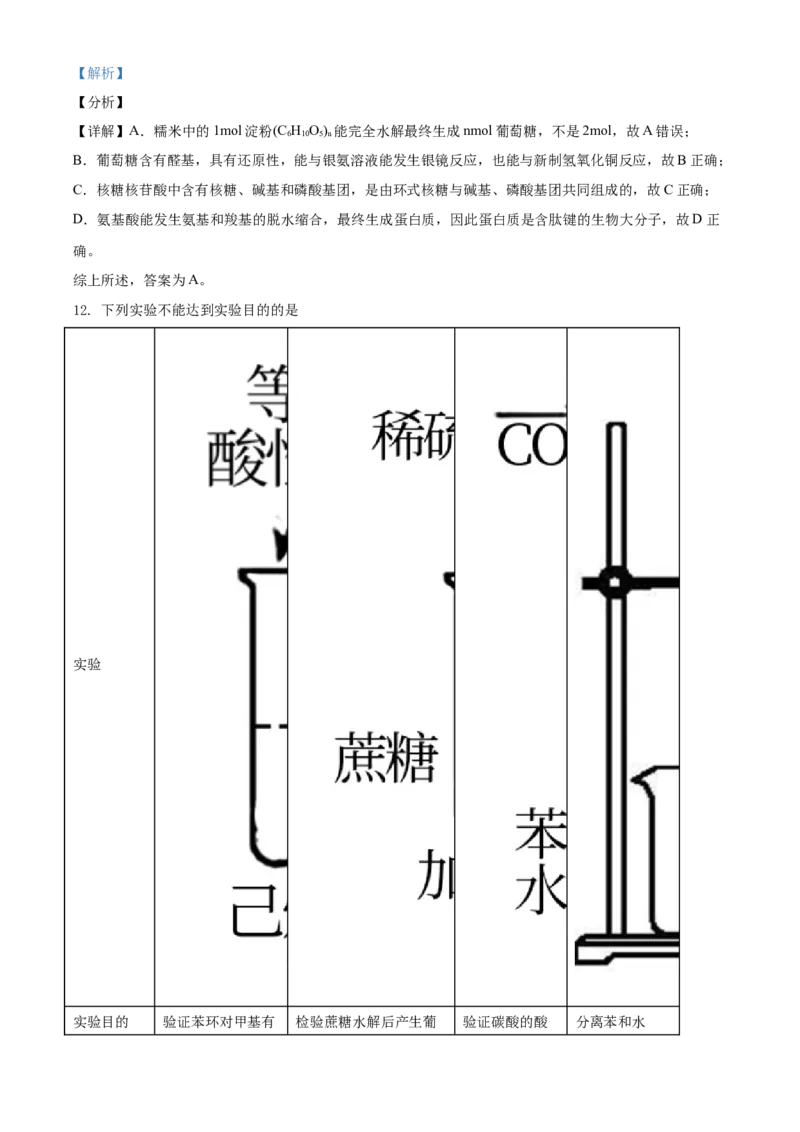
10. 传统中草药金银花对治疗“新冠肺炎”有效,其有效成分“绿原酸”的结构简式如图所示。下列有关
该物质的说法不正确的是
A. 分子式是C H O
16 18 9
B. 绿原酸易被氧化,需密封保存
C. 1mol绿原酸最多能与3molBr 发生反应
2
D. 绿原酸有顺反异构
【答案】C
【解析】
【分析】
【详解】A.根据结构简式确定分子式为C H O,A正确;
16 18 9
B.该分子中的酚羟基易被氧化,所以绿原酸需要密封保存,B正确;
C.苯环上酚羟基邻对位H原子能和溴以1:1发生取代反应,碳碳双键和溴以1 : 1发生加成反应,1mol绿
原酸能和3mol Br 发生取代反应、1mol Br 发生加成反应,所以1mol绿原酸最多能消耗4molBr ,C错误;
2 2 2
D.该分子中碳碳双键两端连接不同的原子或原子团,所以存在顺反异构,D正确;
答案选C。
11. 下列说法不正确的是
A. 糯米中的1mol淀粉能完全水解生成2mol葡萄糖
B. 葡萄糖能发生银镜反应,说明其含有醛基,具有还原性
C. 环式核糖与碱基、磷酸基团共同组成核糖核苷酸
D. 蛋白质是含肽键的生物大分子
【答案】A【解析】
【分析】
【详解】A.糯米中的1mol淀粉(C H O) 能完全水解最终生成nmol葡萄糖,不是2mol,故A错误;
6 10 5 n
B.葡萄糖含有醛基,具有还原性,能与银氨溶液能发生银镜反应,也能与新制氢氧化铜反应,故B正确;
C.核糖核苷酸中含有核糖、碱基和磷酸基团,是由环式核糖与碱基、磷酸基团共同组成的,故C正确;
D.氨基酸能发生氨基和羧基的脱水缩合,最终生成蛋白质,因此蛋白质是含肽键的生物大分子,故D正
确。
综上所述,答案为A。
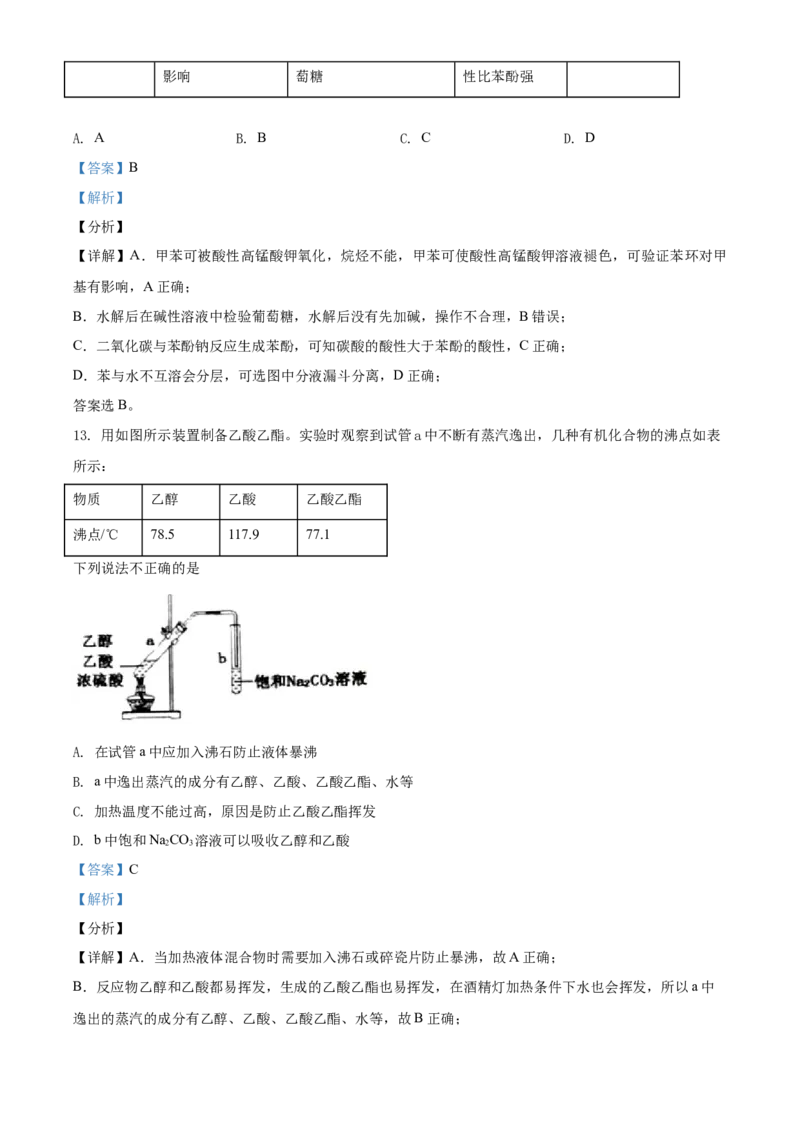
12. 下列实验不能达到实验目的的是
实验
实验目的 验证苯环对甲基有 检验蔗糖水解后产生葡 验证碳酸的酸 分离苯和水影响 萄糖 性比苯酚强
A. A B. B C. C D. D
【答案】B
【解析】
【分析】
【详解】A.甲苯可被酸性高锰酸钾氧化,烷烃不能,甲苯可使酸性高锰酸钾溶液褪色,可验证苯环对甲
基有影响,A正确;
B.水解后在碱性溶液中检验葡萄糖,水解后没有先加碱,操作不合理,B错误;
C.二氧化碳与苯酚钠反应生成苯酚,可知碳酸的酸性大于苯酚的酸性,C正确;
D.苯与水不互溶会分层,可选图中分液漏斗分离,D正确;
答案选B。
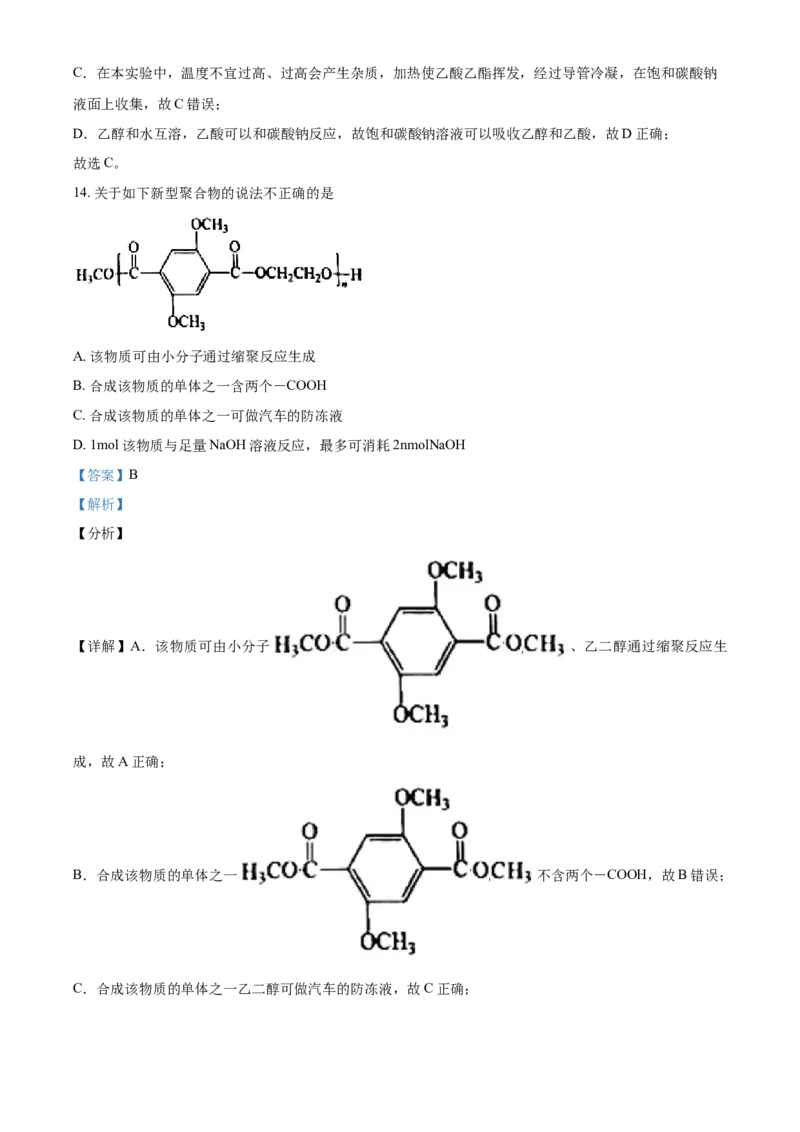
13. 用如图所示装置制备乙酸乙酯。实验时观察到试管a中不断有蒸汽逸出,几种有机化合物的沸点如表
所示:
物质 乙醇 乙酸 乙酸乙酯
沸点/℃ 78.5 117.9 77.1
下列说法不正确的是
A. 在试管a中应加入沸石防止液体暴沸
B. a中逸出蒸汽的成分有乙醇、乙酸、乙酸乙酯、水等
C. 加热温度不能过高,原因是防止乙酸乙酯挥发
D. b中饱和NaCO 溶液可以吸收乙醇和乙酸
2 3
【答案】C
【解析】
【分析】
【详解】A.当加热液体混合物时需要加入沸石或碎瓷片防止暴沸,故A正确;
B.反应物乙醇和乙酸都易挥发,生成的乙酸乙酯也易挥发,在酒精灯加热条件下水也会挥发,所以a中
逸出的蒸汽的成分有乙醇、乙酸、乙酸乙酯、水等,故B正确;C.在本实验中,温度不宜过高、过高会产生杂质,加热使乙酸乙酯挥发,经过导管冷凝,在饱和碳酸钠
液面上收集,故C错误;
D.乙醇和水互溶,乙酸可以和碳酸钠反应,故饱和碳酸钠溶液可以吸收乙醇和乙酸,故D正确;
故选C。
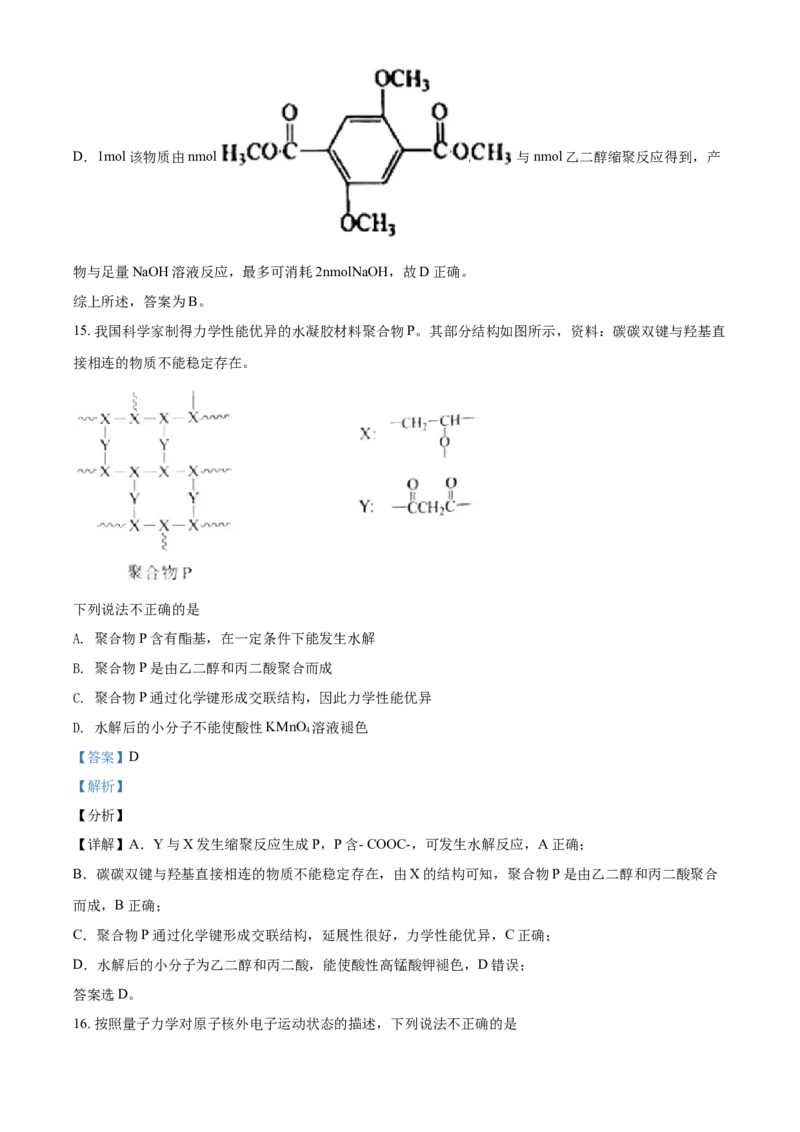
14. 关于如下新型聚合物的说法不正确的是
A. 该物质可由小分子通过缩聚反应生成
B. 合成该物质的单体之一含两个-COOH
C. 合成该物质的单体之一可做汽车的防冻液
D. 1mol该物质与足量NaOH溶液反应,最多可消耗2nmolNaOH
【答案】B
【解析】
【分析】
【详解】A.该物质可由小分子 、乙二醇通过缩聚反应生
成,故A正确;
B.合成该物质的单体之一 不含两个-COOH,故B错误;
C.合成该物质的单体之一乙二醇可做汽车的防冻液,故C正确;D.1mol该物质由nmol 与nmol乙二醇缩聚反应得到,产
物与足量NaOH溶液反应,最多可消耗2nmolNaOH,故D正确。
综上所述,答案为B。
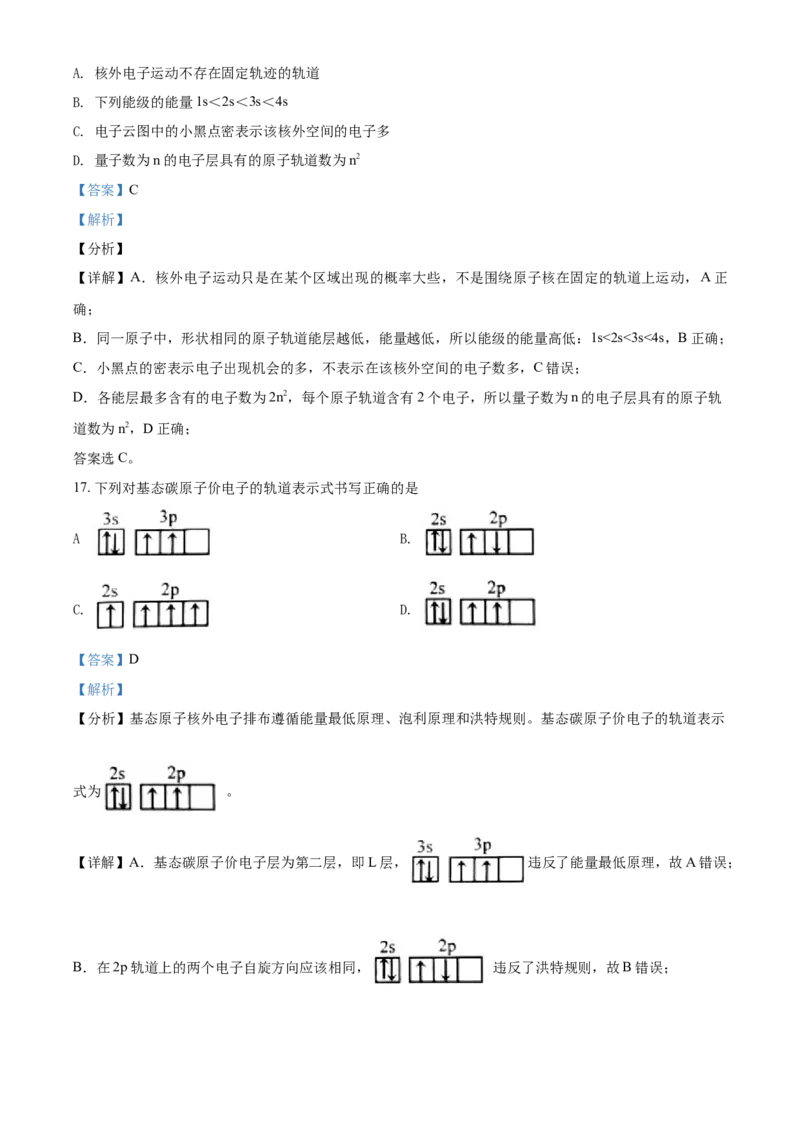
15. 我国科学家制得力学性能优异的水凝胶材料聚合物P。其部分结构如图所示,资料:碳碳双键与羟基直
接相连的物质不能稳定存在。
下列说法不正确的是
A. 聚合物P含有酯基,在一定条件下能发生水解
B. 聚合物P是由乙二醇和丙二酸聚合而成
C. 聚合物P通过化学键形成交联结构,因此力学性能优异
D. 水解后的小分子不能使酸性KMnO 溶液褪色
4
【答案】D
【解析】
【分析】
【详解】A.Y与X发生缩聚反应生成P,P含- COOC-,可发生水解反应,A正确;
B.碳碳双键与羟基直接相连的物质不能稳定存在,由X的结构可知,聚合物P是由乙二醇和丙二酸聚合
而成,B正确;
C.聚合物P通过化学键形成交联结构,延展性很好,力学性能优异,C正确;
D.水解后的小分子为乙二醇和丙二酸,能使酸性高锰酸钾褪色,D错误;
答案选D。
16. 按照量子力学对原子核外电子运动状态的描述,下列说法不正确的是A. 核外电子运动不存在固定轨迹的轨道
B. 下列能级的能量1s<2s<3s<4s
C. 电子云图中的小黑点密表示该核外空间的电子多
D. 量子数为n的电子层具有的原子轨道数为n2
【答案】C
【解析】
【分析】
【详解】A.核外电子运动只是在某个区域出现的概率大些,不是围绕原子核在固定的轨道上运动,A正
确;
B.同一原子中,形状相同的原子轨道能层越低,能量越低,所以能级的能量高低:1s<2s<3s<4s,B正确;
C.小黑点的密表示电子出现机会的多,不表示在该核外空间的电子数多,C错误;
D.各能层最多含有的电子数为2n2,每个原子轨道含有2个电子,所以量子数为n的电子层具有的原子轨
道数为n2,D正确;
答案选C。
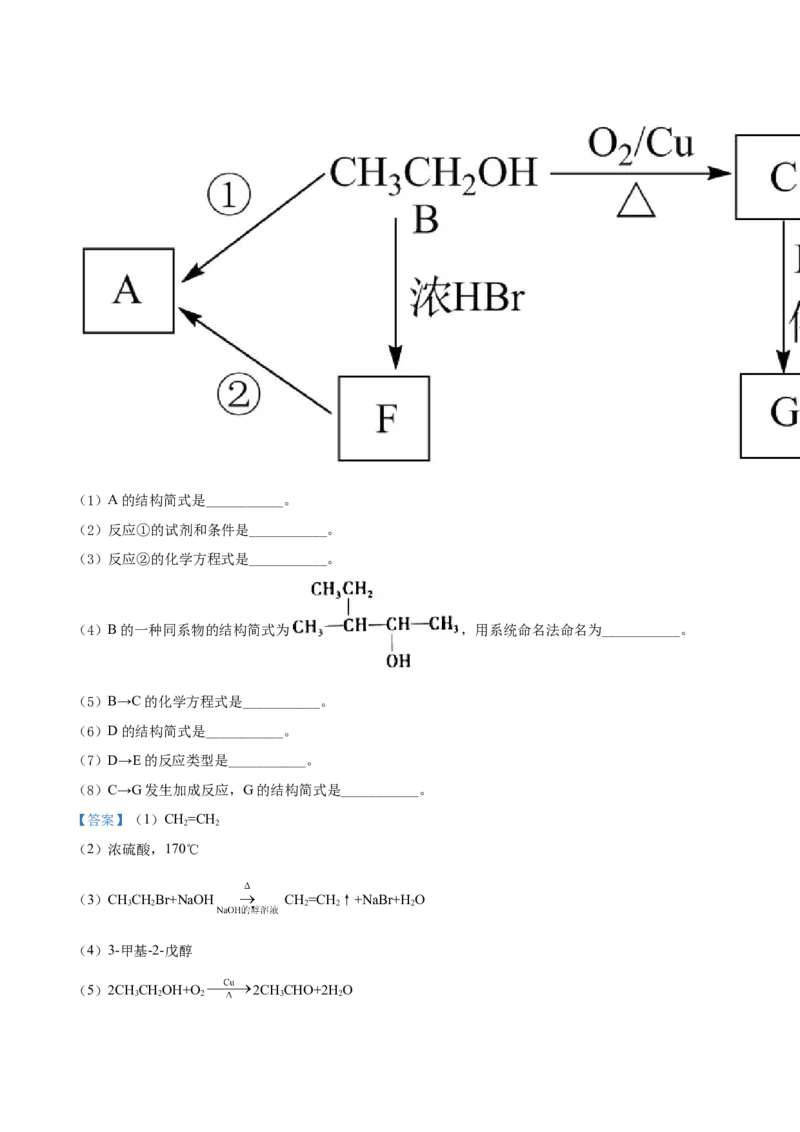
17. 下列对基态碳原子价电子的轨道表示式书写正确的是
.
A B.
C. D.
【答案】D
【解析】
【分析】基态原子核外电子排布遵循能量最低原理、泡利原理和洪特规则。基态碳原子价电子的轨道表示
式为 。
【详解】A.基态碳原子价电子层为第二层,即L层, 违反了能量最低原理,故A错误;
B.在2p轨道上的两个电子自旋方向应该相同, 违反了洪特规则,故B错误;C.2s轨道上应该排布2个电子, 违反了能量最低原理,此排布式为激发态碳原子的价
电子轨道表示式,故C错误;
D. 符合能量最低原理、泡利原理和洪特规则,故D正确;
故答案为D。
18. 电负性是一种重要的元素性质,某些元素的电负性(鲍林标度)数值如下表所示:
元素 H Li O Al P S Cl
电负性 2.1 1.0 3.5 1.5 2.1 2.5 3.0
下列说法不正确 的是
A. LiAlH 中H是-1价,该物质具有还原性
4
B. 非金属性:O>Cl
C. H-Cl键比H-S键极性大
D. Si的电负性范围在2~3之间
【答案】D
【解析】
【分析】
【详解】A.Li、Al、H三种元素中,H的电负性最大,所以LiAlH 中H是-1价,该物质具有还原性,
4
故A正确;
B.O的电负性大于Cl,元素的电负性越大,其非金属性越强,所以非金属性:O>Cl,故B正确;
C.Cl的电负性大于S,则Cl和H形成的H-Cl键的极性比 S和H形成的H-S键极性大,故C正确;
D.Si位于周期表第三周期第ⅣA族,其电负性应介于它前面的元素Al和它后面的元素P之间,即Si的
电负性范围在1.5~2.1之间,故D错误;
故选D。
19. 对下列事实的解释不正确的是
选项 事实 解释
F、Cl、Br 、I 的范德华力逐渐
A F、Cl、Br 、I 的熔沸点依次升高 2 2 2 2
2 2 2 2 增强
在氯化钠晶体中,Na+可以吸引不同方向的
B 离子键具有饱和性
6个Cl﹣
C 浓CuCl 溶液显绿色,加水稀释过程中变蓝 Cu2+与Cl﹣、HO均能形成配合物
2 2D 铜金属具有良好的导电性 铜金属中有“自由电子”
A. A B. B C. C D. D
【答案】B
【解析】
【分析】
【详解】A.F 、Cl 、Br 、I 的相对分子质量逐渐增大,范德华力逐渐增强,所以F 、Cl 、Br 、I 的熔沸
2 2 2 2 2 2 2 2
点依次升高,故A正确;
B.当两个异电荷离子彼此吸引形成离子键后,由于离子的电场无方向性,各自仍具有吸引异电荷离子的
能力,只要空间条件许可,每种离子均可结合更多的异电荷离子,因此离子键无饱和性,故B错误;
C.Cu2+与Cl﹣形成的[CuCl ]2-为黄色,Cu2+与HO形成的[Cu(H O) ]2+为蓝色,在溶液中存在平衡:[CuCl ]2-
4 2 2 4 4
+4H O [Cu(H O) ]2++4Cl-,所以浓CuCl 溶液显绿色,加水稀释,平衡正向移动,溶液变蓝,故C正确;
2 2 4 2
D.金属键理论认为,在金属晶体中,金属原子脱落下来的价电子形成遍布整块晶体的“电子气”被所有原
子所共用。当通电时,电子定向移动,所以一般金属都有良好的导电性,故D正确;
故选B。
20. 甲醛( )是生产胶粘剂的重要原料,下列说法不正确的是
A. 甲醛分子是平面三角形 B. C原子发生sp2杂化
C. 甲醛分子含有3个σ键 D. 甲醛分子含有2个π键
【答案】D
【解析】
【分析】
【详解】A.甲醛分子的中心原子碳原子是sp2杂化,所以甲醛分子是平面三角形,故A正确;
B.甲醛分子的中心原子碳原子的价层电子对数是3,发生sp2杂化,故B正确;
C.单键都是σ键,双键中有一个σ键,一个π键,所以甲醛分子含有3个σ键,故C正确;
D.甲醛分子含1个π键,故D错误;
故选D。
21. 乙烯在一定条件下反应生成乙醇,其化学方程式如下:CH=CH +H O CHCHOH,下
2 2 2 3 2
列说法不正确的是A. 反应过程中,每生成1mol乙醇,断裂1molπ键和1molσ键
B. 乙醇的所有原子可能在同一平面上
C. 水分子是极性分子
D. 乙醇分子不是手性分子
【答案】B
【解析】
【分析】
【详解】A.反应过程中,每生成1mol乙醇,碳碳双键发生断裂,断裂了1molπ键,同时羟基与C原子
的1mol C-O σ键断裂,A正确;
B.乙醇结构简式为CHCHOH,存在甲基结构,所有原子不可能在同一平面上,B错误;
3 2
C.水中存在氢氧键,是不同原子形成的极性分子,C正确;
D.乙醇分子中的C原子上连接了相同的原子,不是手性分子,D正确;
答案选B。
二、非选择题(共58分)
22. 完成下列填空
(1)写出下列基态原子的核外电子排布式。
Li:___________;N:___________;Ti:___________;Cu___________。
(2)钒元素在元素周期表中的位置是___________。
(3)X元素位于第三周期,同周期元素中其第一电离能最小,X的元素符号是___________。
【答案】(1) ①. 1s22s1 ②. 1s22s22p3 ③. 1s22s22p63s23p63d24s2 ④. 1s22s22p63s23p63d104s1
(2)第四周期第ⅤB族
(3)Na
【解析】
【分析】
【小问1详解】
根据构造原理和各元素的核电荷数,各元素的电子排布式分别为: Li:1s22s1;N:1s22s22p3;Ti:
1s22s22p63s23p63d24s2;Cu:1s22s22p63s23p63d104s1。铜的电子排布式中,最后的11个电子在3d轨道上排10
个,4s轨道上排1个,3d轨道是半充满的稳定结构。
【小问2详解】
钒元素的核电荷数为23,在元素周期表中的位置是第四周期第ⅤB族。
【小问3详解】
第一电离能是气态电中性基态原子失去一个电子转化为气态基态正离子时所需的最低能量。第三周期第一
电离能最小的元素是钠,元素符号是Na。23. 完成下列填空
(1)下列常见物质的空间结构呈直线形的是___________,呈平面三角形的是___________。中心原子轨
道采取sp3杂化的是___________,采取sp2杂化的是___________。
①BF ②CO ③NH ④CCl ⑤HC≡CH
3 2 3 4
(2)NF 是微电子工业中种优良的等离子蚀刻气体,利用杂化轨道理论解释其空间结构是三角锥形:
3
___________。
(3)某小组进行如下操作,观察到下列现象:
步骤1:向AgNO 溶液中逐滴滴加氨水,产生白色沉淀;
3
步骤2:继续滴加,沉淀消失,溶液变澄清。
①澄清溶液中含[Ag(NH)]+,其中含有的化学键类型有___________。
3 2
a.σ键 b.配位键 c.氢键
②已知:Ag++NH•H O AgOH↓+NH ,利用平衡移动原理解释步骤2的现象___________。
3 2
【答案】(1) ①. ②⑤ ②. ① ③. ③④ ④. ①
(2)NF 的中心原子N的价层电子对数=3+ (5-3×1)=4,则N采取sp3杂化,由于有一孤电子对,所以分
3
子结构是三角锥形
(3) ①. a b ②. 向硝酸银溶液中滴加氨水,发生反应Ag++NH•H O AgOH↓+NH ,生成白色
3 2
沉淀AgOH,AgOH在水溶液中存在电离平衡:AgOH Ag++OH-,继续滴加氨水,Ag+与NH 生成
3
[Ag(NH)]+,由于该配离子很稳定,促使AgOH的溶解平衡正向移动,AgOH逐渐溶解
3 2
【解析】
【分析】
【小问1详解】
①BF 的中心原子B的价层电子对数=3+ (3-3×1)=3,则B采取sp2杂化,分子结构是平面三角形;②CO
3 2
的中心原子C的价层电子对数=2+ (4-2×2)=2,则C采取sp杂化,分子结构为直线形;③NH 的中心原
3子N的价层电子对数=3+ (5-3×1)=4,则N采取sp3杂化,由于有一孤电子对,所以分子结构是三角锥形;
④ CCl 的中心原子 C 的价层电子对数=4+ (4-4×1)=4,则 C 采取 sp3杂化,分子结构是正四面体;
4
⑤HC≡CH为乙炔,是直线形分子,中心原子C的价层电子对数为2,采取sp杂化,分子结构是直线形。
故空间结构呈直线形的是②⑤;呈平面三角形的是①;中心原子轨道采取sp3杂化的是③④;采取sp2杂化
的是①。
【小问2详解】
NF 的中心原子N的价层电子对数=3+ (5-3×1)=4,则N采取sp3杂化,由于有一孤电子对,所以分子结构
3
是三角锥形。
【小问3详解】
①[Ag(NH)]+中有Ag+和NH 之间是配位键、构成NH 的N和H之间是σ键,故选a和 b。
3 2 3 3
②向硝酸银溶液中滴加氨水,发生反应Ag++NH•H O AgOH↓+NH ,生成白色沉淀AgOH,AgOH
3 2
在水溶液中存在电离平衡:AgOH Ag++OH-,继续滴加氨水,Ag+与NH 生成[Ag(NH)]+,由于该配
3 3 2
离子很稳定,促使AgOH的溶解平衡正向移动,AgOH逐渐溶解。
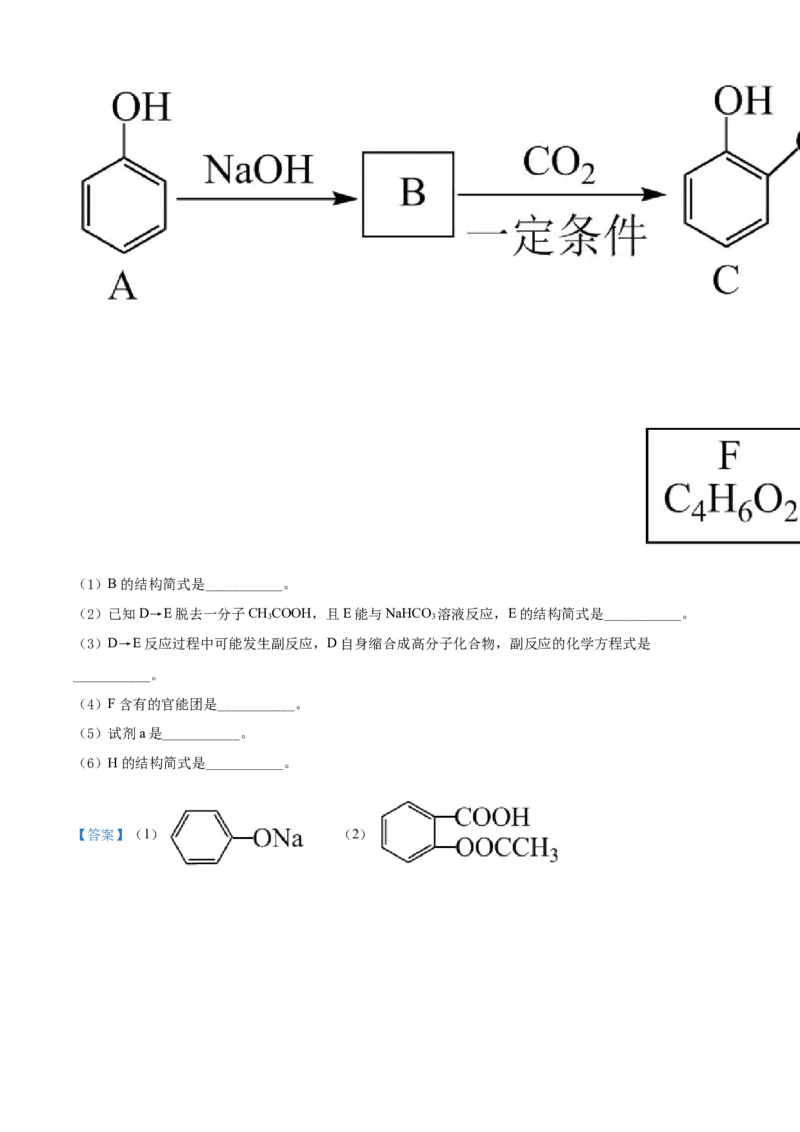
24. 几种有机物的转化关系如图所示(部分条件已省略)。(1)A的结构简式是___________。
(2)反应①的试剂和条件是___________。
(3)反应②的化学方程式是___________。
(4)B的一种同系物的结构简式为 ,用系统命名法命名为___________。
(5)B→C的化学方程式是___________。
(6)D的结构简式是___________。
(7)D→E的反应类型是___________。
(8)C→G发生加成反应,G的结构简式是___________。
【答案】(1)CH=CH
2 2
(2)浓硫酸,170℃
(3)CHCHBr+NaOH CH =CH ↑+NaBr+H O
3 2 2 2 2
(4)3-甲基-2-戊醇
(5)2CHCHOH+O 2CHCHO+2H O
3 2 2 3 2(6)CHCOOH (7)取代反应
3
(8)
【解析】
【分析】乙醇和浓HBr发生取代反应生成的F为CHCHBr,乙醇和CHCHBr都能发生消去反应生成乙烯,
3 2 3 2
故A为乙烯。乙醇在铜催化下被氧化为乙醛,故 C 为乙醛。乙醛和 HCN 发生加成反应生成的 G为
;乙醛发生银镜反应再酸化生成的D为乙酸,乙酸和氨反应生成E。
【小问1详解】
由以上分析可知,A为乙烯,结构简式是CH=CH 。
2 2
【小问2详解】
反应①是乙醇的消去反应,需要浓硫酸做催化剂和脱水剂,所以试剂是浓硫酸,反应需要加热到 170℃,
故反应条件是加热到170℃。
【小问3详解】
反应②是溴乙烷的消去反应,化学方程式是:CHCHBr+NaOH CH =CH ↑+NaBr+H O。
3 2 2 2 2
【小问4详解】
根据系统命名法, 的主链有5个碳原子,从离官能团羟基最近的一端编号,
,名称为3-甲基-2-戊醇。
【小问5详解】
B→C是乙醇的催化氧化,化学方程式是:2CHCHOH+O 2CHCHO+2H O。
3 2 2 3 2
【小问6详解】
由以上分析可知,D为乙酸,结构简式是CHCOOH。
3
【小问7详解】D→E是乙酸中的羟基被氨基取代,反应类型是取代反应。
【小问8详解】
C→G发生加成反应,G的结构简式是 。
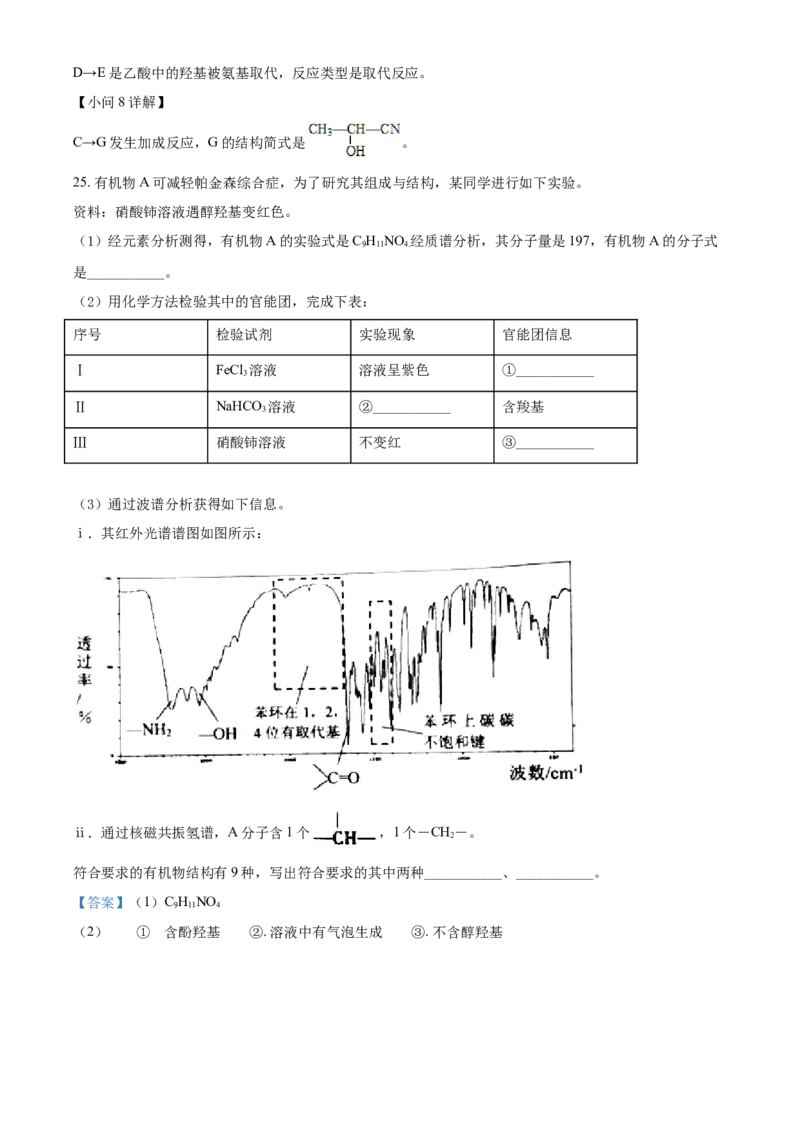
25. 有机物A可减轻帕金森综合症,为了研究其组成与结构,某同学进行如下实验。
资料:硝酸铈溶液遇醇羟基变红色。
(1)经元素分析测得,有机物A的实验式是C H NO 经质谱分析,其分子量是197,有机物A的分子式
9 11 4.
是___________。
(2)用化学方法检验其中的官能团,完成下表:
序号 检验试剂 实验现象 官能团信息
Ⅰ FeCl 溶液 溶液呈紫色 ①___________
3
Ⅱ NaHCO 溶液 ②___________ 含羧基
3
Ⅲ 硝酸铈溶液 不变红 ③___________
(3)通过波谱分析获得如下信息。
ⅰ.其红外光谱谱图如图所示:
ⅱ.通过核磁共振氢谱,A分子含1个 ,1个-CH-。
2
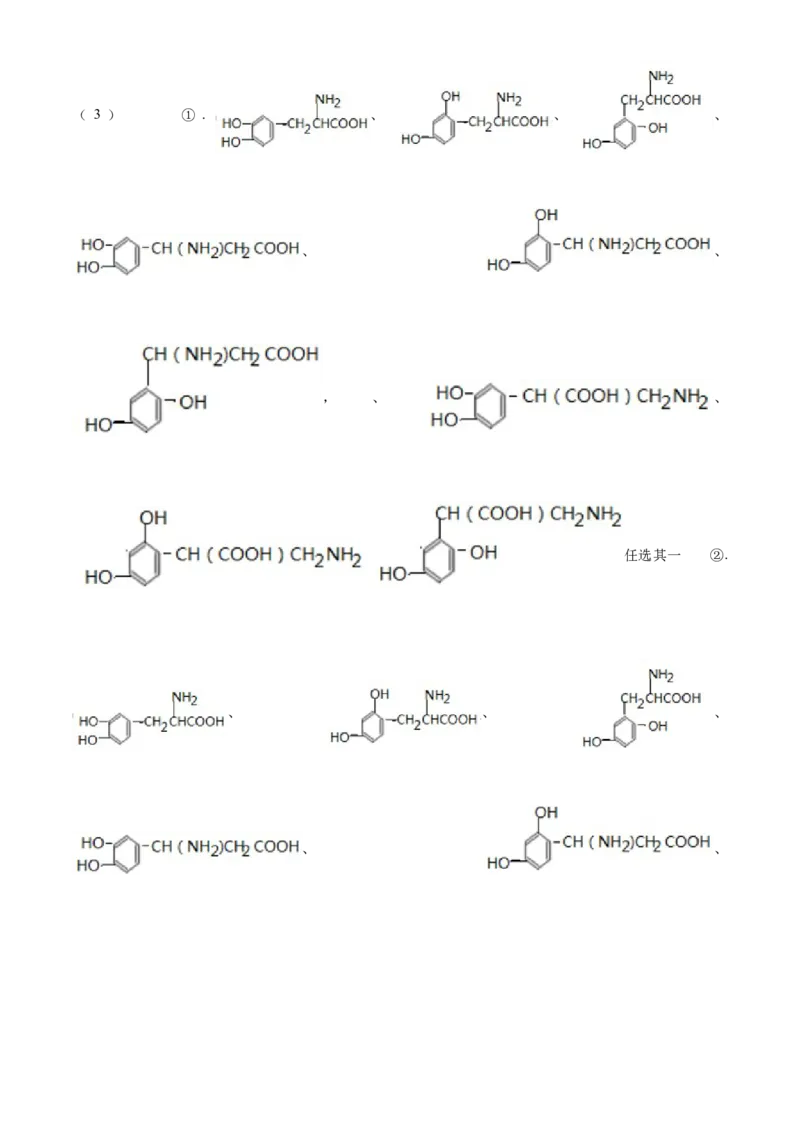
符合要求的有机物结构有9种,写出符合要求的其中两种___________、___________。
【答案】(1)C H NO
9 11 4
.
(2) ① 含酚羟基 ②. 溶液中有气泡生成 ③. 不含醇羟基( 3 ) ① . 、 、 、
、 、
, 、 、
任选其一 ②.
、 、 、
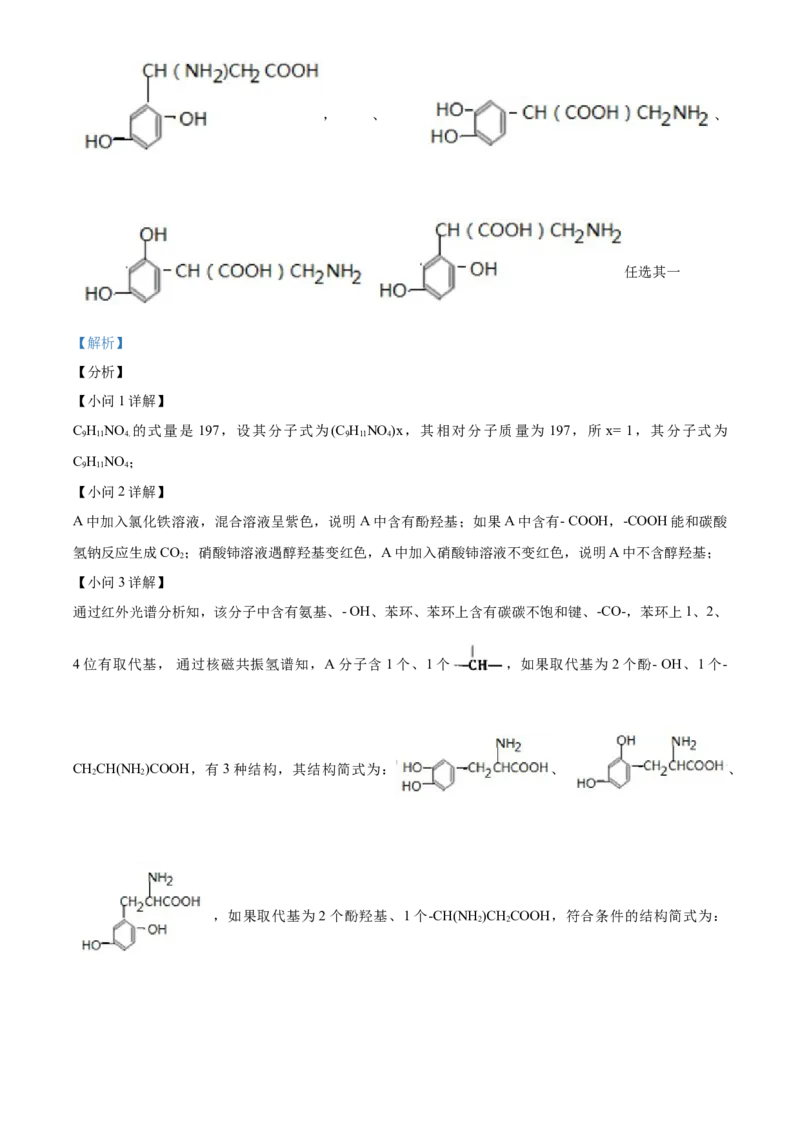
、 、, 、 、
任选其一
【解析】
【分析】
【小问1详解】
C H NO 的式量是 197,设其分子式为(C H NO )x,其相对分子质量为 197,所 x= 1,其分子式为
9 11 4. 9 11 4
C H NO ;
9 11 4
【小问2详解】
A中加入氯化铁溶液,混合溶液呈紫色,说明A中含有酚羟基;如果A中含有- COOH,-COOH能和碳酸
氢钠反应生成CO;硝酸铈溶液遇醇羟基变红色,A中加入硝酸铈溶液不变红色,说明A中不含醇羟基;
2
【小问3详解】
通过红外光谱分析知,该分子中含有氨基、- OH、苯环、苯环上含有碳碳不饱和键、-CO-,苯环上1、2、
4位有取代基, 通过核磁共振氢谱知,A分子含1个、1个 ,如果取代基为2个酚- OH、1个-
CHCH(NH)COOH,有3种结构,其结构简式为: 、 、
2 2
,如果取代基为2个酚羟基、1个-CH(NH)CHCOOH,符合条件的结构简式为:
2 2、 、
,如果取代基为两个酚羟基,1个-CH(COOH)CH NH ,有3种结
2 2
构 , 符 合 条 件 的 有 : 、
,在 9 种中选 2
种即可。
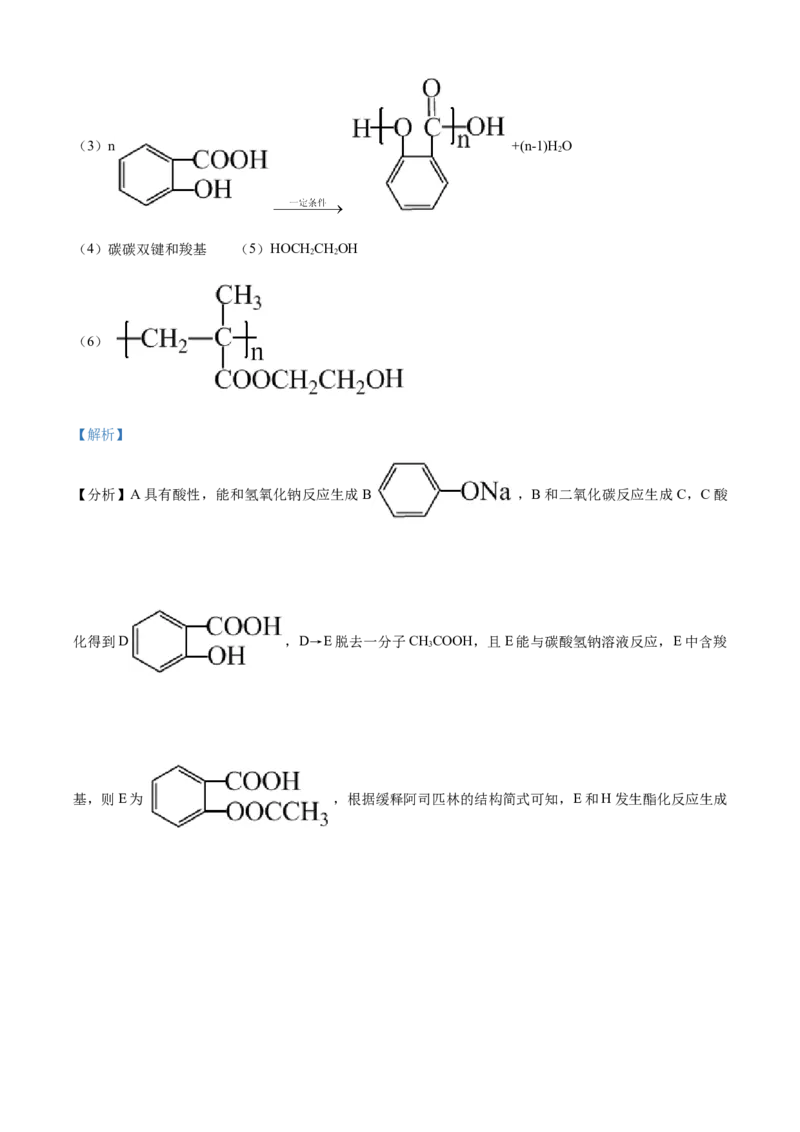
26. 缓释阿司匹林是种常用的解热镇痛类药物,其合成路线如下:(1)B的结构简式是___________。
(2)已知D→E脱去一分子CHCOOH,且E能与NaHCO 溶液反应,E的结构简式是___________。
3 3
(3)D→E反应过程中可能发生副反应,D自身缩合成高分子化合物,副反应的化学方程式是
___________。
(4)F含有的官能团是___________。
(5)试剂a是___________。
(6)H的结构简式是___________。
【答案】(1) (2)(3)n +(n-1)HO
2
(4)碳碳双键和羧基 (5)HOCH CHOH
2 2
(6)
【解析】
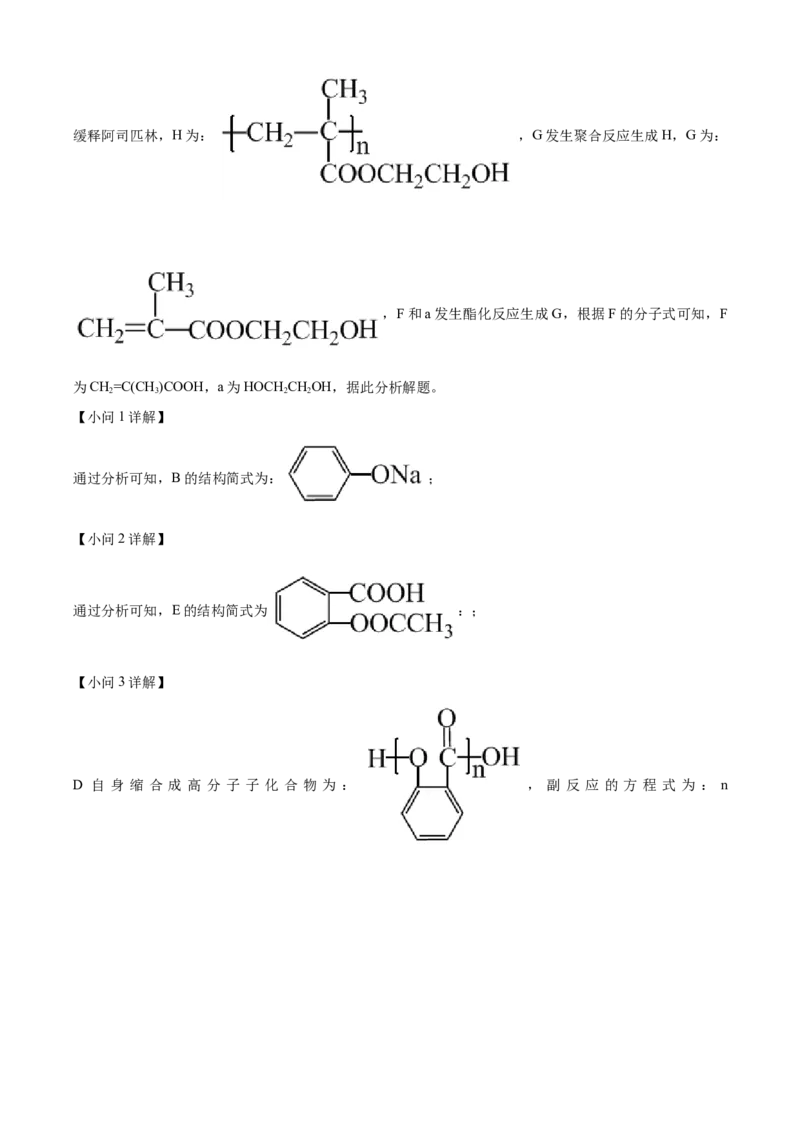
【分析】A具有酸性,能和氢氧化钠反应生成B ,B和二氧化碳反应生成C,C酸
化得到D ,D→E脱去一分子CHCOOH,且E能与碳酸氢钠溶液反应,E中含羧
3
基,则E为 ,根据缓释阿司匹林的结构简式可知,E和H发生酯化反应生成缓释阿司匹林,H为: ,G发生聚合反应生成H,G为:
,F和a发生酯化反应生成G,根据F的分子式可知,F
为CH=C(CH )COOH,a为HOCH CHOH,据此分析解题。
2 3 2 2
【小问1详解】
通过分析可知,B的结构简式为: ;
【小问2详解】
通过分析可知,E的结构简式为 :;
【小问3详解】
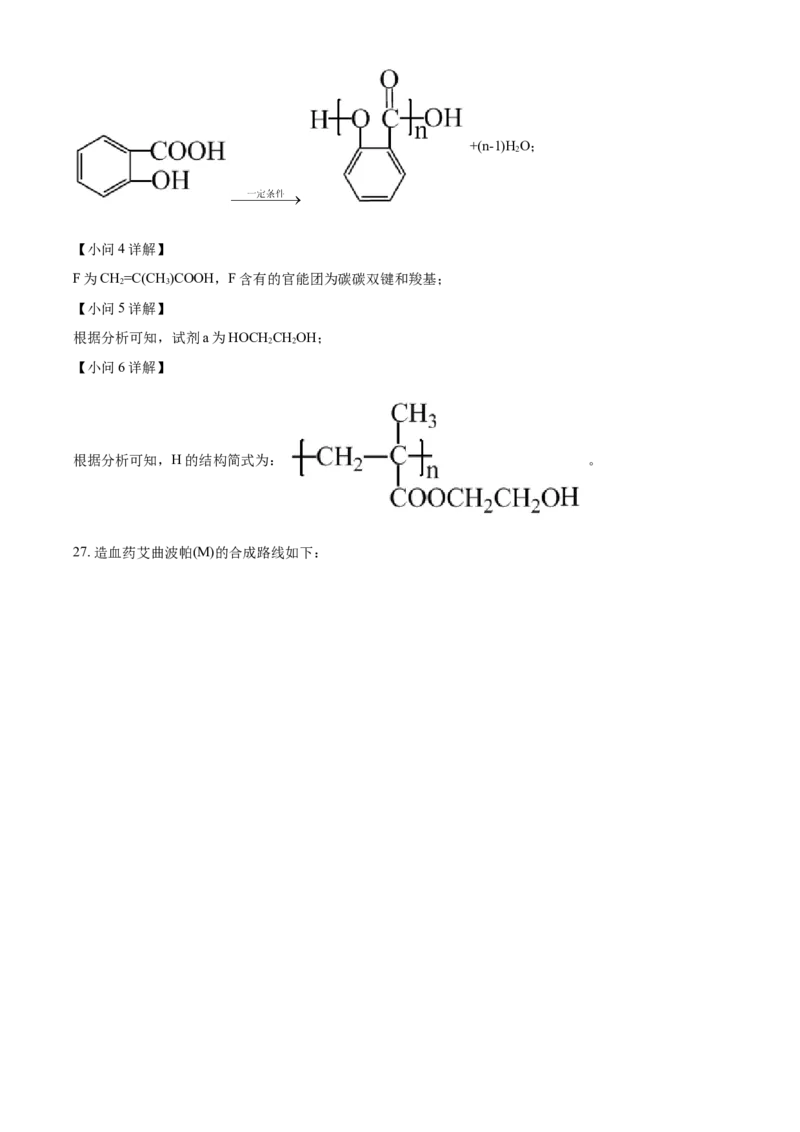
D 自 身 缩 合 成 高 分 子 子 化 合 物 为 : , 副 反 应 的 方 程 式 为 : n+(n-1)HO;
2
【小问4详解】
F为CH=C(CH )COOH,F含有的官能团为碳碳双键和羧基;
2 3
【小问5详解】
根据分析可知,试剂a为HOCH CHOH;
2 2
【小问6详解】
根据分析可知,H的结构简式为: 。
27. 造血药艾曲波帕(M)的合成路线如下:已知:ⅰ.R OH+R NH
1 2 2
ⅱ.R B(OH) +R Br R -R
1 2 2 1 2
ⅲ.R NHNH +
1 2ⅳ.R NH +R CHR
1 2 2 2 3
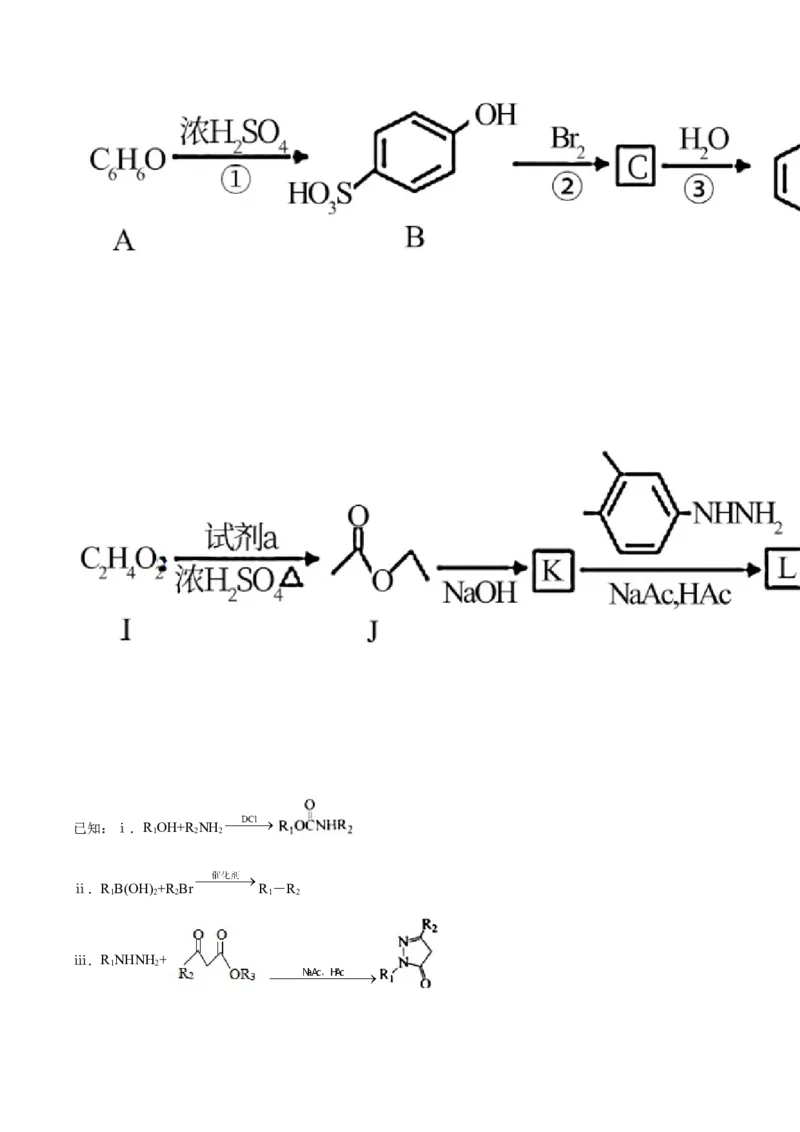
(1)A的结构简式是___________。
(2)对比A与D的结构简式,设计①~③三步反应实现转化的目的是___________。
(3)I→J的化学方程式是___________。
(4)由E经两步反应可得到F,F含2种环状结构,转化路线如下:
E M F
①E→M的反应类型是___________。
②F的结构简式是___________。
(5)H的结构简式是___________。
(6)L的结构简式是___________。
(7)已知每生成1molK需2molJ,J→K的化学方程式是___________。
【答案】(1) (2)使溴原子定位在羟基的邻位上而不是对位
(3)CHCOOH+C HOH CHCOOC H+H O
3 2 5 3 2 5 2
(4) ①. 还原反应 ②.
( 5 ) ( 6 ) ( 7 ) 2CHCOOC H
3 2 5
CHCOCH COOC H+C HOH
3 2 2 5 2 5
【解析】
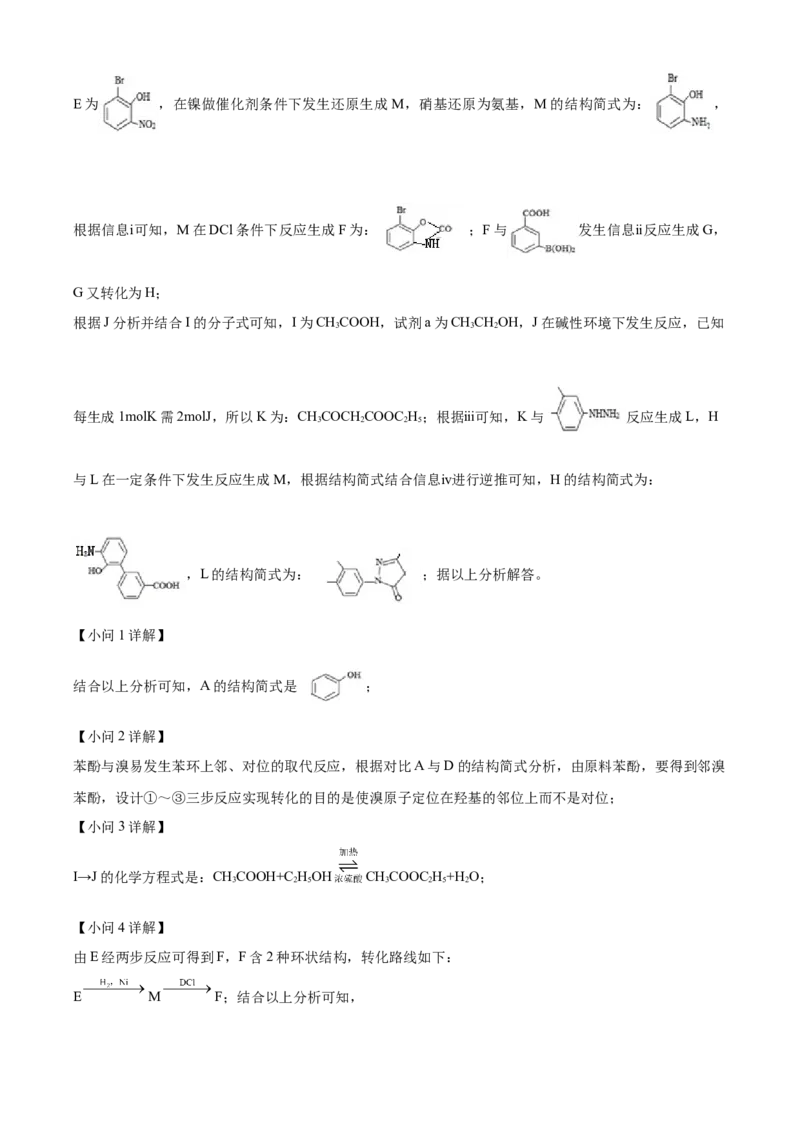
【分析】根据B的结构简式、结合A的分子式可知,A为苯酚,A发生取代反应生成B;根据D的结构简
式分析可知,B与溴发生取代反应生成C,C发生取代反应生成D,所以C为 ;D发生硝
化反应生成E,根据E经两步反应可得到F,F含2种环状结构,满足E M F转化关系,E为 ,在镍做催化剂条件下发生还原生成M,硝基还原为氨基,M的结构简式为: ,
根据信息ⅰ可知,M在DCl条件下反应生成F为: ;F与 发生信息ⅱ反应生成G,
G又转化为H;
根据J分析并结合I的分子式可知,I为CHCOOH,试剂a为CHCHOH,J在碱性环境下发生反应,已知
3 3 2
每生成1molK需2molJ,所以K为:CHCOCH COOC H;根据ⅲ可知,K与 反应生成L,H
3 2 2 5
与L在一定条件下发生反应生成M,根据结构简式结合信息ⅳ进行逆推可知,H的结构简式为:
,L的结构简式为: ;据以上分析解答。
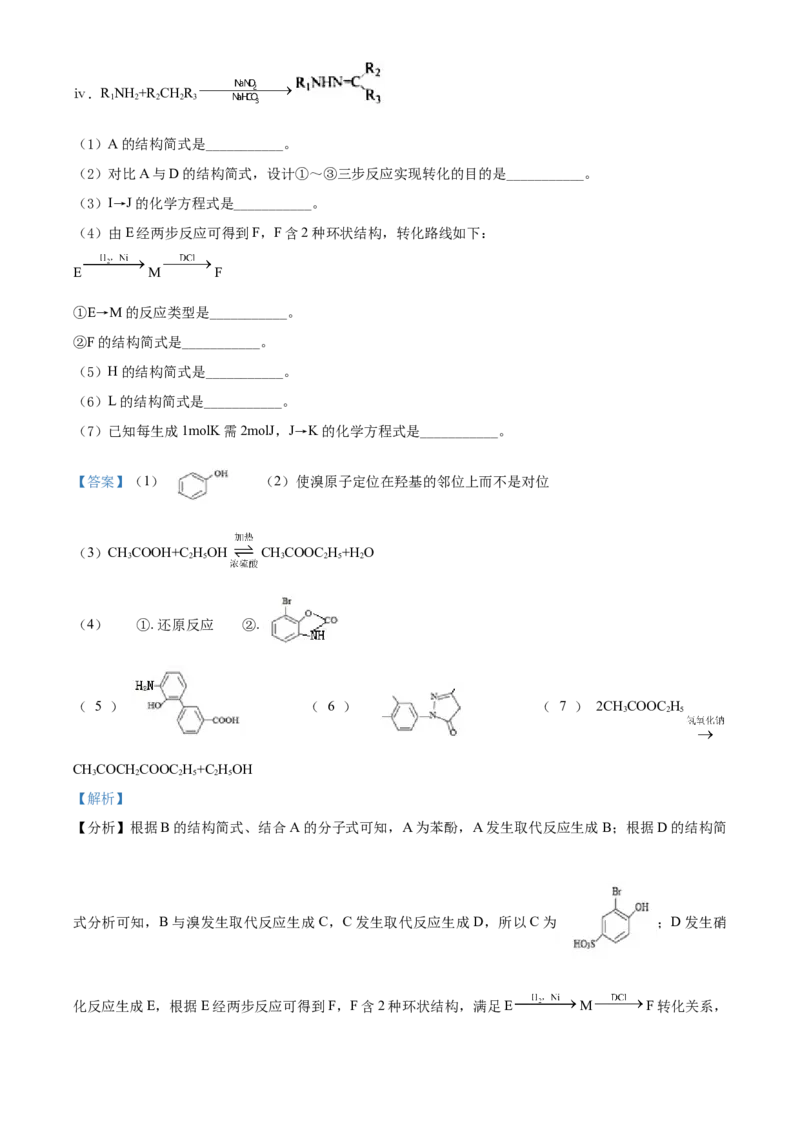
【小问1详解】
结合以上分析可知,A的结构简式是 ;
【小问2详解】
苯酚与溴易发生苯环上邻、对位的取代反应,根据对比A与D的结构简式分析,由原料苯酚,要得到邻溴
苯酚,设计①~③三步反应实现转化的目的是使溴原子定位在羟基的邻位上而不是对位;
【小问3详解】
I→J的化学方程式是:CHCOOH+C HOH CHCOOC H+H O;
3 2 5 3 2 5 2
【小问4详解】
由E经两步反应可得到F,F含2种环状结构,转化路线如下:
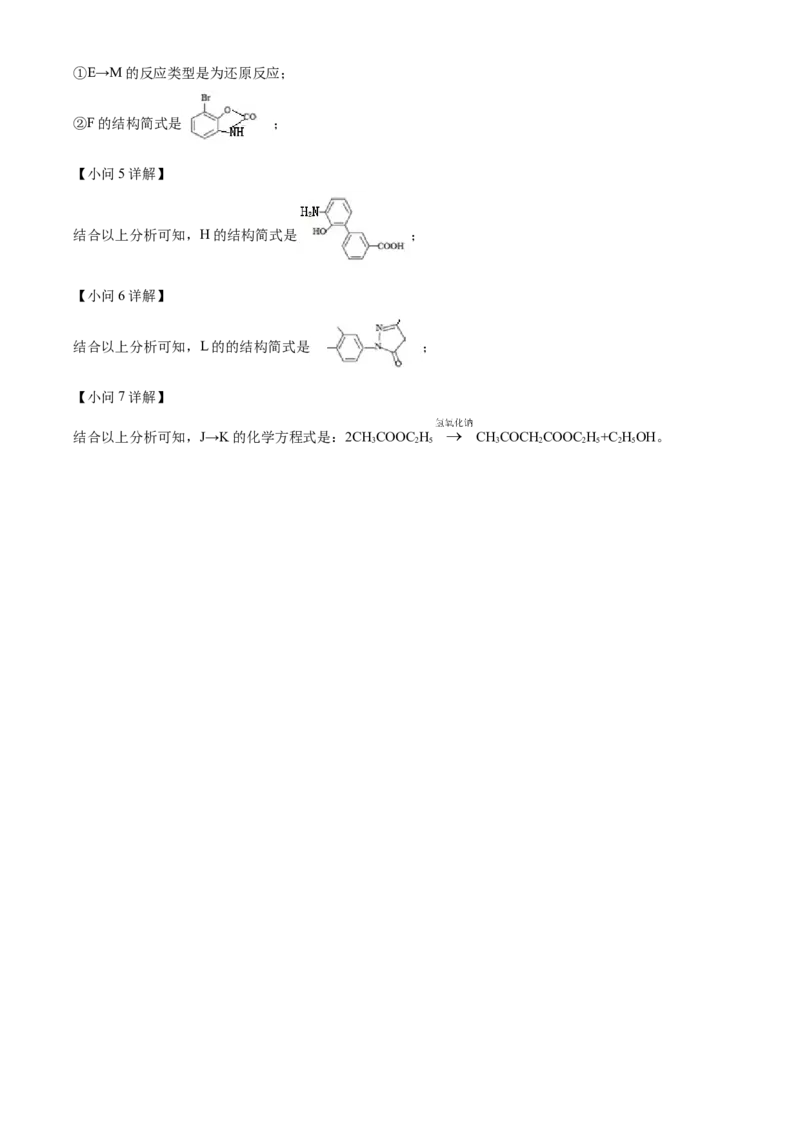
E M F;结合以上分析可知,①E→M的反应类型是为还原反应;
②F的结构简式是 ;
【小问5详解】
结合以上分析可知,H的结构简式是 ;
【小问6详解】
结合以上分析可知,L的的结构简式是 ;
【小问7详解】
结合以上分析可知,J→K的化学方程式是:2CHCOOC H CHCOCH COOC H+C HOH。
3 2 5 3 2 2 5 2 5