文档内容
高三省级联测考试
2024-2025
化学参考答案
在即将到来的高考中,化学学科的命题趋势将呈现出多方面的特点。
首先,热点、重点和冷点知识会达到协调与平衡。 如氧化还原反应、离子反应、元
素周期律等热点重点内容,依然会是考查的核心,但一些平时看似冷门的知识点,如某
些过渡金属化合物的性质等,也可能会出现在试卷中,以检验学生知识的全面性。 如第
题。
8
非遗文化和文物方面,可能会涉及古代化学工艺,像青铜器的冶炼与防锈、陶瓷的
烧制等,让学生了解化学在传统文化传承中的重要作用。 例如,第 、 题。 社会新闻
1 2
热点也可能融入,例如近期的环境污染治理案例,考查其中涉及的化学原理与方法。
高考对主干知识的全面考查不会松懈,包括物质的量、电化学基础、化学反应速率
与平衡、电解质溶液、有机化学基础等。 这些知识会通过各种题型,如选择题、填空
题、简答题等进行全方位检测,且题目会更加注重知识的综合运用和实际情境的结合。
如第 、 、 、 题。
6 13 14 17
实验探究部分,预计会加大力度。 不仅要考查学生对基本实验操作、实验仪器使用
的掌握,还会着重考查实验方案的设计与评价、实验数据的分析与处理等能力。 例如,
可能会给出一个陌生的实验情境,让学生探究某种物质的性质或反应条件。 例如,第
、 、 题。
5 12 15
综合能力检测将贯穿始终,会将化学知识与物理、生物等学科知识相融合,比如在
环保问题中,涉及化学污染物的处理、对生态系统的影响(生物知识)以及相关设备的能
量转化(物理知识)等,考查学生跨学科解决实际问题的能力。
近三年来全国各地出现的优秀高考题题型也值得关注,像工艺流程题、实验探究题
的命题思路和考查方式,都可能为今年的高考命题提供参考和借鉴。 学生们在复习备考
时,应深入研究这些题型,总结解题方法和技巧,以更好地应对高考挑战。 例如,第
、 题。
10 16
题号
1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案
B C A D B C B C A A B C B D
解析:纸张的主要成分是天然纤维素 属于天然有机高分子材料 项正确 燃料燃烧过程中既有化学
1.B , ,A ;
变化 燃烧生成新物质 也有物理变化 项错误 丝绸的主要成分是蛋白质 灼烧时有烧焦羽毛气味 与
( ), ,B ; , ,
化学纤维灼烧时的气味不同 项正确 金箔是金单质 化学性质稳定 能长久保存 项正确
,C ; , , ,D 。
解析:合金的硬度一般比组成它的纯金属大 青铜 铜锡合金 硬度比纯铜大 项正确 铜在空气中与
2.C , ( ) ,A ;
氧气 二氧化碳 水等反应生成铜绿 发生了氧化反应 项正确 合金是由两种或两种以上的金属 或金属
、 、 , ,B ; (
与非金属 熔合而成的具有金属特性的物质 属于混合物 不是纯净物 项错误 在文物修复中 可以利用
) , , ,C ; ,
化学试剂与锈迹发生化学反应从而去除锈迹 同时采取适当的保护措施 避免损伤文物本体 项正确
, , ,D 。
化学·预测卷 答案 第 页(共 页)
Ⅱ 1 6
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}解析:氮离子核外有 个电子 项正确 的电子式为 ·· ·· 项错误 分子中 原
· · ·
3.A 10 ,A ;HFO H·O·F·,B ;SF4 S
·· ··
子的价层电子对数为 分子的空间结构不是正四面体形 项错误 的正确名称为
5, ,C ;
三甲基己烷 项错误
2,2,5 ,D 。
解析:这些二维过渡金属碲化物材料属于无机材料 而不是有机高分子材料 项错误
4.D , ,A ;Ti、Nb、Ta、
属于 区元素 碲 属于 区元素 项错误 这些材料中元素的原子来自不同元素 最外层电子数
Mo d , (Te) p ,B ; ,
不同 例如 最外层电子数为 最外层电子数为 项错误 文中提到这些材料具有良好导电性能
, ,Ti 2,Te 6,C ; ,
在量子通讯等领域有应用潜力 说明可以用于制造量子通讯设备 项正确
, ,D 。
解析: 受热分解生成了 但缺少 检验装置 项不符合题意 还原 粉末 浅
5.B NaHCO3 CO2, CO2 ,A ;H2 WO3 ,
黄色粉末变为黑色 或灰色 粉末 项符合题意 在 溶液中几乎完全水解 应该
( ) ,B ;CH3CH2COOCH3 NaOH ,
用饱和 溶液替代 溶液 项不符合题意 两个烧杯中电解质溶液装反了 铜极插入
Na2CO3 NaOH ,C ; , CuSO4
溶液 极插入 溶液 项不符合题意
,M MSO4 ,D 。
解析:它含碳碳双键 羟基 醚键 羟基的邻位碳原子上有碳氢键 能发生加成 酯化 消去反应 项正
6.C 、 、 , , 、 、 ,A
确 它含碳碳双键 能使溴水 酸性高锰酸钾溶液褪色 项正确 它是分子构成的物质 熔化时只克服分子
; , 、 ,B ; ,
间作用力 氢键和范德华力 不破坏化学键 项错误 其不饱和度为 而苯环不饱和度为 所以其同分
( ), ,C ; 7, 4,
异构体有苯的衍生物 项正确
,D 。
解析: 与 不能大量共存 项不符合题意 在碱性条件下 和 能大量共存 项符
+ 2- - -
7.B H S2O3 ,A ; ,ClO Cl ,B
合题意 难溶于水 项不符合题意 在较强酸性条件下 能存在 在酸性条件下不
3+ 2+
;AgI ,C ; Fe ,[Cu(NH3)4]
稳定 项不符合题意
,D 。
解析:甲转化为乙时断裂铌氧双键中的 键和氢氧 键 形成了氧氧 键 项正确 上述循环中
8.C π σ , σ ,A ; ,Nb
原子都有 个电子参与成键 项正确 碳碳双键被 氧化生成环氧键 另一种产物为 循环图中
6 ,B ; H2O2 , H2O,
没有标出来 原子利用率小于 项错误 为乙酸基 连接的碳原子都是手性碳原子 甲 乙 丙
, 100%,C ;R ,R , 、 、 、
丁离子都含 个手性碳原子 项正确
1 ,D 。
解析:基态 原子价层电子排布式为 为氧 原子半径在同周期中最大 为锂 没有最
2 4
9.A Z 2s2p,Z ;X ,X ;W
高价氧化物对应的水化物 说明 没有正化合价 为氟 为硅 原子序数大于 原子最外层有
, W ,W ;R ;M 14,M
个电子 为钙 根据香花石组成可知 元素化合价代数和等于 设 的化合价为x 有
2 ,M 。 , 0, Y , :(+2)×3+
x 解得x 故 为铍 稳定性
(+1)×2+[+4+(-2)×4]×3+(-1)×2=0, =+2, Y 。 :HF>H2O>(CH4)
项正确 分子中 上有 个孤电子对 形结构 它是极性分子 项错误 第一电离能
>SiH4,A ;OF2 O 2 ,V , ,B ; :
项错误 的电负性大于 中两种元素的电负性差值大于 故离子键百分数
Be>Li,C ;F O,CaF2 CaO, :CaF2>
项错误
CaO,D 。
解析:观察图示 极为阴极 只析出银 阴极的电极反应式为 + - n
10.A ,b , , Ag +e Ag, (Ag)=
2 .16g
-1=0.02 mol,
n
(e
-
)=0.02 mol,A
项正确
;
图中银
、
铜溶于浸出液
,
发生了氧化还原反应
,
108g·mol
在电渗析中 在 极得到电子发生了氧化还原反应 故不只发生 个氧化还原反应 项错误 过二
+
,Ag b , 1 ,B ;
硫酸钾 氧化银和铜 反应中作氧化剂 项错误 离子的氧化性强弱与其浓度有关 当c
+
(K2S2O8) , ,C ; , (Ag )
较小c
2+
较大时
2+
会在阴极得电子生成 项错误
,(Cu ) ,Cu Cu,D 。
解析:同位素是质子数相同而中子数不同的原子 即同位素原子的质子数相同 电子数也相同 项
11.B , , ,A
错误 质量数为 质子数为 中子数 质量数 质子数 项正确 钍主要用于核能
; 225, 89, = - =225-89=136,B ;
化学·预测卷 答案 第 页(共 页)
Ⅱ 2 6
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}等领域 而不是制造烟花 项错误 核衰变产生了新元素 属于核物理变化 而化学变化中原子种类不
, ,C ; , ,
变 项错误
,D 。
解析: 射线衍射是测定分子结构的科学方法 我国科学家利用 射线衍射测定青蒿素分子结构
12.C X , X ,A
项不符合题意 测定一定量乙醇与足量钠反应产生的氢气体积 经计算可确定乙醇分子结构 项不符合
; , ,B
题意 卤代烃中卤素检验 还需要用硝酸中和过量的碱 项符合题意 在淀粉 溶液中加入溴水
-
; , ,C ; KI ,2I
观察溶液的颜色变化可确认溴的非金属性比碘强 项不符合题意
-
+Br2I2+2Br , ,D 。
解析:观察图示 溴化锂除增强导电性外 还作催化剂 项错误 极区发生的相关反应有 阳极
13.B , , ,A ;FTO :
反应 式 为 溴 单 质 氧 化 烯 烃 生 成 环 氧 烷 烃 反 应 式 为
- -
2Br - 2e Br2, ,
加 合 得 阳 极 区 总 反 应 式
, :
项正确 溴离子循环氧化 还原生成溴离子 总体上保持
,B ; , ,
稳定 基本不变 项错误 铂极的电极反应式为 可见溶液的 不会减
- + -
c(Br ) , ,C ; 2H +2e H2↑, pH
小 项错误
,D 。
解析:根据溶度积表达式可知 c - K c + c 2-
14.D ,-lg (BrO3)=-lg sp(AgBrO3)+lg (Ag ),-lg (CrO4 )=
K c + 由此可知 直线 代表 c 2- 与 c + 关系 由 点坐标
-lg sp(Ag2CrO4)+2lg(Ag ), , ① -lg(CrO4 ) -lg(Ag ) , c
可知 K -4.27 K -11.95 故根据图示可知 先生成 后生成
, sp(AgBrO3)=10 , sp(Ag2CrO4)=10 , , Ag2CrO4,
项错误 点溶液是 的不饱和溶液 是 的过饱和溶液 该溶液易析出
AgBrO3,A ;a AgBrO3 , Ag2CrO4 ,
沉淀 项错误 根据溶度积计算 点对应溶液中c
- -2.27 -1
数量级为
-3
项
Ag2CrO4 ,B ; b :(BrO3)=10 mol·L , 10 ,C
错误 c2 (BrO3 - ) K2 sp(AgBrO3) (10 -4.27 ) 2
3.41
项正确
;c (CrO 2 4 - ) =K sp(Ag2CrO4) = 10 -11.95 =10 ,D 。
答案: 分
15. (14 )
作无水溶剂 分 分
(1) (1 ) B(2 )
玻璃棒 分
(2) (1 )
分
2(CH3CH2)2NH2Cl+CuCl2·2H2O[(CH3CH2)2NH2]2CuCl4+2H2O(2 )
过滤快 固体较干燥等 避免产品吸水 分
(3) 、 , (2 )
防止样品吸收水蒸气 分
(4) (2 )
分
3
(5)sp(2 )
变色 恤 变色鞋子 或食品包装上的温度指示标签 或制成温度指示涂料 贴纸或传感器 或应用于
(6) T 、 ; ; 、 ;
智能窗户 汽车玻璃等 答案合理即可 分
、 ( ,2 )
解析:()依题意,本实验制备需要无水溶剂,乙醇、异丙醇作溶剂。锥形瓶中液体加热时一般不超过容积
1
1,选择 项合理。()使用玻璃棒搅拌,能加快固体溶解、液体混合均匀。氯化铜晶体在乙醇、异丙醇
B 2
3
中不能电离,以结晶水合物形式参与反应。()减压过滤,过滤速度快,避免产品吸水。()密封毛细管
3 4
口,避免样品吸收水蒸气。()正四面体形结构中铜离子采用 杂化。()围绕热致变色材料特点,设
3
5 sp 6
计遇热发生颜色变化方面应用。
答案: 分
16. (14 )
升温 提高水浸速率 分 制造光导纤维 冶炼粗硅 制造陶瓷材料等 分
(1) , (1 ) 、 、 (2 )
氧化剂 催化剂 分
(2) 、 (2 )
分 烧结 分
2- - 2- -
(3)[BeF4] +4OH [Be(OH)4] +4F (2 ) (1 )
化学·预测卷 答案 第 页(共 页)
Ⅱ 3 6
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}坩埚 泥三角 分
(4) 、 (2 )
分
(5)②(2 )
32
3×10 分
(6)a2bN (2 )
3 A
解析:()升温有利于提高水浸速率。依题意,滤渣成分是二氧化硅,利用二氧化硅可以制造光导纤维、陶
1
瓷、粗硅等。()实验室用二氧化锰与浓盐酸共热制氯气,在双氧水中加入二氧化锰粉末制氧气。()四
2 3
氟铍酸钠与足量氢氧化钠反应生成四羟基合铍酸钠和氟化钠。铁冰晶石中氟元素可以利用,将铁冰晶石
用于“烧结”工序。()灼烧操作中,坩埚、泥三角主要材料是陶瓷,而酒精灯、玻璃棒主要成分是玻璃(硅
4
酸盐)。()焦炭还原法,温度很高,消耗能源较大;产生大气污染物 。()图示六棱柱的体积为
5 CO 6
a2b 33×10 -30 3 ,图示六棱柱含 个 ,则 晶体的密度为 150 · -3
2
cm 6 BeO BeO a2b
33 -30N
g cm =
×10 A
2
3×10 32 · -3 。
a2bN g cm
3 A
答案: 分
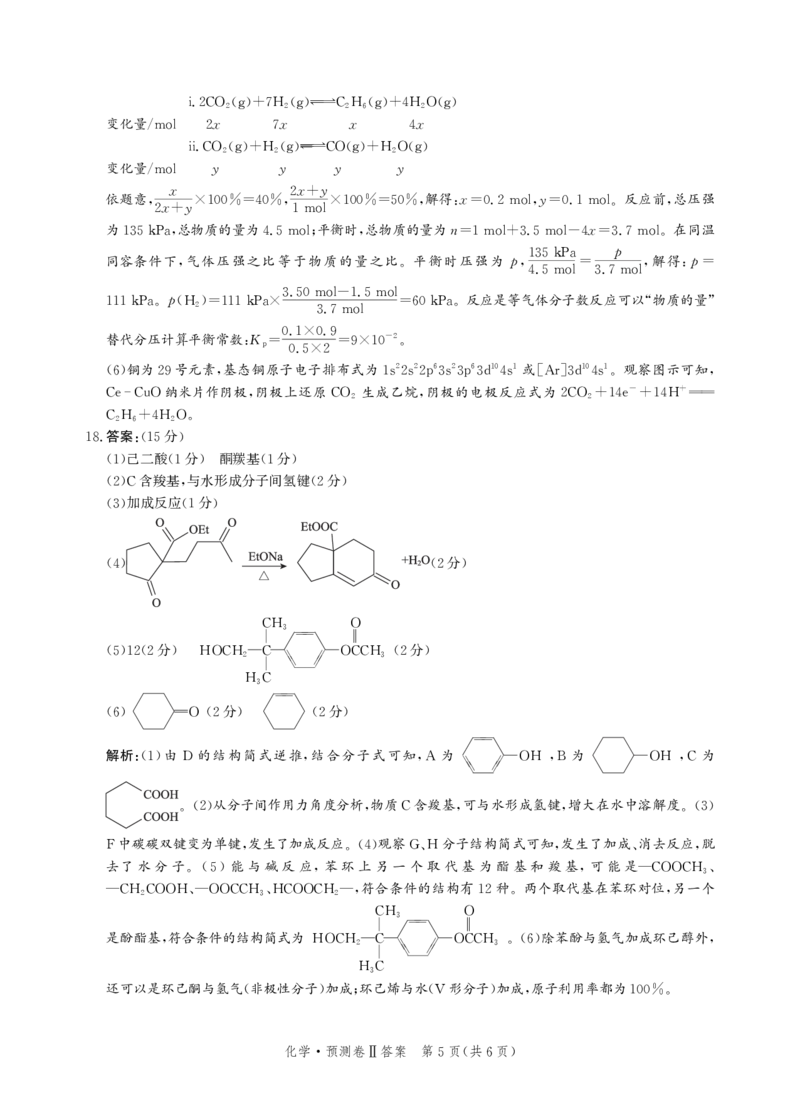
17. (15 )
分
(1)CO2(1 )
分
(2)-264.8(2 )
分 温度超过 活性降低 分
(3)Cat1(1 ) 400℃,Cat1 (2 )
反应 是放热反应 反应 是吸热反应 当温度大于 反应 和 达到平衡 升高温度 反应 逆
(4) i , ii , 480℃, i ii , , i
向移动 反应 正向移动 且反应 正向移动程度大于反应 逆向移动的程度 分
, ii , ii i (2 )
分 或 分
-2
(5)60(2 ) 0.09( 9×10 )(2 )
或 分
2 2 6 2 6 10 1 10 1
(6)①1s2s2p3s3p3d4s [Ar]3d4s(1 )
分
- +
②2CO2+14e +14H C2H6+4H2O(2 )
解析:()题述涉及的分子中,只含极性键的非极性分子为 。
1 CO2
()有关热化学方程式如下:
2
() 1 () () H · -1
①H2g+ O2gH2Ol Δ =-285.8kJ mol
2
() 7 () () () H · -1
②C2H6g+ O2g2CO2g+3H2Ol Δ =-1559.8kJ mol
2
() () H · -1
③H2OlH2Og Δ =+44kJ mol
根据盖斯定律, 得目标反应,H ·
-1
( ·
-1
)
①×7-②+③×4 Δ 1=-285.8kJ mol ×7- -1559.8kJ mol
· · 。
-1 -1
+44kJ mol ×4=-264.8kJ mol
()单位时间内二氧化碳转化率相当于反应速率,温度相同时转化率最高,则催化效能最高。温度高于
3
, 活性降低,导致二氧化碳转化率快速降低。
400℃ Cat1
()转化率、选择性变化趋势,可以从平衡移动角度解释。反应 是放热反应,反应 是吸热反应,当温度
4 i ii
大于 ,反应 和 达到平衡,升高温度,反应 逆向移动,反应 正向移动,且反应 正向移动程度
480℃ i ii i ii ii
大于反应 ,故二氧化碳转化率仍然增大,而乙烷的选择性降低。
i
()设反应 平衡时,生成乙烷x ,反应 平衡时,生成 y 。
5 i mol ii CO mol
化学·预测卷 答案 第 页(共 页)
Ⅱ 4 6
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}() () () ()
i.2CO2g+7H2gC2H6g+4H2Og
变化量/ x x x x
mol 2 7 4
() () () ()
ii.CO2g+H2gCOg+H2Og
变化量/
y y y y
mol
x x y
依题意,
x y×100%=40%
,2 +
×100%=50%
,解得:x
=0.2 mol
,y
=0.1 mol
。反应前,总压强
2 + 1mol
为 ,总物质的量为 ;平衡时,总物质的量为n x 。在同温
135kPa 4.5mol =1mol+3.5mol-4 =3.7mol
p
同容条件下,气体压强之比等于物质的量之比。平衡时压强为 p,135 kPa ,解得:p
= =
4.5mol 3.7mol
。p( ) 3.50mol -1.5mol 。反应是等气体分子数反应可以“物质的量”
111kPa H2 =111kPa× =60kPa
3.7mol
替代分压计算平衡常数:K 0.1×0.9 -2 。
p= =9×10
0.5×2
()铜为 号元素,基态铜原子电子排布式为 或[ ] 。观察图示可知,
2 2 6 2 6 10 1 10 1
6 29 1s2s2p3s3p3d4s Ar3d4s
纳米片作阴极,阴极上还原 生成乙烷,阴极的电极反应式为
- +
Ce CuO CO2 2CO2+14e +14H
。
C2H6+4H2O
答案: 分
18. (15 )
己二酸 分 酮羰基 分
(1) (1 ) (1 )
含羧基 与水形成分子间氢键 分
(2)C , (2 )
加成反应 分
(3) (1 )
分
(4) (2 )
CH3 O
分
(5)12(2 ) HOCH2 C OCCH3
H3C
化学·预测卷 答案 第 页(共 页)
Ⅱ 5 6
分
(2 )
分 分
(6) O (2 ) (2 )
解析:()由 的结构简式逆推,结合分子式可知, 为 , 为 , 为
1 D A OH B OH C
。()从分子间作用力角度分析,物质 含羧基,可与水形成氢键,增大在水中溶解度。()
2 C 3
中碳碳双键变为单键,发生了加成反应。()观察 、 分子结构简式可知,发生了加成、消去反应,脱
F 4 G H
去了水分子。( )能与碱反应,苯环上另一个取代基为酯基和羧基,可能是— 、
5 COOCH3
— 、— 、 —,符合条件的结构有 种。两个取代基在苯环对位,另一个
CH2COOH OOCCH3 HCOOCH2 12
CH3 O
是酚酯基,符合条件的结构简式为
HOCH2 C OCCH3
H3C
。()除苯酚与氢气加成环己醇外,
6
还可以是环己酮与氢气(非极性分子)加成;环己烯与水( 形分子)加成,原子利用率都为 。
V 100%
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}编写细目表
能力要求
1. :
接受 吸收 整合化学信息的能力 分析和解决化学问题的能力 化学实验与探究能力
Ⅰ. 、 、 Ⅱ. Ⅲ.
核心素养
2. :
宏观辨识与微观探析 变化观念与平衡思想 证据推理与模型认知 科学探究与创新意识 科学态度
① ;② ;③ ;④ ;⑤
与社会责任
知识点 能力要求 核心素养 预估
题号 题型 分值
主题内容 难度
( )
Ⅰ Ⅱ Ⅲ ① ② ③ ④ ⑤
选择题 世界首个非遗春节 物质组成和变化 易
1 3 — √ √ √
选择题 文物与物质性质 易
2 3 √ √ √
选择题 化学用语 易
3 3 √ √ √
选择题 物质结构与性质 易
4 3 √ √ √
选择题 实验操作与装置 易
5 3 √ √ √
选择题 有机物结构与性质 易
6 3 √ √ √
选择题 离子大量共存判断 易
7 3 √ √ √
选择题 反应历程与化学键 中
8 3 √ √ √
选择题 元素推断与结构 中
9 3 √ √ √ √
选择题 微型化工 中
10 3 √ √
选择题 物质结构与性质 中
11 3 √ √
选择题 实验设计与评价 中
12 3 √ √ √
选择题 电化学原理应用 中
13 3
选择题 电解质溶液与图像 较难
14 3 √ √ √
非选择题 配合物制备实验 中
15 14 √ √ √ √
非选择题 无机化工 铍元素转化与氧化还原 中
16 14 ( ) √ √ √ √
非选择题 反应原理 热化学与反应速率和平衡 较难
17 15 ( ) √ √ √ √
非选择题 有机推断与合成路线设计 中
18 15 √ √ √ √
化学·预测卷 答案 第 页(共 页)
Ⅱ 6 6
{#{QQABRQCQogioABIAARgCAw1iCgCQkBEACSoOhFAUIAABgQNABAA=}#}