文档内容
通辽一中 2023 级高二上学期开学检测
化学试卷(特优班)
注意事项:
1、答卷前,考生务必将自己的姓名、考生号涂写在答题卡上。本试卷满分 100分,考试时间
75分钟。
2、做选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3、回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Zn:65
.第Ⅰ卷(选择题 共45分)
1.下列事实中,不能用勒夏特列原理解释的是( )
A.在FeSO 溶液中加入少量铁粉以防止Fe2+被氧化
4
B.开启啤酒瓶后,瓶中立刻泛起大量泡沫
C.实验室中常用排饱和食盐水的方法收集Cl
2
D.工业生产硫酸的过程中使用过量的空气以提高SO 的利用率
2
2.下列由实验得出的结论正确的是 ( )
选项 实 验 结 论
甲烷与氯气在光照下反应后的混合气体能使
A 生成的氯代甲烷具有酸性
湿润的石蕊试纸变红
乙醇分子中的氢与水分子中的氢
B 乙醇和水都可与金属钠反应产生可燃性气体
具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性
将乙烯通入溴的四氯化碳溶液,溶液最终变 生成的1,2-二溴乙烷是无色、
D
为无色透明 易溶于四氯化碳的液体
A.A B.B C.C D.D
3.将NO 装入带活塞的密闭容器中,当反应2NO (g) N O (g)达到平衡后,改变下列
2 2 2 4
一个条件,其中叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
化学试题 第 1页(共 10页)
学科网(北京)股份有限公司B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入稀有气体,压强增大,平衡向右移动,混合气体的颜色变浅
4.将浓度为0.05mol/L的HClO的溶液加水不断稀释,下列各量始终保持增大的是(
)
A. B. C. D.
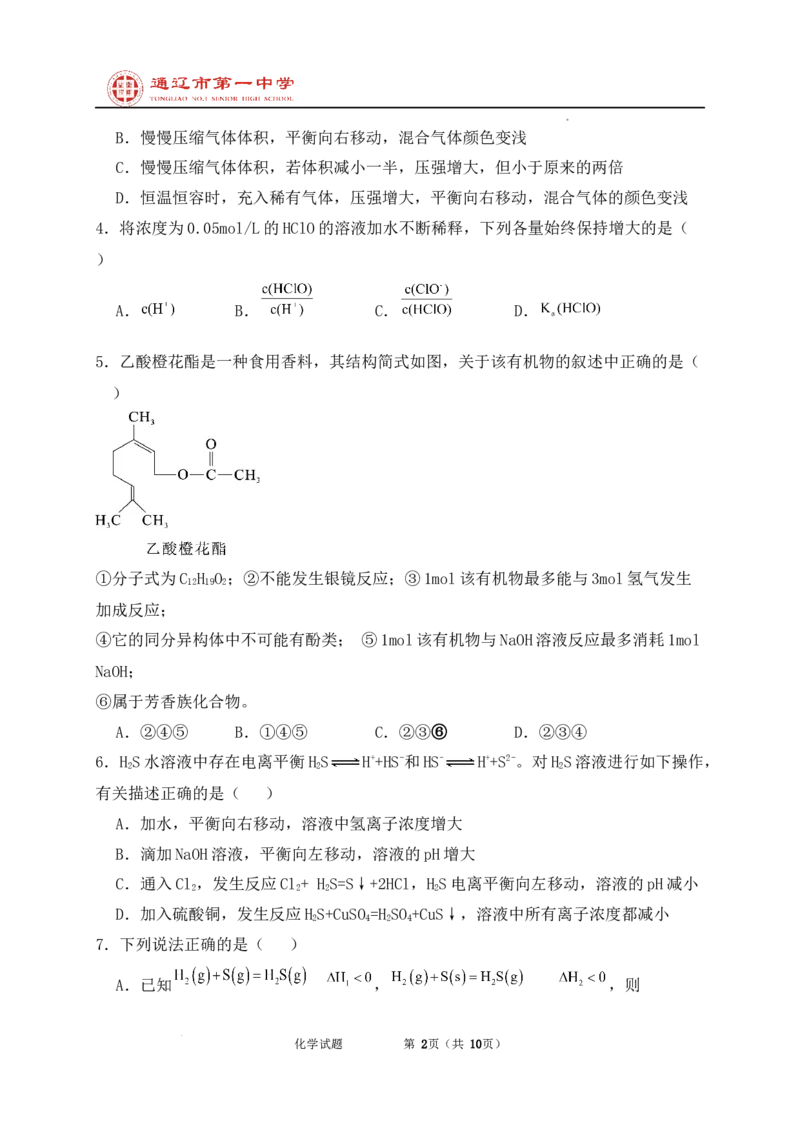
5.乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是(
)
①分子式为C H O ;②不能发生银镜反应;③1mol该有机物最多能与3mol氢气发生
12 19 2
加成反应;
④它的同分异构体中不可能有酚类; ⑤1mol该有机物与NaOH溶液反应最多消耗1mol
NaOH;
⑥属于芳香族化合物。
A.②④⑤ B.①④⑤ C.②③⑥ D.②③④
6.H S水溶液中存在电离平衡H S H++HS-和HS- H++S2-。对H S溶液进行如下操作,
2 2 2
有关描述正确的是( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.滴加NaOH溶液,平衡向左移动,溶液的pH增大
C.通入Cl ,发生反应Cl + H S=S↓+2HCl,H S电离平衡向左移动,溶液的pH减小
2 2 2 2
D.加入硫酸铜,发生反应H S+CuSO =H SO +CuS↓,溶液中所有离子浓度都减小
2 4 2 4
7.下列说法正确的是( )
A.已知 , ,则
化学试题 第 2页(共 10页)
学科网(北京)股份有限公司B.中和热的测定实验中,氢氧化钠分批加入,反应更充分,测定的中和热数值误差
更小
C.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
D.一定条件下,将1mol 、0.5mol 置于密闭容器中充分反应后,放出热量
98.3kJ,热化学方程式可表示为:2SO (g)+O (g) 2SO
2 2 3
(g)
8.在密闭容器中发生储氢反应:LaNi (s)+3H (g)
5 2
LaNi H (s) △H=-301kJ•mol-1。在某温度下,达到平衡状态,测得氢气压强为2MPa。
5 6
下列说法正确的是( )
A.当LaNi H 的浓度不再变化时,该反应达到平衡状态
5 6
B.若温度不变,压缩体积至原来的一半,重新达到平衡时H 的压强仍为2MPa
2
C.缩小容器的容积,重新达到平衡时H 的浓度增大
2
D.升高温度有利于储氢
9.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列判断正确的
是( )
A.冰醋酸不导电,所以冰醋酸不是电解质
B.A、B、 三点对应的溶液中, 由小到大的顺序是
C.A、B、C三点对应的溶液中, 电离程度最大的B
D.若使B点对应的溶液中 增大、 增大,可行的方法是加热
10.某小组为了探究影响 溶液与 溶液在酸性[所用试剂浓度:
]条件下反应速率的因
素,设计的实验方案如表所示。混合溶液的体积变化忽略不计,下列说法错误的是(
化学试题 第 3页(共 10页)
学科网(北京)股份有限公司)
实验 实验 褪色时
编号 温度/K 间/min
1 298 4.0 2 2 8
2 298 5.0 2 2 1 6
3 303 5.0 2 1 2
A.
B.该反应的离子方程式为
C.实验1中 的反应速率为
D.实验2和3探究的是温度对反应速率的影响
11.在一密闭容器中发生反应2A(s)+2B(g) 2C(g)+D(g),3min达到平衡状态,
增加了0.6mol∙L-1,下列说法正确的是( )
A.0~3min,
B.在2min末,
C.第4min时, 和 表示的反应速率的值相等
D.若相同时间内, ,则这两段时间内反应速率相等
12.常温下0.1mol/L醋酸溶液中存在电离平衡:CH COOH H++CH COO-,下列叙述不
3 3
正确的是( )
A.溶液加水稀释或加热均可使CH COO-的物质的量增多
3
B.溶液中加入少量纯醋酸,平衡向右移动,电离程度减小
化学试题 第 4页(共 10页)
学科网(北京)股份有限公司C.溶液加水稀释,[c(CH COO-)・c(H+)]/c(CH COOH)不变
3 3
D.溶液加水稀释后,溶液中c(H+)/c(CH COO-)的比值将减小
3
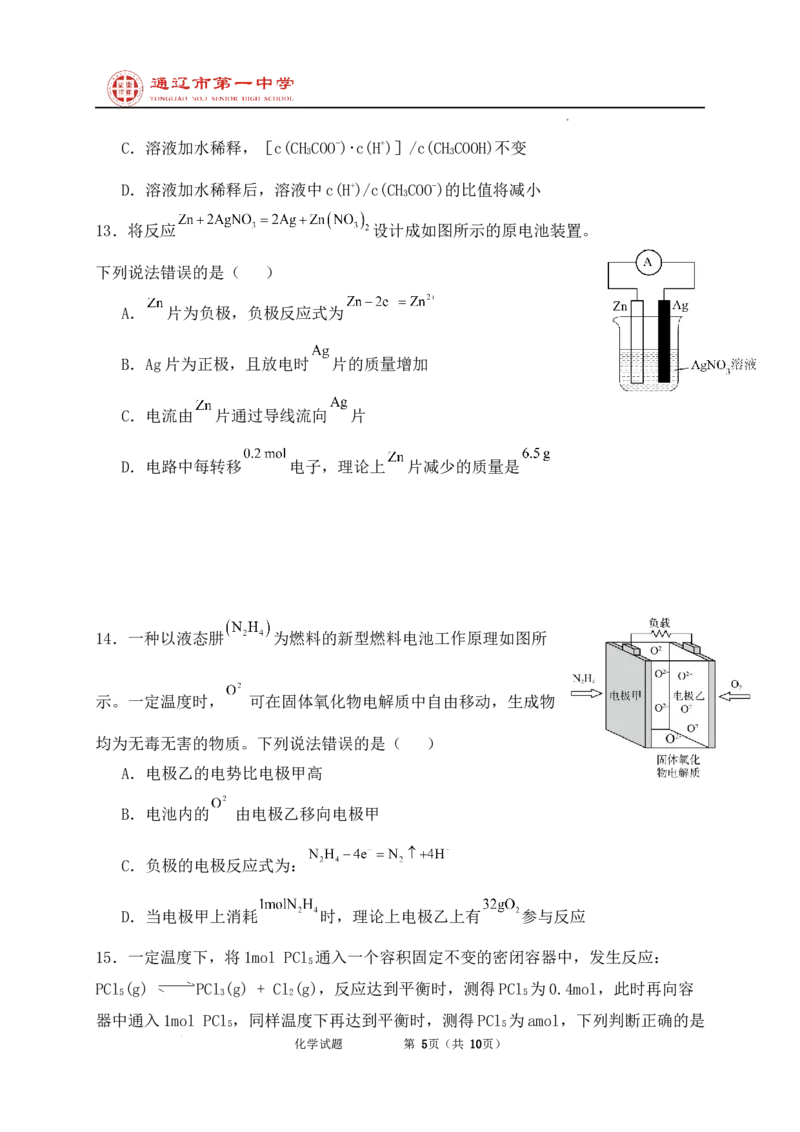
13.将反应 设计成如图所示的原电池装置。
下列说法错误的是( )
A. 片为负极,负极反应式为
B.Ag片为正极,且放电时 片的质量增加
C.电流由 片通过导线流向 片
D.电路中每转移 电子,理论上 片减少的质量是
14.一种以液态肼 为燃料的新型燃料电池工作原理如图所
示。一定温度时, 可在固体氧化物电解质中自由移动,生成物
均为无毒无害的物质。下列说法错误的是( )
A.电极乙的电势比电极甲高
B.电池内的 由电极乙移向电极甲
C.负极的电极反应式为:
D.当电极甲上消耗 时,理论上电极乙上有 参与反应
15.一定温度下,将1mol PCl 通入一个容积固定不变的密闭容器中,发生反应:
5
PCl (g) PCl (g) + Cl (g),反应达到平衡时,测得PCl 为0.4mol,此时再向容
5 3 2 5
器中通入1mol PCl ,同样温度下再达到平衡时,测得PCl 为amol,下列判断正确的是
5 5
化学试题 第 5页(共 10页)
学科网(北京)股份有限公司A.Cl 的体积分数增大 B.PCl 的分解率增大
2 5
C.a = 0.8 D.a > 0.8
第Ⅱ卷(填空题,共55分)
16.25℃时,部分物质的电离平衡常数如表所示:
化学式 CH COOH H CO HClO HCN
3 2 3
K =4.3×10-7
a1
电离平衡常数(K ) 1.8×10-5 3.0×10-8 5.0×10-10
a
K =5.6×10-11
a2
请回答下列问题:
(1)CH COOH、H CO 、HClO、HCN的酸性由强到弱的顺序 。
3 2 3
(2)向NaCN中通入少量的CO ,发生反应的离子方程式为 。
2
(3)体积相同、pH相同的① ;②HCl;③ 三种酸溶液分别与同浓度的
NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是 (填序号);
若是体积相同,物质的量浓度相同的以上三种酸分别和足量的Zn反应,生成氢气的量
由大到小的排列顺序是 (填序号)。
(4)H+浓度相同等体积的两份溶液A(盐酸)和B(CH COOH)分别与不同质量的锌粉反应,
3
若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
(填写序号)。
a.反应所需要的时间:B>A b.开始反应时的速率:A>B
c.参加反应的锌物质的量:A=B d.A中有锌剩余
(5)25°C 时常压下,已知在 C(H+)=1X10-5 mol/L的稀醋酸溶液中C(OH-)=1X10-9
mol/L,则c(CH COO- )= mol· L -1。下列方法中,可以使 0.10mol·L
3
-1CH COOH 的电离程度增大的是 (填字母)。
3
a.加少入量0.10mol·L -1的稀盐酸 b.加热该CH COOH溶液
3
c.加入少量冰醋酸 d.加水稀释至0.010mol·L -1
e.加入少量氯化钠晶体 f.加入少量0.10mol·L -1的NaOH溶液
17.人类也可主动地参与氮循环,人工固氮就是参与的手段之一、回答下列问题:
(1)常见的固氮反应在温度为 时的有关热力学数据如下:
反应 平衡常数
化学试题 第 6页(共 10页)
学科网(北京)股份有限公司K
I.
Ⅱ.
Ⅲ.
结合表中数据分析,最适宜的人工固氮反应是 (填“I”“Ⅱ”或“Ⅲ”),理
由是 。
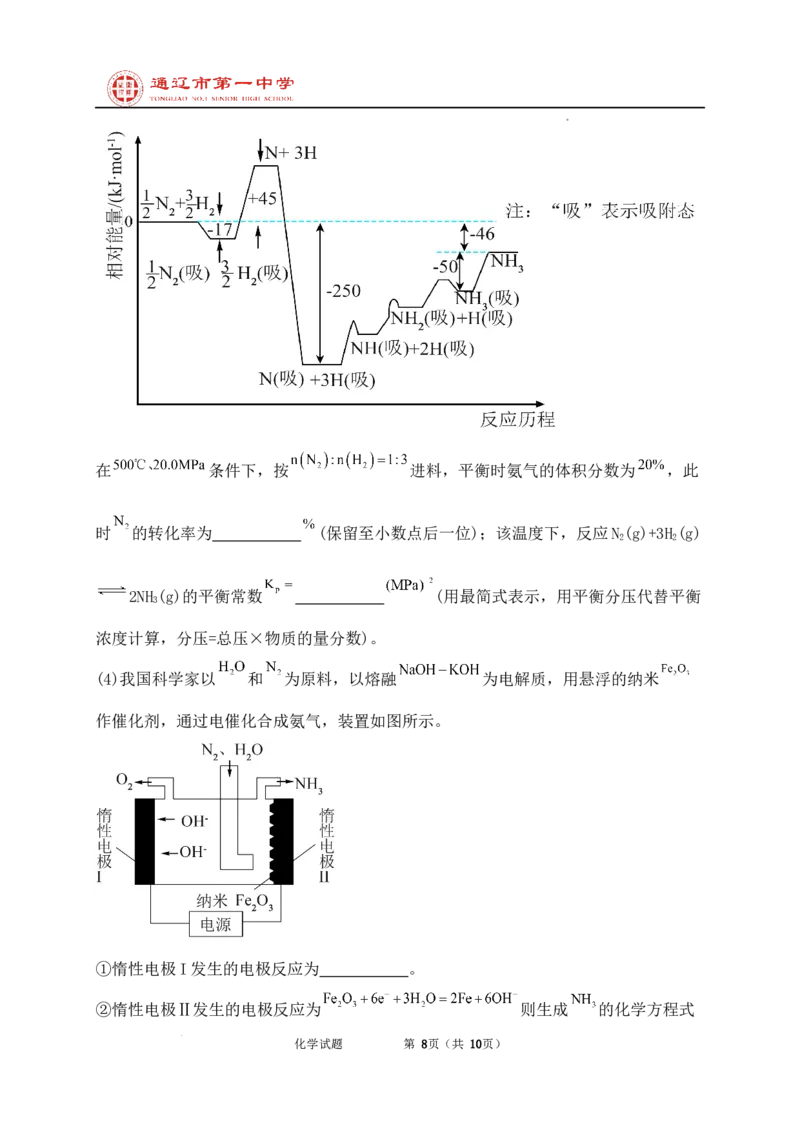
(2)研究表明,合成氨反应在 催化剂表面上通过如图反应历程进行。速率控制步骤
(速率最慢步骤、决速步骤)的反应方程式为 ,理由是 。
(3)
化学试题 第 7页(共 10页)
学科网(北京)股份有限公司在 条件下,按 进料,平衡时氨气的体积分数为 ,此
时 的转化率为 (保留至小数点后一位);该温度下,反应N (g)+3H (g)
2 2
2NH (g)的平衡常数 (用最简式表示,用平衡分压代替平衡
3
浓度计算,分压=总压×物质的量分数)。
(4)我国科学家以 和 为原料,以熔融 为电解质,用悬浮的纳米
作催化剂,通过电催化合成氨气,装置如图所示。
①惰性电极I发生的电极反应为 。
②惰性电极Ⅱ发生的电极反应为 则生成 的化学方程式
化学试题 第 8页(共 10页)
学科网(北京)股份有限公司为 。
18.邻苯二甲酸二乙酯(F)在医药、香料、塑料、橡胶以及涂料等领域应用广泛,其合
成路线如图所示,D是最简单的烯烃,请回答下列问题:
(1)D的分子式为 ,B的结构简式为 。A→B的反应类型为 。
(2)C+E→F的化学方程式为 ,D→E的反应类型为 。
(3)1 mol A与足量Na反应生成 的体积(标准状况下)为 L。
(4)D能发生聚合反应生成高分子X,X的链节为 。
(5)与E具有相同官能团的H比E多一个O,下列物质(不考虑稳定性)中,与H互为同
分异构体的是 (填标号,下同),互为同系物的是 。
① ② ③ ④ ⑤
化学试题 第 9页(共 10页)
学科网(北京)股份有限公司通辽一中 2023 级高二上学期开学检测
化学试题(特优班)参考答案
1.A 2.D 3.C 4.C 5.A
6.C 7.A 8.B 9.D 10.C
11.C 12.D 13.C 14.C 15.D
16.(1)CH COOH>H CO>HClO>HCN
3 2 3
(2)CN-+CO +H O=HCN+ HCO
2 2
(3) ①>②=③ ③>②=①
(4)cd
(5) 10-5-10-9 bdf
17.(1) Ⅲ 反应I在任何温度下都不能自发,反应Ⅱ需在较高温度下才能自发且K值很小,
反应Ⅲ在常温下能自发且K值大
(2) 活化能越大,反应速率越慢
(3) 33.3
(4)
18.(1) 氧化反应
(2) 加成反应
(3)22.4 (4) (5) ④ ②③
化学试题 第 10页(共 10页)
学科网(北京)股份有限公司