文档内容
D.使用Ⅰ时,反应过程中M所能达到的最高浓度更大
长春外国语学校2024-2025学年第一学期第一次月考
高二年级化学试卷(理科)
4.在某恒压密闭容器中充入1molCO和2molH ,发生反应:CO(g)+2H(g) CHOH(g),下列说
2 2 3
出题人 :罗睿 审题人:周艳杰 法中能够判断该反应一定处于平衡状态的是( )
⇌
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共 4页。考试结束后,将答 A.单位时间内生成1molCH OH的同时消耗2molH B.容器中混合气体的密度不随时间变化
3 2
题卡交回。 C.容器中CO与CHOH物质的量之比为1:1 D.容器中CO与H 的体积之比恒定不变
3 2
注意事项: 5.研究发现,液态苯是优质储氢材料:C H(l)+3H(g) C H (l)。一定温度下,在密闭容器中
6 6 2 6 12
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码准确粘贴在考生信息条 充入一定量液态苯(足量)和适量氢气,经反应达到平衡后,测得c(H )=2 mol·L-1。保持温度不变,
2
⇌
形码粘贴区。 将体积压缩至原来的一半,达到新平衡时c(H )为( )
2
2.选择题必须使用2B铅笔填涂;非选择题必须使用0.5毫米黑色字迹的签字笔书写,字 A.1 mol·L-1 B.2 mol·L-1 C.3 mol·L-1 D.4 mol·L-1
体工整、笔迹清楚。 6. 对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作
3.请按照题号顺序在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿 K )。已知反应CH(g)+2HO(g) CO(g)+4H(g),在t ℃时的平衡常数K =a,则下列说法正确
p 4 2 2 2 p
纸、试题卷上答题无效。 的是( )
⇌
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 A.K =
p
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 B.升高温度,若K 增大,则该反应为放热反应
p
可能用到的相对原子质量:H—1 C—12 O—16 C.该反应达到平衡状态后,增大压强,平衡向左移动,K 不变
p
D.t ℃时,反应CH(g)+HO(g) CO(g)+2H(g)的平衡常数K =a
4 2 2 2 p
7. 已知2NO+2H=2HO+N 的速率方程为v =k cα(NO)cβ(H ),在800℃下测定了不同初始浓
第Ⅰ卷 2 2 2 ⇌ 正 正 2
度及正反应速率的关系,数据如表,则下列说法中正确的是( )
一、选择题:本题共15小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
实验 c(NO)/(mol·L-l) c(H )/(mol·L-l) v
0 0 2 正
题目要求的。
1.下列有关化学反应速率的认识错误的是( ) 1 1 1 v
①可以测定某一反应的瞬时速率
2 2 1 4v
②只能用单位时间内物质的量浓度变化值表示
③任何化学反应都可以通过反应现象判断化学反应的快慢 3 1 2 2v
④溶液中发生的反应,速率的快慢主要由温度、浓度决定
4 2 x 16v
A.只有① B.只有①② C.只有③④ D.均错误
2.反应3Fe(s)+4HO(g)=====Fe O(s)+4H(g)在一容积可变的密闭容器中进行,下列条件
2 3 4 2
A. α、β的值分别为2、2 B.若v =k c2(H O)c(N ),则K=
的改变能使反应速率加快的是( ) 逆 逆 2 2 c
C. 降低温度,k 可能增大 D. 表中的x为4
①增加铁的量 ②将容器的体积缩小一半 ③保持体积不变,充入N 使体系压强增大 ④ 正
2
8.反应NH HS(s) NH (g)+HS(g)在某温度下达到平衡,下列各种情况不会使平衡发生移动的
保持体积不变,充入水蒸气使体系压强增大 4 3 2
是( )
A.②④ B.②③ C.③④ D.①④
⇌
A.移走一部分NH HS固体 B. 温度、容积不变时,通入SO 气体
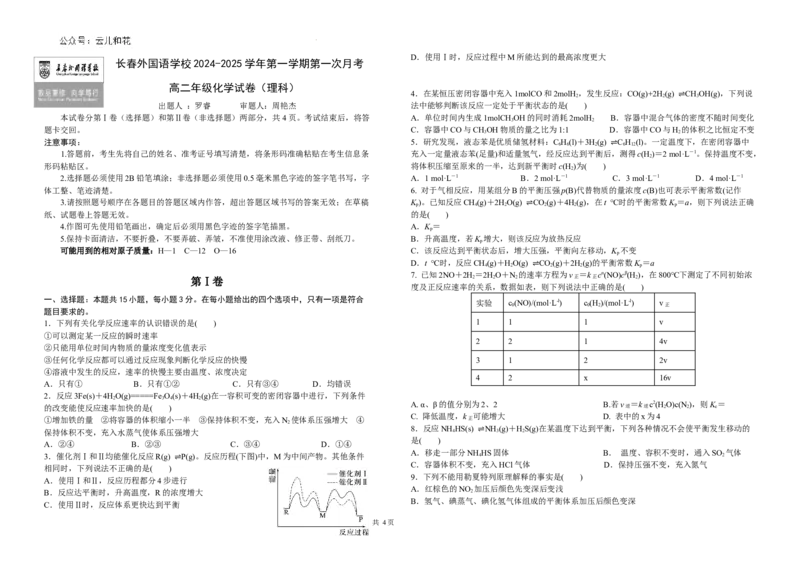
3.催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(下图)中,M为中间产物。其他条件 4 2
C.容器体积不变,充入HCl气体 D.保持压强不变,充入氮气
相同时,下列说法不正确的是( )
⇌ 9.下列不能用勒夏特列原理解释的事实是( )
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
A.红棕色的NO 加压后颜色先变深后变浅
B.反应达平衡时,升高温度,R的浓度增大 2
B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C.使用Ⅱ时,反应体系更快达到平衡
第 1 页 共 4页
学科网(北京)股份有限公司C.黄绿色的氯水光照后颜色变浅 下列说法不正确的是( )
D.向含有[Fe(SCN)]2+的红色溶液中加铁粉,振荡,溶液红色变浅或褪去 A.原料气须经过净化处理,以防止催化剂中毒和安全事故发生
B.合成氨一般选择400~500℃进行,主要是让铁触媒的活性最大,平衡转化率高
C.热交换的目的是预热原料气,同时对合成的氨气进行降温利于液化分离
10.下列对化学反应的预测正确的是( ) D.新型锰系催化剂将合成氨的温度、压强分别降到了350℃、1MPa,显著降低合成氨的能耗
选项 化学方程式 已知条件 预测
A A(s)===B(g)+C(s) ΔH>0 它一定是非自发反应
B A(g)+2B(g)===2C(g)+3D(g) 能自发反应 ΔH一定小于0
14.α 和α,c 和c 分别为两个恒容容器中平衡体系NO(g) 2NO (g)和3O(g) 2O(g)的反应
C M(s)+aN(g)===2Q(g) ΔH<0,自发反应 a可能等于1、2、3 1 2 1 2 2 4 2 2 3
D M(s)+N(g)=== 2Q(s) 常温下,自发进行 ΔH>0 转化率及反应物的平衡浓度,在温度不变的情况下,均增加反应物的物质的量,下列判断正确的
⇌ ⇌
11.有关反应CO(g)+H
2
O(g)⇌CO
2
(g)+H
2
(g),正反应为放热反应。若在容积可变的密闭容器 是( )
中,下列对图像的分析中不正确的是( ) A.α 1 减小、α 2 增大,c 1 、c 2 均增大 B.α 1 、α 2 均增大,c 1 、c 2 均减小
C.α、α 均减小,c、c 均增大 D.α 减小、α 增大,c 增大、c 减小
1 2 1 2 1 2 1 2
15.在容积为2 L的刚性密闭容器中加入1 mol CO 2 和3 mol H 2 ,发生反应:CO 2 (g)+3H 2 (g) ⇌
CHOH(g)+HO(g)。在其他条件不变的情况下,温度对反应的影响如图所示(注:T、T 均大于
3 2 1 2
300 ℃)。下列说法正确的是( )
A.图Ⅰ研究的是t 时升高温度对反应速率的影响
0
B.图Ⅱ研究的是t 时增大压强(缩小体积)或使用催化剂对反应速率的影响
0
C.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 A.该反应在T
1
的平衡常数比在T
2
时的小
D.图Ⅲ研究的是催化剂对化学平衡的影响,且乙使用了催化剂 B.处于A点的反应体系从T
1
变到T
2
,达到平衡时减小
12.在相同条件下研究催化剂Ⅰ、Ⅱ对反应 的影响,各物 C.T
2
时,反应达到平衡时生成甲醇的反应速率v(CH
3
OH)= mol·L-1·min-1
质浓度c随反应时间t的变化的部分曲线如图,下列说法正确的是( D.T
1
时若反应达到平衡后CO
2
的转化率为x,则容器内的压强与起始压强之比为(2-x) 2
)
∶
A.对于不能自发发生的反应,可寻找高效催化剂使其发生
第Ⅱ卷
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
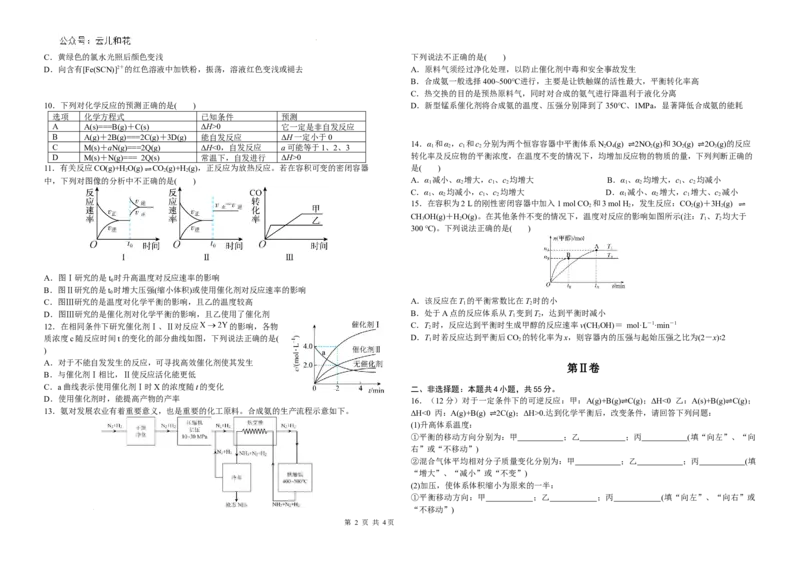
C.a曲线表示使用催化剂Ⅰ时X的浓度随t的变化 二、非选择题:本题共4小题,共55分。
D.使用催化剂时,能提高产物的产率 16.(12分)对于一定条件下的可逆反应:甲:A(g)+B(g) C(g);ΔH<0 乙:A(s)+B(g) C(g);
13.氨对发展农业有着重要意义,也是重要的化工原料。合成氨的生产流程示意如下。 ΔH<0 丙:A(g)+B(g) 2C(g);ΔH>0.达到化学平衡后,改变条件,请回答下列问题:
⇌ ⇌
(1)升高体系温度:
⇌
①平衡的移动方向分别为:甲 ;乙 ;丙 (填“向左”、“向
右”或“不移动”)
②混合气体平均相对分子质量变化分别为:甲 ;乙 ;丙 (填
“增大”、“减小”或“不变”)
(2)加压,使体系体积缩小为原来的一半:
①平衡移动方向:甲 ;乙 ;丙 (填“向左”、“向右”或
“不移动”)
第 2 页 共 4页
学科网(北京)股份有限公司②设压缩之前压强分别为p(甲)、p(乙)、p(丙),压缩后压强分别为pˊ(甲)、pˊ(乙)、pˊ(丙), 18.(16分)航天员呼吸产生的CO 用下列反应处理,可实现空间站中O 的循环利用。
2 2
则p(甲)与pˊ(甲)、p(乙)与pˊ(乙)、p(丙)与pˊ(丙)的关系分别为:甲 ;乙 Sabatier反应:CO(g)+4H(g) CH(g)+2HO(g)
2 2 4 2
; 水电解反应:2HO(g)=2H (g)+O(g)
2 2 2
⇌
丙 。 一种新的循环利用方案是用Bosch反应CO(g)+2H(g) C(s)+2H O(g) ΔH<0代替Sabatier反应,
2 2 2
17.(14分)“科学态度”是科学研究的基本要求,“社会责任”是化学人人生观和价值 再电解水实现O 的循环利用。
2
⇌
观的基本体现,“科学态度与社会责任”是化学的核心素养。 回答下列问题:
Ⅰ.Fenton法常用于处理含难降解有机物的工业废水,在加入 Fe2+并调好 pH后再加入 (1)有关上述反应,下列说法正确的是 (填标号)。
HO ,所产生的羟基自由基(·OH)能氧化降解污染物。现运用该法降解某有机污染物(p- A.室温下,2HO(g) 2H(g)+O(g)不能自发进行的原因为ΔS<0
2 2 2 2 2
CP),探究有关因素对该降解反应速率的影响。 B.可逆反应都有一定的限度,限度越大反应物的转化率一定越高
⇌
C.可逆反应中,若反应物的总能量>生成物的总能量,则ΔH<0
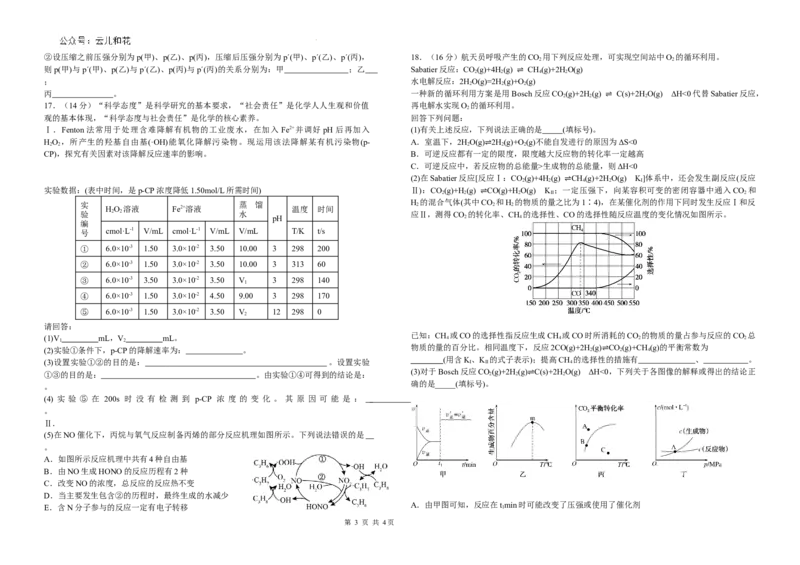
(2)在Sabatier反应[反应Ⅰ:CO(g)+4H(g) CH(g)+2HO(g) K]体系中,还会发生副反应(反应
2 2 4 2 Ⅰ
实验数据:(表中时间,是p-CP浓度降低1.50mol/L所需时间) Ⅱ):CO(g)+H(g) CO(g)+HO(g) K ;一定压强下,向某容积可变的密闭容器中通入CO 和
2 2 2 Ⅱ 2
⇌
实 蒸 馏 H 2 的混合气体(其中CO 2 和H 2 的物质的量之比为1∶4),在某催化剂的作用下同时发生反应Ⅰ和反
HO 溶液 Fe2+溶液 温度 时间 ⇌
验 2 2 水 应Ⅱ,测得CO 的转化率、CH 的选择性、CO的选择性随反应温度的变化情况如图所示。
pH 2 4
编
号 cmol·L-1 V/mL cmol·L-1 V/mL V/mL T/K t/s
① 6.0×10-3 1.50 3.0×10-2 3.50 10.00 3 298 200
② 6.0×10-3 1.50 3.0×10-2 3.50 10.00 3 313 60
③ 6.0×10-3 3.50 3.0×10-2 3.50 V 3 298 140
1
④ 6.0×10-3 1.50 3.0×10-2 4.50 9.00 3 298 170
⑤ 6.0×10-3 1.50 3.0×10-2 3.50 V 12 298 0
2
请回答:
(1)V mL,V mL。
已知:CH
4
或CO的选择性指反应生成CH
4
或CO时所消耗的CO
2
的物质的量占参与反应的CO
2
总
1 2
(2)实验①条件下,p-CP的降解速率为: 。 物质的量的百分比。相同温度下,反应2CO(g)+2H 2 (g) CO 2 (g)+CH 4 (g)的平衡常数为
(3)设置实验①②的目的是: 。设置实验
(用含K
Ⅰ
、K
Ⅱ
的式子表示);提高CH
4
的选择性的措施有 、 。
⇌
(3)对于Bosch反应CO(g)+2H(g) C(s)+2HO(g) ΔH<0,下列关于各图像的解释或得出的结论正
①③的目的是: 。由实验①④可得到的结论是: 2 2 2
确的是_____(填标号)。
。
⇌
(4) 实 验 ⑤ 在 200s 时 没 有 检 测 到 p-CP 浓 度 的 变 化 。 其 原 因 可 能 是 :
。
Ⅱ.
(5)在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列说法错误的是
。
A.如图所示反应机理中共有4种自由基
B.由NO生成HONO的反应历程有2种
C.改变NO的浓度,总反应的反应热不变
D.当主要发生包含②的历程时,最终生成的水减少
E.含N分子参与的反应一定有电子转移
A.由甲图可知,反应在t
1
min时可能改变了压强或使用了催化剂
第 3 页 共 4页
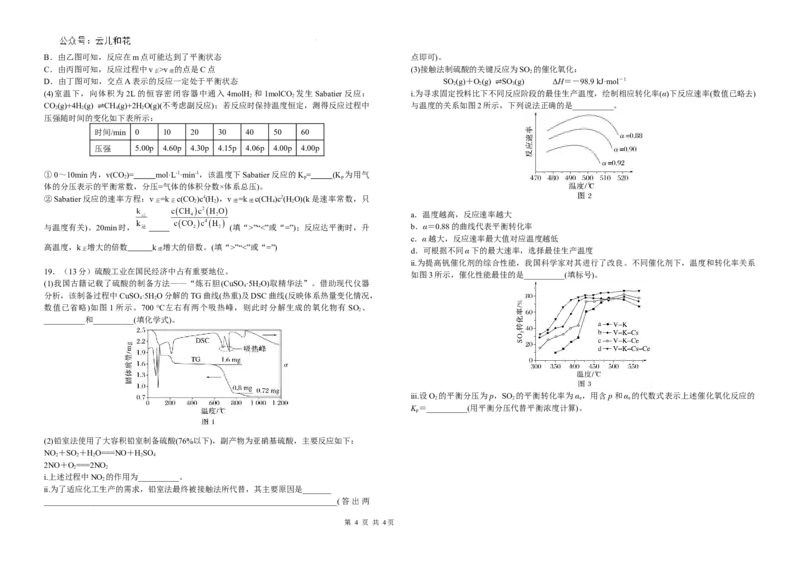
学科网(北京)股份有限公司B.由乙图可知,反应在m点可能达到了平衡状态 点即可)。
C.由丙图可知,反应过程中v >v 的点是C点 (3)接触法制硫酸的关键反应为SO 的催化氧化:
正 逆 2
D.由丁图可知,交点A表示的反应一定处于平衡状态 SO (g)+O(g) SO (g) ΔH=-98.9 kJ·mol-1
2 2 3
(4)室温下,向体积为2L的恒容密闭容器中通入 4molH 和1molCO 发生Sabatier反应: ⅰ.为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)
2 2
⇌
CO(g)+4H(g) CH(g)+2HO(g)(不考虑副反应);若反应时保持温度恒定,测得反应过程中 与温度的关系如图2所示,下列说法正确的是__________。
2 2 4 2
压强随时间的变化如下表所示:
⇌
时间/min 0 10 20 30 40 50 60
压强 5.00p 4.60p 4.30p 4.15p 4.06p 4.00p 4.00p
①0~10min内,v(CO)= mol·L-1·min-1,该温度下Sabatier反应的K= (K 为用气
2 p p
体的分压表示的平衡常数,分压=气体的体积分数×体系总压)。
②Sabatier反应的速率方程:v =k c(CO)c4(H ),v =k c(CH)c2(H O)(k是速率常数,只
正 正 2 2 逆 逆 4 2
a.温度越高,反应速率越大
与温度有关)。20min时, (填“>”“<”或“=”);反应达平衡时,升 b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
高温度,k 增大的倍数 k 增大的倍数。(填“>”“<”或“=”)
正 逆 d.可根据不同α下的最大速率,选择最佳生产温度
ⅱ.为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系
19.(13分)硫酸工业在国民经济中占有重要地位。
如图3所示,催化性能最佳的是__________(填标号)。
(1)我国古籍记载了硫酸的制备方法——“炼石胆(CuSO ·5H O)取精华法”。借助现代仪器
4 2
分析,该制备过程中CuSO ·5H O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,
4 2
数值已省略)如图1所示。700 ℃左右有两个吸热峰,则此时分解生成的氧化物有 SO 、
2
__________和__________(填化学式)。
ⅲ.设O 的平衡分压为p,SO 的平衡转化率为α,用含p和α 的代数式表示上述催化氧化反应的
2 2 e e
K =__________(用平衡分压代替平衡浓度计算)。
p
(2)铅室法使用了大容积铅室制备硫酸(76%以下),副产物为亚硝基硫酸,主要反应如下:
NO +SO +HO===NO+HSO
2 2 2 2 4
2NO+O===2NO
2 2
ⅰ.上述过程中NO 的作用为__________。
2
ⅱ.为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是_______
________________________________________________________________________(答出两
第 4 页 共 4页
学科网(北京)股份有限公司17.【答案】(共14分)
(1)8.00(或8、8.0)(1分) 10.00(或10、10.0) (1分)
(2)0.0075mol/(L·s)(或7.5×10-3)
(3)探究温度对反应速率的影响 探究HO 溶液的浓度对反应速率的影响
2 2
其他条件相同时,c(Fe2+)越大,反应速率越大
(4)Fe2+在该条件下生成Fe(OH) ,并迅速被氧化成Fe(OH) ,不能使HO 产生羟基自由基
2 3 2 2
(5)AD
18.【答案】(共16分)
(1)C
K
1
(2) 控制反应温度在340℃左右(1分) 增大压强(1分)
K2
11
(3)BC
1
(4)0.01 > <
16P2
19.【答案】(共13分)
(1)CuO SO
3
(2)ⅰ.催化剂(1分)
ⅱ.铅室法制得的产品中存在亚硝基硫酸杂质,生产过程中需使用有毒的氮氧化物
长春外国语学校2024-2025学年第一学期第一次月考
(3)ⅰ.cd ⅱ.d ⅲ.
高二年级化学答案(理科)
一、单项选择题
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
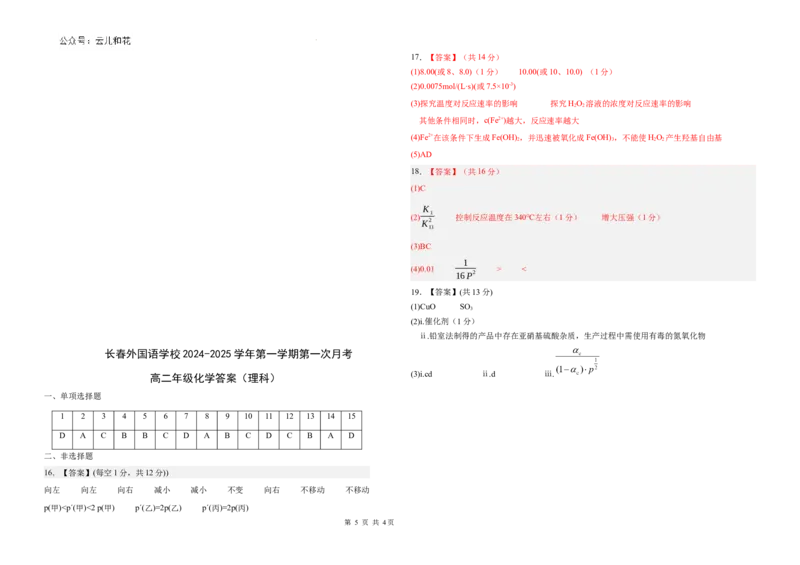
D A C B B C D A B C D C B A D
二、非选择题
16.【答案】(每空1分,共12分))
向左 向左 向右 减小 减小 不变 向右 不移动 不移动
p(甲)