文档内容
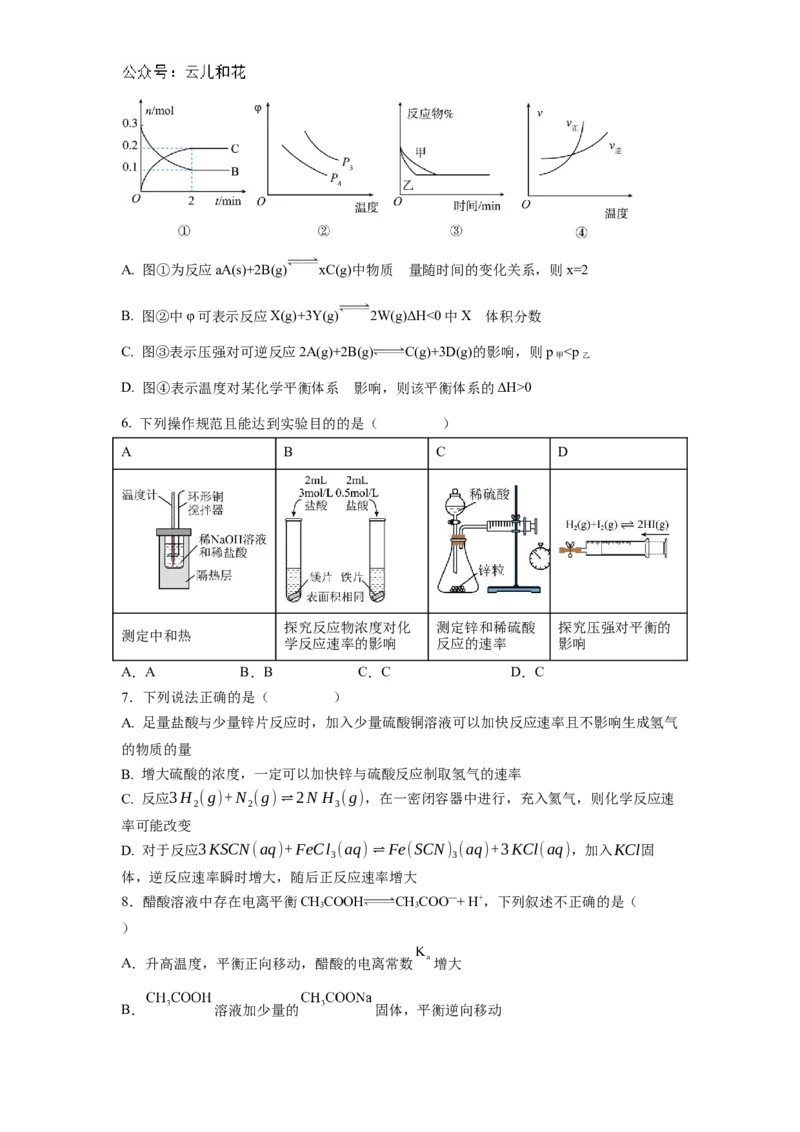
0 6. 下列操作规范且能达到实验目的的是( ) A B C D 探究反应物浓度对化 测定锌和稀硫酸 探究压强对平衡的 测定中和热 学反应速率的影响 反应的速率 影响 A.A B.B C.C D.C 7.下列说法正确的是( ) A. 足量盐酸与少量锌片反应时,加入少量硫酸铜溶液可以加快反应速率且不影响生成氢气 的物质的量 B. 增大硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率 C. 反应3H (g)+N (g)⇌2N H (g),在一密闭容器中进行,充入氦气,则化学反应速 2 2 3 率可能改变 D. 对于反应3KSCN(aq)+FeCl (aq)⇌Fe(SCN) (aq)+3KCl(aq),加入KCl固 3 3 体,逆反应速率瞬时增大,随后正反应速率增大 8.醋酸溶液中存在电离平衡CHCOOH CHCOO—+ H+,下列叙述不正确的是( 3 3 ) A.升高温度,平衡正向移动,醋酸的电离常数 增大 B. 溶液加少量的 固体,平衡逆向移动C. 的 溶液加水稀释,溶液中 减小 D.室温下,欲使 醋酸溶液的电离度增大,可加入少量冰醋酸 9.在恒压、H 和CO 的起始浓度一定的条件下,用不同Mg含量的催化剂Ni/xMg(x值越 2 2 大表示 Mg 含量越大)催化反应相同时间,测得不同温度下反应:4H(g)+CO(g) 2 2 CH(g)+2HO(g)的 CO 转化率如图所示。下列说法正确 4 2 2 的是( ) A.反应4H(g)+CO(g) CH(g)+2HO(g)的ΔH>0 2 2 4 2 B.延长W点的反应时间也无法提高CO 的转化率 2 C.相同条件下催化剂中Mg的含量越高催化效率越高 D.当反应温度低于350 ℃,该反应的平衡常数随温度升高 而增大。 10.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应: ¿(s)+4CO(g)⇌∋(CO) (g),已知该反应平衡常数与温度的关系如下表: 4 温度℃ 25 80 230 平衡常 5×104 2 1.9×10−5 数 下列说法正确的是( ) A. 上述生成¿(CO) (g)的反应为吸热反应 4 B. B. 25℃时反应¿(CO) (g)⇌∋(s)+4CO(g)的平衡常数为0.5 4 C. C. 在80℃时,测得某时刻,¿(CO) 、CO浓度均为0.5mol/L,则此时v(正)>v(逆) 4 D. D. 80℃达到平衡时,测得n(CO)=0.3mol,则¿(CO) 的平衡浓度为2mol/L 4 11.用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如图所示,已知下列 过程中钯(Pd)以正二价形式存在。下列有关说法正确的是( ) A.HO 的电子式为 2 2 B.反应①②③均为氧化还原反应 C.反应②中有1molO 参与反应时转移电子的物质的量为 2 2mol D.反应过程中[PbCl O]2−、HCl均为该反应的催化剂 2 2 12.一定条件下在密闭烧瓶内发生反应:2NO (g) NO(g) △H<0。下列说法正确的是 2 2 4 ( ) A.测定NO 的相对分子质量时,选择高温、高压条件时误差较小 2 B.将烧瓶放入热水中,正逆反应速率均加快,烧瓶内气体颜色加深 C.恒温,恒容,若平衡后再向烧瓶内充入NO ,平衡向右移动,烧瓶内气体颜色比原来 2浅 D.恒温,恒容,若向烧瓶内充入N,烧瓶内压强增大,反应速率加快 2 13.Burns和Dainton研究发现Cl 与CO合成COCl 的反应机理如下: 2 2 ① Cl (g) 2Cl•(g) 快 2 ② CO(g)+Cl•(g) COCl•(g) 快 ③ COCl•(g)+Cl(g) COCl (g)+Cl•(g) 慢 2 2 反应②的速率方程为v =k c(CO)×c(Cl•),v =k c(COCl•)。下列说法错误的是( 正 正 逆 逆 ) A.反应①的活化能小于反应③的活化能 B.反应②的平衡常数K= C.要提高合成COCl 的速率,关键是提高反应③的速率 2 D.选择合适的催化剂并不能提高单位时间内COCl 的产率 2 14.二氧化碳加氢制甲醇涉及的反应可表示为: 反应Ⅰ:CO (g)+3H (g)=CH OH(g)+H O(g) ΔH =−49kJ⋅mol−1 2 2 3 2 1 反 应 Ⅱ : CO (g)+H (g)=CO(g)+H O(g) ΔH =+41kJ⋅mol−1 2 2 2 2 一体积固定的密闭容器中,在5MPa下,按照n(CO ):n(H )=1:3投料,平衡时,CO 2 2 和CH OH在含碳产物中物质的量分数及CO 的转化率随温度的变化如题图所示.下列说 3 2 法正确的是( ) A. H 的平衡转化率始终不高于CO 2 2 B. n曲线代表的物质为CH OH,温度越高,越有利于CH OH的生成 3 3 C. 270~400℃时,平衡移动的程度:反应Ⅰ>反应Ⅱ D. 加入选择性高的催化剂,可提高CH OH的平衡转化率 3 第Ⅱ卷(非选择题,共 58分) 二、填空题15.(14分)生产生活中的化学反应都伴随能量的变化,请根据有关知识回答下列问题: (1)制作有降温、保鲜和镇痛的冷敷袋可以利用 ______(填“放热”或“吸热”)的化学 变化或物理变化. (2)“即热饭盒”可利用下面 ______(填字母序号)反应释放的热量加热食物. A.生石灰和水 B.浓硫酸和水 C.钠和水 (3)丙烷 常用作运动会火炬燃料。一定量丙烷气体完全燃烧生成 和 (C H ) CO (g) 3 8 2 过程中放出了553.75kJ能量。请写出丙烷燃烧的热化学方程式:_____, 1molH O(l) 2 (4)在发射“神舟”七号的火箭推进器中装有肼(N H)和过氧化氢,当两者混合时即产生 2 4 气体,并放出大量的热。已知:NH(l)+2HO(l)==N(g)+4HO(g) ΔH=-641.6 kJ·mol- 2 4 2 2 2 2 1;HO(l)==H O(g) ΔH=+44.0 kJ·mol-1,若用6.4 g液态肼与足量过氧化氢反应生成氮气 2 2 和液态水,则整个过程中放出的热量为 。 (5)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C HN)作推进剂。NO 与偏 2 8 2 2 4 二甲肼燃烧产物只有CO(g)、HO(g)、N(g),并放出大量热,已知10.0 g液态偏二甲肼与 2 2 2 液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为 。 (6)火箭和导弹表面的薄层是耐高温物质.制得该物质的热化学方程式为 4Al(s)+3TiO (s)+3C(s)=2Al O (s)+3TiC(s)ΔH=−1176kJ/mol.该反应中每 2 2 3 转移1mol电子放出的热量为 ______kJ. (7)键能是指气态分子中1mol化学键解离成气态原子所吸收的能量,相关化学键键能如 下。 化学键 C O(CO) O=O C=O 键能(KJ/mol) a 500 1075 已知: ;则a= 。 16.(16分) 下表是不同条件下合成氨反应达平衡时反应混合物中氨的体积分数(%)。 0.1MPa 10MPa 20MPa 30MPa 60MPa 500℃ 0.10 10.6 19.1 26.4 42.2 600℃ 0.05 4.50 9.10 13.8 23.1 (1)目前,我国合成氨工业生产中采用的压强一般不高于30MPa,主要原因是 。 (2)250℃时,在体积为2.0L的恒容密闭容器中加入6molH 、2molCO 和催化剂,发生反应 2 2 CO(g)+3H (g) CHOH(g)+H O(g),10min时反应达到平衡,测得 2 2 3 2 c(CHOH)=0.75mol/L。 3 ①下列描述中能说明上述反应已达平衡的是 (填编号)。 A.3ν (H )=ν (CHOH) 正 2 逆 3 B.容器中气体压强不随时间而变化 C.c(H ) ∶c(CO)的值不变 2 2 D.容器中气体平均相对分子质量不随时间而变化②250℃时,该反应的化学平衡常数K= 。 ③若其他条件不变,将上述反应改在初始体积为2.0L的恒压容器中进行,则平衡时相较于 恒容容器,CO 的转化率 (填“更高”,“更低”或“不变”, 2 下同),平衡常数K 。 (3)合成总反应在起始物 时,在不同条件下达到平衡, 设体系中甲醇的物质的量分数为 ,在恒温 ℃下的 、在恒压 下的 如图所示。 ①图中对应等压过程的曲线是 ,判断的理由是 ; ②当 时, 的平衡转化率 (保留三位有效数 字) 17. (14分)环成二烯(C H)是一种重要的有机化工原料。 5 6 Ⅰ.环戊二烯容易反应生成双环戊二烯(C H ):2C H(g) C H (g)。不同温度下,溶 10 12 5 6 10 12 液中环戊二烯(C H)浓度(初始浓度为1.5mol·L-1 )与反应时间的关系如图所示。 5 6 (1) 反应开始至b点时,用双环戊二烯(C H )表示的平均速率为 。 10 12 (2) (填“大于”、“小于”或“等于”) (3)a点的正反应速率 b点的逆反应速率(填“大于”、“小于”或“等于”) Ⅱ.可用环戊烯(C H)制备环戊二烯(C H)。有如下反应: 5 8 5 6 反应i:C H(g) C H(g)+ H(g) ∆H =+100.3kJ·mol-1 5 8 5 6 2 1 反应ii:2HI(g) H (g) + I (g) ∆H =+11.0 kJ·mol-1 2 2 2 反应iii:C H(g) + I (g) C H(g)+ 2HI(g) ∆H 5 8 2 5 6 3 (4)反应iii的焓变∆H= kJ·mol-1 3 (5)某温度时在恒容密闭容器中充入等物质的量的碘和环戊烯发生反应iii,起始总压为P, 0 平衡时总压为1.2 P。 0 ①平衡时环戊烯(C H)的体积分数为 %。 5 8 ②用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算压强平衡常数K = 。 p ③达到平衡后,欲增加环戊烯(C H)的平衡转化率,可采取的措施有 。 5 8 A.加入催化剂 B. 适当升高温度 C.增大环戊烯C H 5 8 的浓度 D.适当降低压强 18.(14分)(1)现有物质①硫酸铜溶液 ②碳酸钙固体 ③冰醋酸 ④浓硫酸 ⑤三氧化 硫 ⑥金属镁 ⑦石墨 ⑧熔融苛性钾 ⑨氨水 ⑩HCl ,按下列要求填空。 属于强电解质的是 (填序号,下同);能导电的是 。 (2)在一定温度下,向CHCOONa溶液中逐渐通入少量HCl气体,下列图形最接近实验过 3程中电流(I)随所加HCl的量变化的是 。 (3)常温下,部分酸的电离常数如表所示: 化学式 HF HCN HCO 2 3 电离 K =4.4×10-7 K=3.5×10-4 K=5.0×10-10 a1 常数 a a K =4.7×10-11 a2 ①c(H+)相同的三种酸,其酸的浓度由大到小的顺序为_______________________。 ②中和等量的 NaOH,消耗等 pH 的氢氟酸和硫酸的体积分别为 a L、b L,则 a________b(填“大于”“小于”或“等于”,下同)。中和等物质的量浓度、等体积的氢 氟酸和硫酸需要NaOH的物质的量为n、n,则n________n。 1 2 1 2 ③向NaCN溶液中通入少量的CO,发生反应的离子方程式为__________________。 2高二上期一月月考化学参考答案 一、选择题(14*3=42分) 1 2 3 4 5 6 7 C A B D B C C 8 9 10 11 12 13 14 D B D C B D A 二、填空题(共58分,每空2分) 15.(1)吸热 (2)A (3)C H (g)+5O (g) = 3CO (g)+4H O(l) △H= -2215kJ/mol 3 8 2 2 2 (4)163.52kJ (5)C H N (l)+2N O (l) = 2CO (g)+3N (g)+4H O(g) △H= -2550kJ/mol 2 8 2 2 4 2 2 2 (6)98 (7)1617 16.(1)压强过大,对设备的要求更高,压缩过程中的能耗也更大,使得综合成本过高。 (2)①BD ② ③更高 不变 (3)①b ; 等温条件下, 增大压强,平衡 正向移动,x(CH OH) 会变大,故a为等温线,所以b为等压过程的曲线。 ②33.3% 3 17. (1)0.45mol·L-1·h-1 (2)小于 (3)大于 (4)+89.3 (5)①25 ② ③BD 18.(1)②⑧⑩ ; ①⑥⑦⑧⑨ (2)C (3)①c(HCN)>c(H CO )>c(HF) ②小于 小于 2 3 ③CO +CN-+H O=HCN+HCO - 2 2 3