文档内容
{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}#$#%!#$#& 学年山西名校十月联合考试
高二化学参考答案
!’(!"解析#甲醇燃烧是个放热!熵增的过程"(项正确#
#’)!"解析#温室气体主要是指二氧化碳"二氧化碳不是形成酸雨的主要物质"形成酸雨的主
要物质是硫氧化物!氮氧化物等")项错误#
"’*!"解析#铁棒能导热"铁棒代替玻璃搅拌器会导致反应温度差变小"得到的反应热$!!%的
值偏大"*项错误#
%’)!"解析#!!"$!!""$的反应在较高温度下能自发进行"*项错误&催化剂不能增大反应
限度"+项错误&活化分子间的碰撞不一定是有效碰撞"(项错误#
&’(!"解析#铝遇浓硫酸在常温下发生钝化"钝化属于化学变化"即发生了化学反应"*项不符
合题意&应用湿润的红色石蕊试纸检验氨气")项不符合题意&该原电池装置中*,为负极"+
项不符合题意#
-’+!"解析#对于+,./0#$/+,./+,0平衡体系"氯离子浓度增大"平衡向逆反应方向
# #
移动"减小了氯气的溶解度"能用勒夏特列原理解释"*项不符合题意&对于二氧化碳溶解平
衡体系"压强减小"气体溶解度减小"气体溶解平衡发生移动"能用勒夏特列原理解释")项不
符合题意&食品包装袋内加入铁粉包未涉及化学平衡移动"+项符合题意&增大压强"平衡向
生成氨气的方向移动"能够用勒夏特列原理解释"(项不符合题意#
1’)!"解析#分子中含有酮羰基!羟基!羧基和碳碳双键四种官能团")项错误#
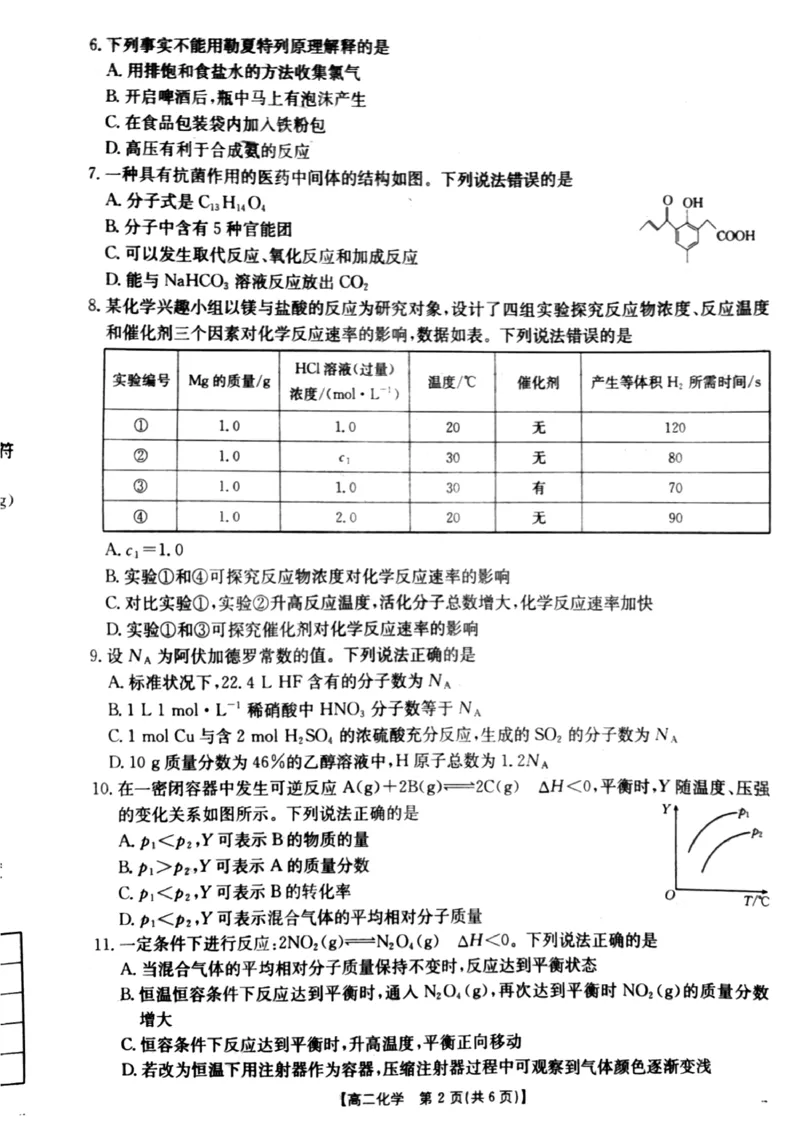
2’(!"解析#依据题意可推知"实验
"#
探究反应温度对反应速率的影响"实验
#$
探究催化
剂对反应速率的影响"实验
"%
探究反应物浓度对反应速率的影响"故#3!’$"(项错误#
!
4’(!"解析#标准状况下"/5为液体"*项错误&稀硝酸中不含/60 分子")项错误&浓硫酸
"
变稀"反应停止"生成的70 的分子数小于$ "+项错误#
# *
!$’*!"解析#该反应的正向反应为气体体积分数减小的放热反应"温度升高有利于逆反应的
进行$即温度升高")的物质的量及*的质量分数都增大%"压强增大有利于正反应的进行
$即压强增大")的转化率及混合气体的平均相对分子质量都增大%"*项符合题意#
!!’*!"解析#由于反应物和生成物均为气体"且反应前后 !%$气体%%$"故& $混合气体%不变
8
时"反应达到平衡"*项正确&恒温恒容条件下反应达到平衡时"通入60 "再次达到平衡
# %
时60 的质量分数减小")项错误&温度升高"平衡逆向移动"+项错误&若改为恒温下用注
#
射器作为容器"压缩注射器过程中可观察到气体颜色先深后浅"(项错误#
!#’+!"解析#少量70 通入9+,0溶液中会有/+,0生成"*项错误&硝酸会氧化硫离子")
#
项错误&聚丙烯的结构简式为 &+/ ((+/$+/ %’"(项错误#
# "
!"’)!"解析#淀粉水解液呈酸性"应先加6:0/溶液中和酸并使溶液呈碱性"*项不符合题
意&乙烯和丙烯均能使酸性高锰酸钾溶液褪色"+项不符合题意&制备金属钠时"应电解熔融
6:+,"(项不符合题意#
!高二化学"参考答案!第!!!!!页#共"页$%
!"#$!%
{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}
书书书!%’)!"解析#根据反应7
#
+,
#
$;%.+,
#
$;%#$#7+,
#
$;%可知"’正 $+,
#
%<’逆 $7+,
#
%3!<#时"
反应达到平衡状态"由图像可知"(!)点时’正 $+,
#
%<’逆 $7+,
#
%3!<#"反应达到平衡状
态"继续加热"’正 $+,
#
%<’逆 $7+,
#
%)!<#"即’正 $+,
#
%)’逆 $+,
#
%"平衡逆向移动"该反应正
向为放热反应"*项错误&该反应是反应前后气体分子数不变的纯气体反应"初始投料改为
#=>,7+, 和#=>,+,"平衡时+, 的转化率不变"+项错误&该反应是反应前后气体分子
# # # #
数不变的纯气体反应"改变压强平衡不移动"达到平衡后缩小容器容积"重新达到平衡后"体
系的温度不变"因此*不变"(项错误#
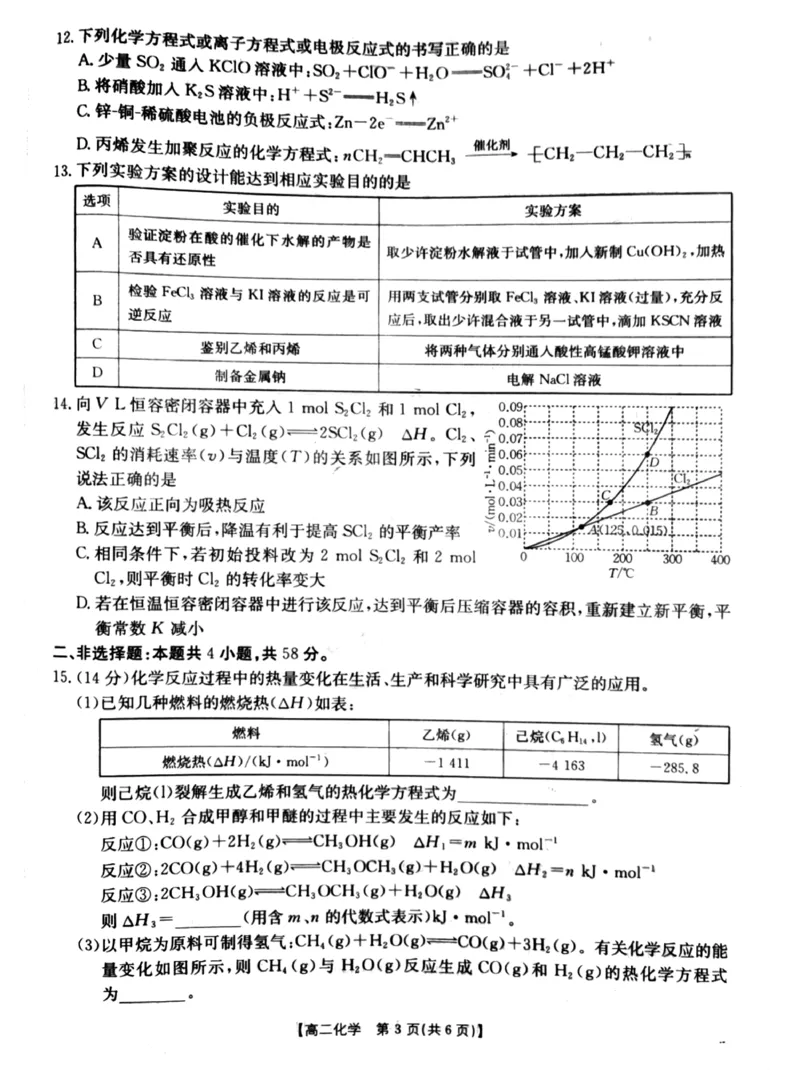
!&’$!%+/ $,%***"+/ $;%./ $;%!!!3."&&’2?@’=>,A!$#分%
- !% # % #
$#%$%A#+%$#分%
$"%+/ $;%./0$;%#$+0$;%."/ $;%!!!3.!-!’!?@’=>,A!$#分%
% # #
"$#,.-%
$%%"$#分%& $#分%
2
$&%"$#分%&6$;%."/ $;%#$#6/ $;%!!!3A4$’2?@’=>,A!$#分%
# # "
"解析#$#%依据盖斯定律可知 !! 3!! A#!! "故 !! 3$%A#+%?@’=>,A!#
" # ! "
$%%由 "B#.# 可得+0还原60 至6 反应的化学方程式为%+0$;%.#60 $;%***
# # #
6$;%.%+0 $;%!!!3$A#,A-%?@’=>,A!"%+0$;%&2CA&$A#,A-%?@"当有
# #
"$#,.-%
""’-D$标准状况%+0发生反应"转移电子的数目为"$ "放出的热量为 ?@#
* 2
’’
!-’$!%6:.(’7’/)A$#分%&球形干燥管$#分%
’ ’
’’
$#%6$!分%&平衡压强"便于稀盐酸顺利滴下$#分%&除去/7气体中的/+,杂质$#分%
#
$"%5C7.#/.***5C#../7+$#分%&$$#分%
#
$%%+:$7/%.#+:+6 .-/0** , *#+7$6/ %."+:$0/%$#分%
# # # # # #
"解析#$#%仪器E的支管的作用是平衡压强"便于稀盐酸顺利滴下&装置*的作用是除去
/7气体中的/+,杂质#
#
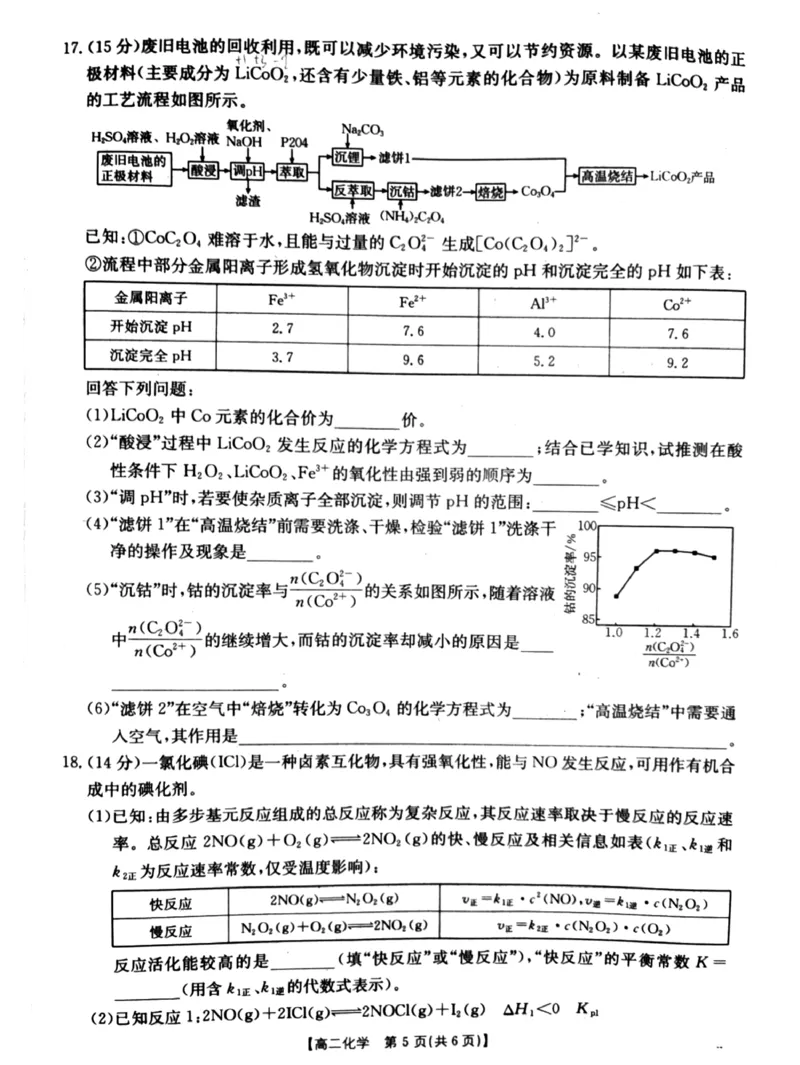
!1’$!%."$!分%
$#%#DF+>0 ./0 ."/70 ***#+>70 .DF70 .0 +.%/0$#分%&DF+>0 "
# # # # % % # % # # #
/0 "5C".$#分%
# #
$"%&’#$!分%&1’-$!分%
$%%取最后一次洗涤液少许于试管中"滴加盐酸酸化的氯化钡溶液"无白色沉淀产生"则已洗
净$或其他合理答案"#分%
$&%+>+0 与过量的+0#A 生成(+>$+0 %)#A而溶解$#分%
# % # % # % #
焙烧
$-%"+>+0 .#0 ***+>0 .-+0 $#分%&利用空气中的氧气将.#价+>氧化为."价
# % # " % #
$#分%
"解析#$#%DF+>0 中."价的+>元素被/0 还原为.#价的+>#."故反应的化学方程式
# # #
为#DF+>0 ./0 ."/70 ***#+>70 .DF70 .0 +.%/0#
# # # # % % # % # #
!高二化学"参考答案!第!!!!#页#共"页$%
!"#$!%
{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}$"%*调 G/+将溶液中的杂质离子*,".和5C".转化为沉淀"即 G/-&’#&同时不能沉淀
+>#."即 G/)1’-#
$%%检验*滤饼!+洗涤干净只需要检验最后一次洗涤液中不含硫酸根离子#
$-%+>+0 在空气中加热"+>+0 晶体被空气中的氧气氧化"得到+>0 "根据元素守恒
# % # % " %
焙烧
和得失电子守恒可写出反应的化学方程式,"+>+0 .#0 ***+>0 .-+0 #
# % # " % #
!2’$!%慢反应$!分%& . !正 $#分%
. !逆
$#%!! .!! $#分%&,$#分%&高温$!分%
! #
!#’% $#%’2B!$"%# #%’2#
$"%$’!$#分%& $#分%& 或 $#分%
/ !$$B$#$’$B!$"A!#’%B!$"% $’!B$#$’$A!#’%%
"解析#$!%依据化学反应达到平衡时正!逆反应速率相等(. !正 ’##$60%3. !逆 ’#$6 # 0 # %)"
可知*3 . !正 #
. !逆
$"%依据* $0H%3!B!$%I:#"可知平衡时 1$+,%3$’!?I:&设$&/=FJ内K$;%变化
G" # #
的压强为2?I:"列三段式,
+,$;%.K$;%#$#K+,$;%
# #
起始分压-?I:, #$
平衡分压-?I:, $’! #$A2 #2
!#’%
$’!.#$A2.#23"#’&"解出23!#’%"$&/=FJ内"’$K%3 ?I:’=FJA!"* 3
# / G%
$#%’2B!$"%# #%’2#
或 #
!$$B$#$’$B!$"A!#’%B!$"% $’!B$#$’$A!#’%%
!高二化学"参考答案!第!!!!"页#共"页$%
!"#$!%
{#{QQABCQYAgggIAIAAAAhCQwFYCgGQkBEAAagGwBAMsAIAiRFABCA=}#}