文档内容
新蔡县第一高级中学2024-2025学年高二下学期开学考试化学试题
一、单选题(每题3分,共42分)
1.下列说法正确但不能用勒夏特列原理解释的是
A.对NO (g)+CO(g) CO (g)+NO(g)平衡体系加压,气体颜色变深
2 2
B.合成氨工业使用高压以提高氨的产量
⇌
C.用饱和食盐水除去Cl 中的HCl,可减少Cl 的损失
2 2
D.硫酸工业将SO 催化氧化成SO 的反应,往往需要使用过量空气
2 3
2.化学和生活、科技、社会发展息息相关,下列说法正确的是
A.“深海一号”母船海水浸泡区的铝基可保障船体不易腐蚀
B.高效率钙钛矿太阳能电池,其能量转化形式为电能→化学能
C.华为新上市的mate60 pro手机引发关注,其芯片材料是SiO
2
D.“北斗卫星”授时系统的“星载铷钟”含铷元素,其单质遇水能缓慢反
应放出H
2
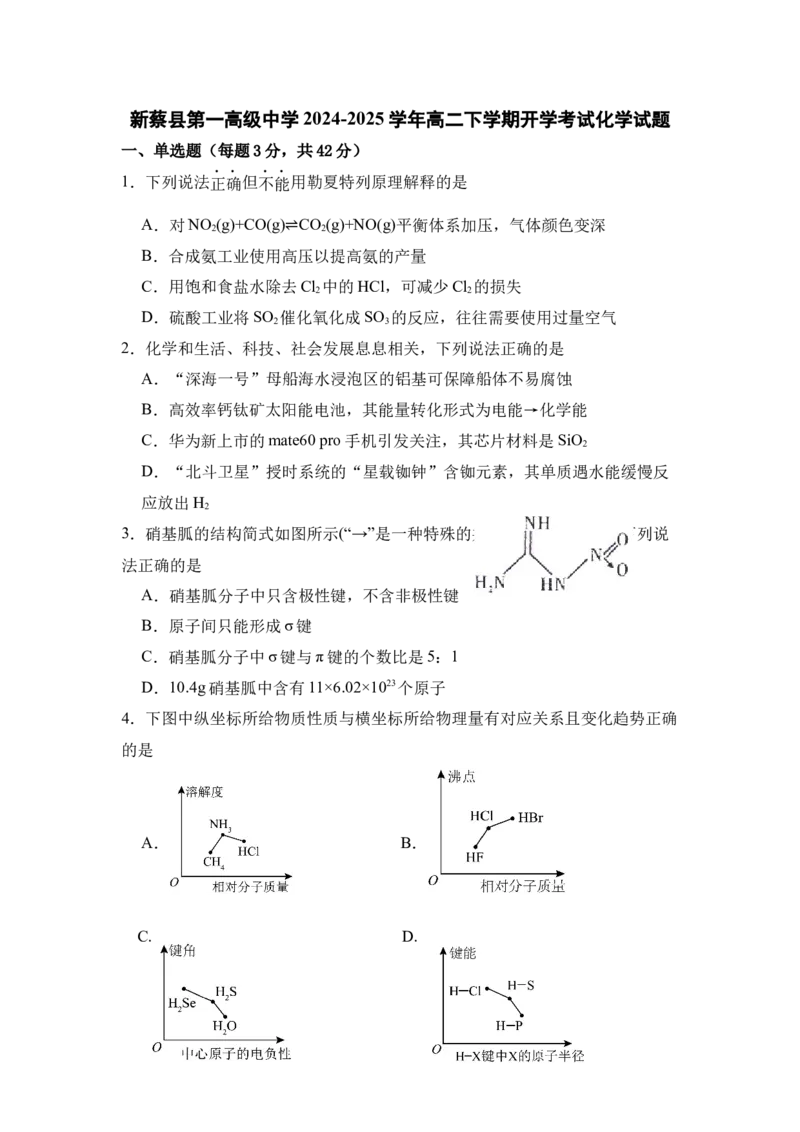
3.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)下列说
法正确的是
A.硝基胍分子中只含极性键,不含非极性键
B.原子间只能形成σ键
C.硝基胍分子中σ键与π键的个数比是5:1
D.10.4g硝基胍中含有11×6.02×1023个原子
4.下图中纵坐标所给物质性质与横坐标所给物理量有对应关系且变化趋势正确
的是
A. B.
C. D.5.下列说法不正确的是
A.HCl、HBr、HI的沸点依次升高与分子间作用力大小有关
B.晶体硅、碳化硅、金刚石的熔点依次升高与共价键键能大小有关
C. 的热稳定性大于 与 分子间存在氢键有关
D. 在水中的溶解度大于 在水中的溶解度与分子的极性有关
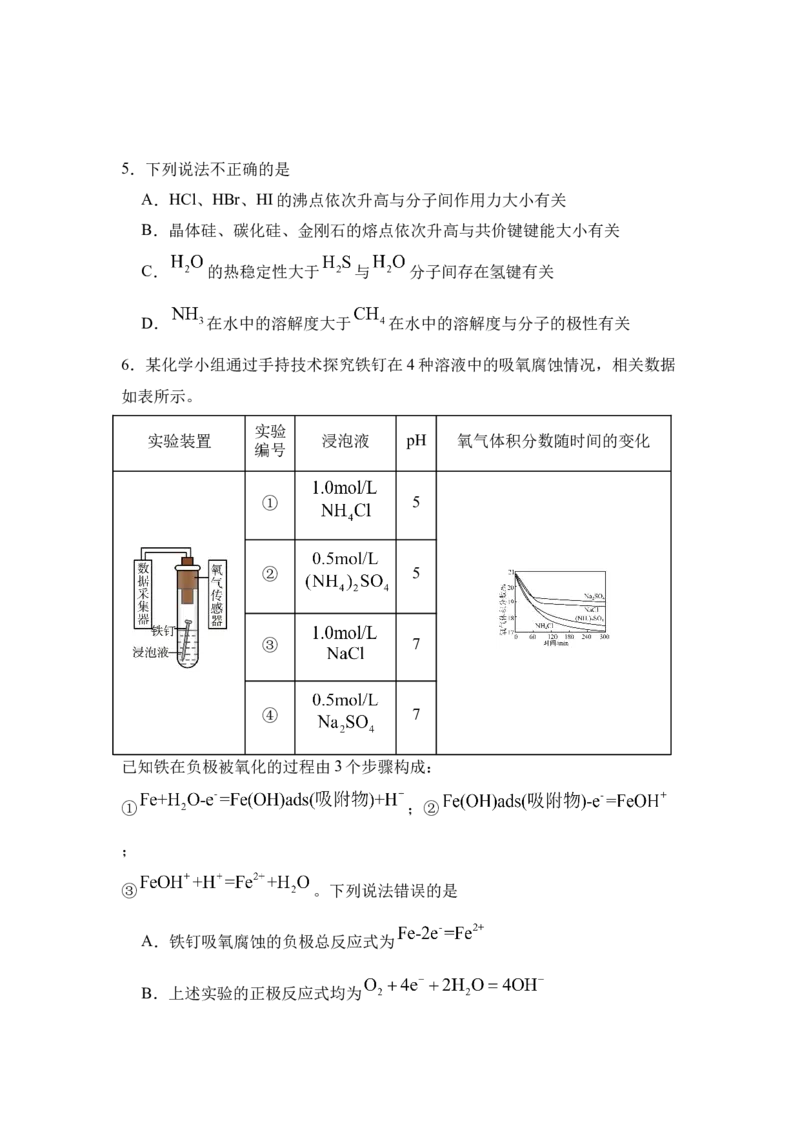
6.某化学小组通过手持技术探究铁钉在4种溶液中的吸氧腐蚀情况,相关数据
如表所示。
实验
实验装置 浸泡液 pH 氧气体积分数随时间的变化
编号
① 5
② 5
③ 7
④ 7
已知铁在负极被氧化的过程由3个步骤构成:
① ;②
;
③ 。下列说法错误的是
A.铁钉吸氧腐蚀的负极总反应式为
B.上述实验的正极反应式均为C.由实验可知,铁钉在中性溶液中比在弱酸性溶液更难被腐蚀
D.和 相比浸泡液存在带相同电荷数的 ,使铁钉更难腐蚀
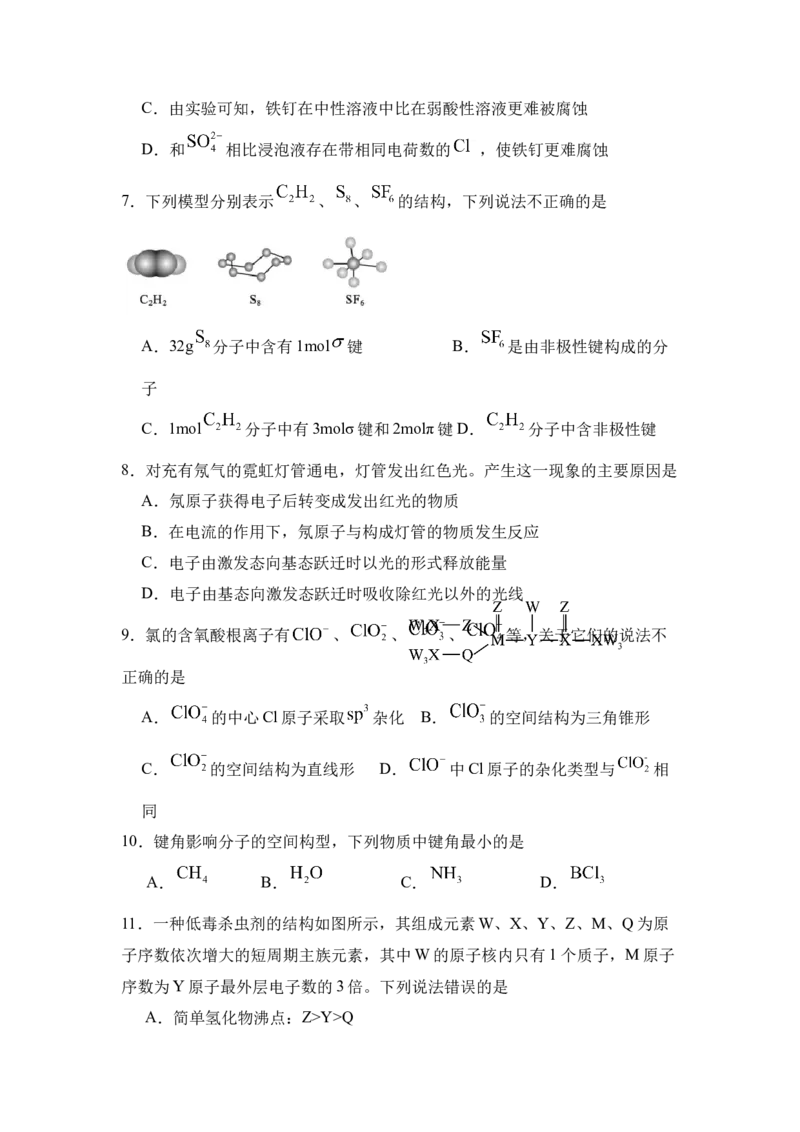
7.下列模型分别表示 、 、 的结构,下列说法不正确的是
A.32g 分子中含有1mol 键 B. 是由非极性键构成的分
子
C.1mol 分子中有3molσ键和2molπ键D. 分子中含非极性键
8.对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因是
A.氖原子获得电子后转变成发出红光的物质
B.在电流的作用下,氖原子与构成灯管的物质发生反应
C.电子由激发态向基态跃迁时以光的形式释放能量
D.电子由基态向激发态跃迁时吸收除红光以外的光线
9.氯的含氧酸根离子有 、 、 、 等,关于它们的说法不
正确的是
A. 的中心Cl原子采取 杂化 B. 的空间结构为三角锥形
C. 的空间结构为直线形 D. 中Cl原子的杂化类型与 相
同
10.键角影响分子的空间构型,下列物质中键角最小的是
A. B. C. D.
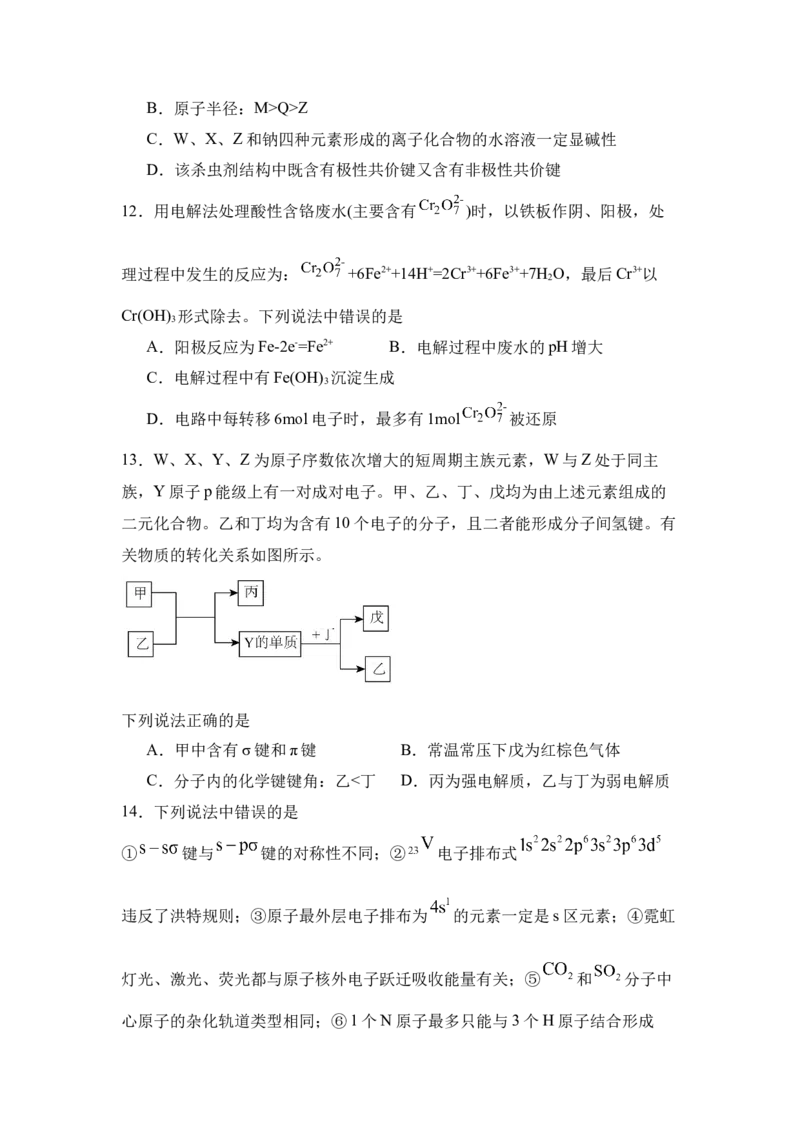
11.一种低毒杀虫剂的结构如图所示,其组成元素W、X、Y、Z、M、Q为原
子序数依次增大的短周期主族元素,其中W的原子核内只有1个质子,M原子
序数为Y原子最外层电子数的3倍。下列说法错误的是
A.简单氢化物沸点:Z>Y>QB.原子半径:M>Q>Z
C.W、X、Z和钠四种元素形成的离子化合物的水溶液一定显碱性
D.该杀虫剂结构中既含有极性共价键又含有非极性共价键
12.用电解法处理酸性含铬废水(主要含有 )时,以铁板作阴、阳极,处
理过程中发生的反应为: +6Fe2++14H+=2Cr3++6Fe3++7H O,最后Cr3+以
2
Cr(OH) 形式除去。下列说法中错误的是
3
A.阳极反应为Fe-2e-=Fe2+ B.电解过程中废水的pH增大
C.电解过程中有Fe(OH) 沉淀生成
3
D.电路中每转移6mol电子时,最多有1mol 被还原
13.W、X、Y、Z为原子序数依次增大的短周期主族元素,W与Z处于同主
族,Y原子p能级上有一对成对电子。甲、乙、丁、戊均为由上述元素组成的
二元化合物。乙和丁均为含有10个电子的分子,且二者能形成分子间氢键。有
关物质的转化关系如图所示。
下列说法正确的是
A.甲中含有σ键和π键 B.常温常压下戊为红棕色气体
C.分子内的化学键键角:乙<丁 D.丙为强电解质,乙与丁为弱电解质
14.下列说法中错误的是
① 键与 键的对称性不同;② 电子排布式
违反了洪特规则;③原子最外层电子排布为 的元素一定是s区元素;④霓虹
灯光、激光、荧光都与原子核外电子跃迁吸收能量有关;⑤ 和 分子中
心原子的杂化轨道类型相同;⑥1个N原子最多只能与3个H原子结合形成分子,是由共价键的饱和性决定的
A.3个 B.4个 C.5个 D.6个
二、填空题
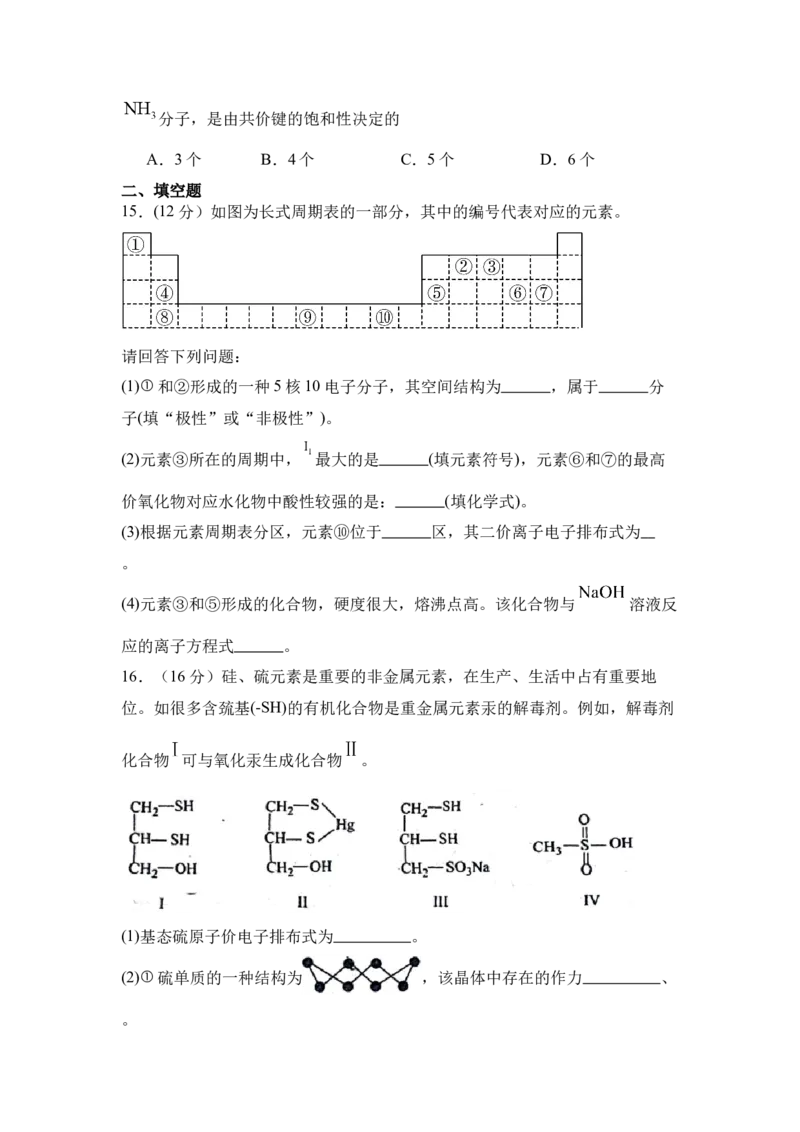
15.(12分)如图为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)①和②形成的一种5核10电子分子,其空间结构为 ,属于 分
子(填“极性”或“非极性”)。
(2)元素③所在的周期中, 最大的是 (填元素符号),元素⑥和⑦的最高
价氧化物对应水化物中酸性较强的是: (填化学式)。
(3)根据元素周期表分区,元素⑩位于 区,其二价离子电子排布式为
。
(4)元素③和⑤形成的化合物,硬度很大,熔沸点高。该化合物与 溶液反
应的离子方程式 。
16.(16分)硅、硫元素是重要的非金属元素,在生产、生活中占有重要地
位。如很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂
化合物 可与氧化汞生成化合物 。
(1)基态硫原子价电子排布式为 。
(2)①硫单质的一种结构为 ,该晶体中存在的作力 、
。② 、 、 键角由大到小的顺序是 (填离子符号)。
(3) 、 、 的沸点由高到低顺序为 。
(4) 分子的空间结构(以Si为中心)为 ,分子中氮原子的杂化
轨道类型是 。
(5)化合物 也是一种汞解毒剂。化合物 是一种强酸。下列说法正确的有
___________。
A.在 中S原子采取 杂化 B.在Ⅱ中S元素的电负性最大
C.在 中C-C-C键角是180° D.在Ⅲ中存在离子键与共价键
(6)化合物 的结构与甘油( )相似,但是甘油在水中的溶解度更大,其原
因可能是 。
17.(14分) 是一种二元弱酸。回答下列问题:
(1)写出 第二步电离方程式: 。
(2)常温下,加水稀释 溶液,下列物理量增大的是___________(填字母)。
A. B. C. D.
(3)常温下,向 溶液中缓缓通入 ,恰好完全反应
时停止通入 ,写出该反应的离子方程式: 。如果忽略体积变
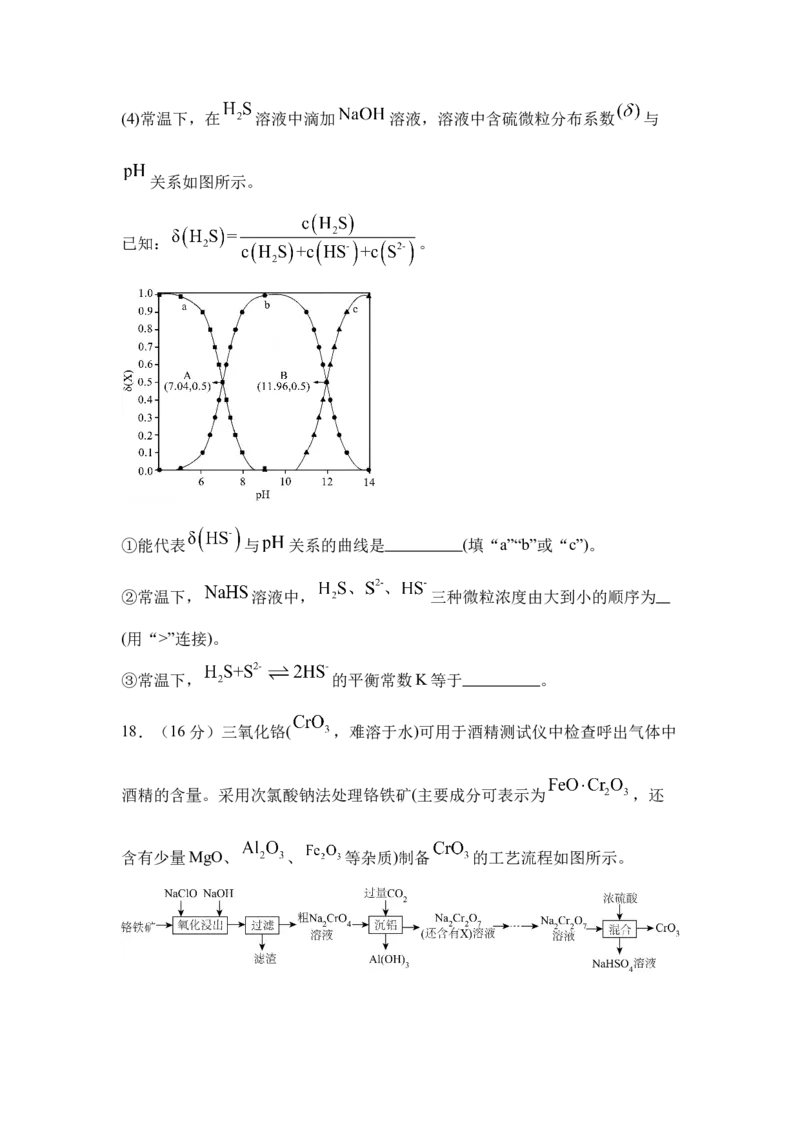
化,所得溶液 为 。(4)常温下,在 溶液中滴加 溶液,溶液中含硫微粒分布系数 与
关系如图所示。
已知: 。
①能代表 与 关系的曲线是 (填“a”“b”或“c”)。
②常温下, 溶液中, 三种微粒浓度由大到小的顺序为
(用“>”连接)。
③常温下, 的平衡常数K等于 。
18.(16分)三氧化铬( ,难溶于水)可用于酒精测试仪中检查呼出气体中
酒精的含量。采用次氯酸钠法处理铬铁矿(主要成分可表示为 ,还
含有少量MgO、 、 等杂质)制备 的工艺流程如图所示。已知:“氧化浸出”时铁元素仅以 形式存在。
回答下列问题:
(1)“氧化浸出”时加热的目的是 。
(2)“氧化浸出”时发生的主要反应的离子方程式为 。
(3)滤渣的主要成分是 (填化学式),实验室中过滤时所需的玻璃仪器
有 。
(4)写出 的电子式: ,X包括的物质主要为 (填化学
式)。
(5)在实验室中进行“混合”时的操作是 。
(6)写出“混合”时生成 的化学方程式: 。
化学参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 A A C D C D B C C B
题号 11 12 13 14
答案 C D C C
15.(1) 正四面体 非极性 (2) Ne HClO
4
(3) ds (4)
16.(1) (2) (非极性)共价键 范德华力
(3) (4) 四面体 (5)AD
(6)甘油中所含的羟基数目多,更易与水形成氢键,更易溶于水
17.(1) (2)B (3) 1
(4) b
18.(1)加快氧化浸出速率(2)
(3) MgO和Fe O 玻璃棒、烧杯和漏斗
2 3
(4) NaHCO 、NaCl
3
(5)将浓硫酸沿器壁慢慢倒入Na Cr O 溶液中,边加边搅拌
2 2 7
(6)