文档内容
2025 届高三期初学业质量监测试卷
化学
注意事项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,满分100分,考试时间为75分钟。考试结束后,请将答题卷交回。
2.答题前,请您务必将自己的姓名、准考证号、座位号用0.5毫米黑色字迹签字笔填写在答
题卷上。
3.请监考员认真核对在答题卡上所粘贴的条形码上的姓名、考试证号与你本人的是否相符。
4.作答选择题必须用2B铅笔把答题卡对应题目的答案标号涂黑。如需改动,请用橡皮擦干
净后,再选涂其它答案。作答非选择题必须用书写黑色字迹的0.5毫米的签字笔写在答题卷
上的指定位置,在其它位置作答一律无效。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 P 31 Fe 56 Zn 65
一、单项选择题:共13分,每题3分,共39分。每题只有一个选项最符合题意。
1.现代三大基本材料之一是高分子材料,下列物质的主要成分属于高分子的是( )
A.花生油 B.石墨烯 C.不锈钢 D.羊绒衫
2.三氟化氮常用于微电子工业,其制备原理: ,下列说法正确的是( )
A.中子数为8的氮原子: B. 的电子式为
C. 的VSEPR模型为三角锥 D. 为离子晶体
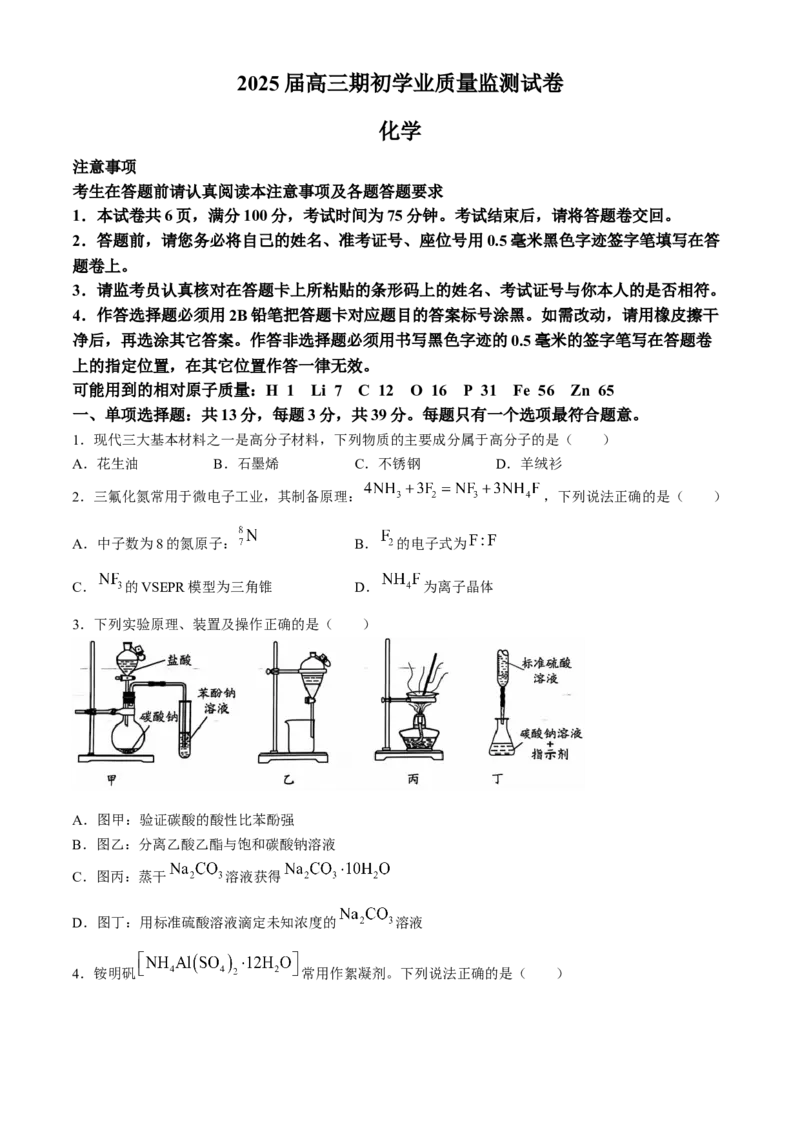
3.下列实验原理、装置及操作正确的是( )
A.图甲:验证碳酸的酸性比苯酚强
B.图乙:分离乙酸乙酯与饱和碳酸钠溶液
C.图丙:蒸干 溶液获得
D.图丁:用标准硫酸溶液滴定未知浓度的 溶液
4.铵明矾 常用作絮凝剂。下列说法正确的是( )A.离子半径: B.电负性:
C.第一电离能: D.沸点:
阅读下列材料,完成5~7题:
海洋是一个巨大的卤素资源宝库,从海水中能获得NaCl。工业常用电解饱和NaCl溶液制备 ,并
进一步制得 、 、HClO、NaClO、 、 、 等用途更广泛的化合物。黄
绿色气体 可用于自来水消毒,在稀硫酸溶液中用草酸 )还原 可制得 。
5.下列说法正确的是( )
A.1mol 分子中含有2mol 键
B. 和HClO均是由极性键构成的非极性分子
C.. 中 夹角小于 中
D.在NaCl晶胞中,每个 周围紧邻且距离相等的 构成正六面体结构
6.下列化学反应表示正确的是( )
A.电解饱和食盐水制备 的离子方程式:
B.将氯水在强光下照射的化学方程式:
C.在稀硫酸溶液中用草酸 还原 可制得 的离子方程式:
D.常温下 与NaOH溶液反应的离子方程式:
7.下列物质性质与用途具有对应关系的是( )
A. 能溶于水,可用于工业制盐酸
B.HCl具有还原性,可用于实验室制取氯气
C.NaClO具有强碱性,可用作漂白液
D. 气体呈黄绿色,可用作自来水消毒剂
8.硫及其化合物的转化具有重要的应用。下列说法正确的是( )A.
B.
C.硫化亚铁与稀硫酸混合:
D. 通入 溶液中:
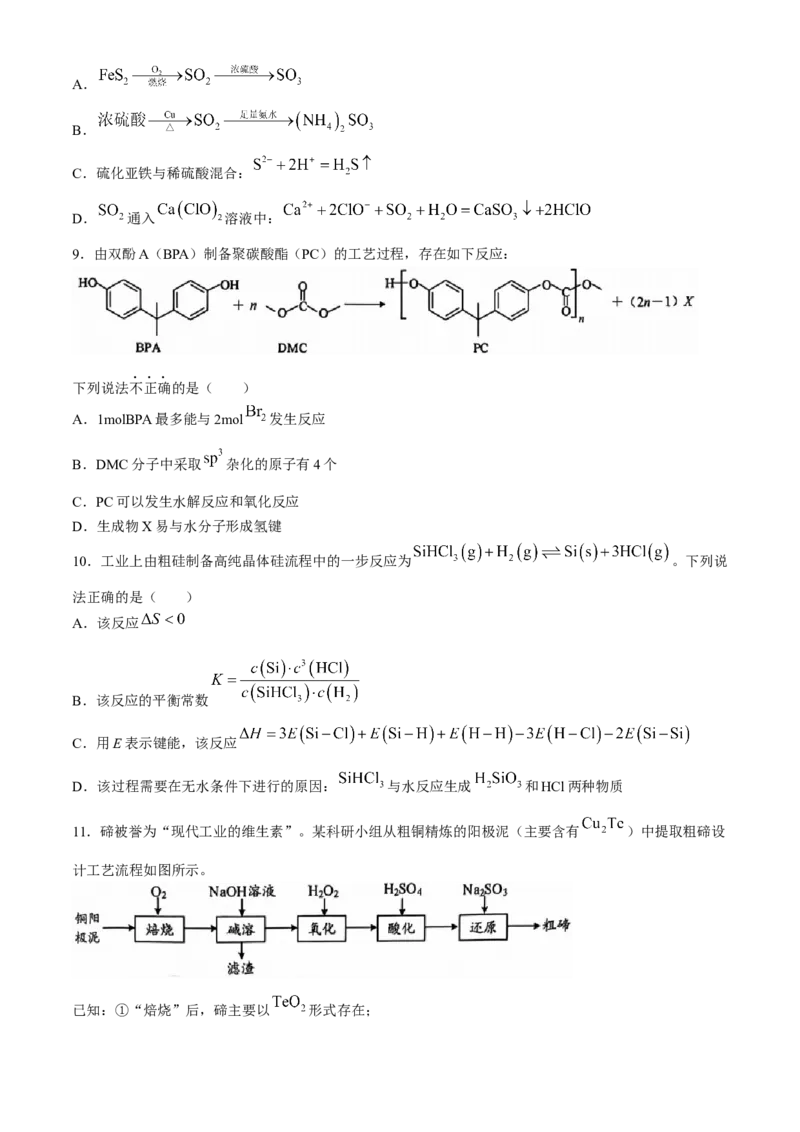
9.由双酚A(BPA)制备聚碳酸酯(PC)的工艺过程,存在如下反应:
下列说法不正确的是( )
A.1molBPA最多能与2mol 发生反应
B.DMC分子中采取 杂化的原子有4个
C.PC可以发生水解反应和氧化反应
D.生成物X易与水分子形成氢键
10.工业上由粗硅制备高纯晶体硅流程中的一步反应为 。下列说
法正确的是( )
A.该反应
B.该反应的平衡常数
C.用E表示键能,该反应
D.该过程需要在无水条件下进行的原因: 与水反应生成 和HCl两种物质
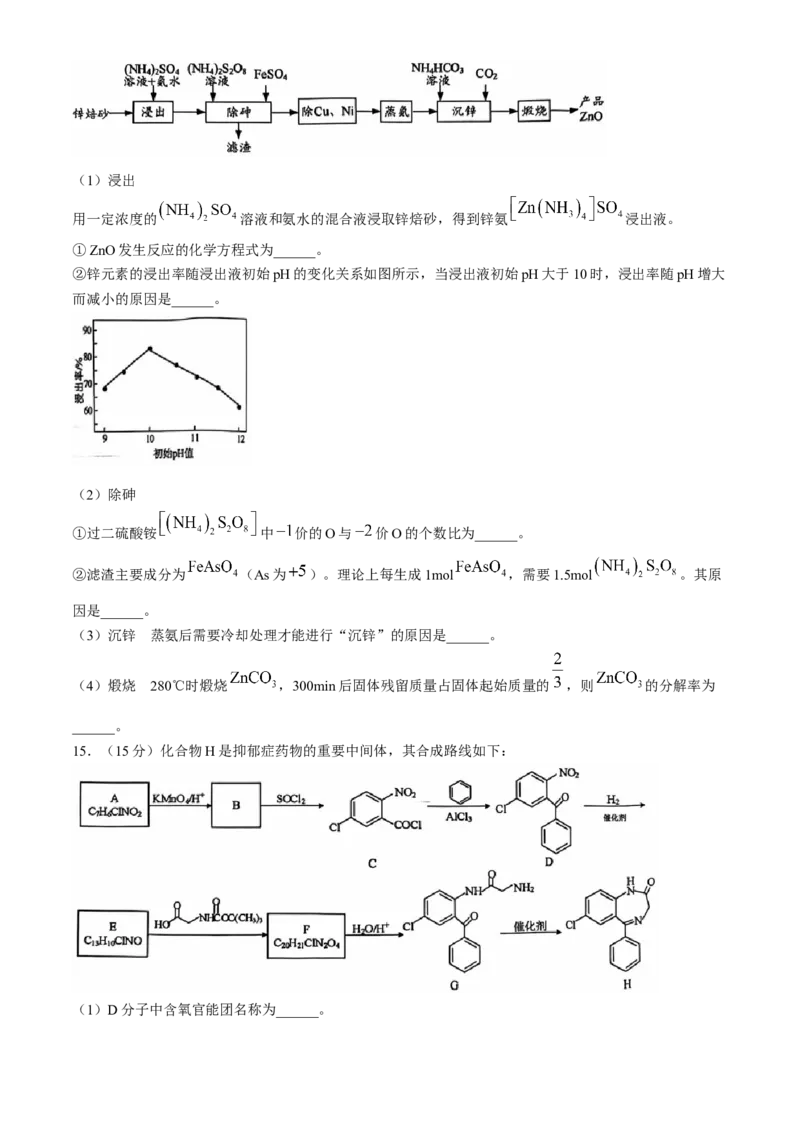
11.碲被誉为“现代工业的维生素”。某科研小组从粗铜精炼的阳极泥(主要含有 )中提取粗碲设
计工艺流程如图所示。
已知:①“焙烧”后,碲主要以 形式存在;② 微溶于水,易溶于强酸和强碱。
③ 的 ,氧化性比硫酸强。下列有关说法正确的是( )
A.“焙烧”使用的主要仪器有:蒸发皿、酒精灯、玻璃棒
B.“碱溶”后的滤渣中Ag和Au可用稀硝酸分离
C.“氧化”时氧化剂与还原剂的物质的量之比为
D.“还原”反应的离子方程式为
12.下列探究实验能达到目的的是( )
选项 实验目的 实验方法或操作
A 将样品溶解后加入HCl酸化的 溶液,观察是否产生白
样品是否变质
色沉淀
B 键的极性对羧酸酸性的影响
用pH计分别测定 溶液和 溶液的pH
C 是否具有还原性 向2mL 溶液中滴加2~3滴酸性 溶液,观察溶液颜
色变化
向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL2-
D 2-溴丁烷能否发生消去反应
溴丁烷,微热,将产生的气体通入 的 溶液,观察现象
13. 在磁性材料、电化学领域应用广泛,利用钴渣主要含( 、FeO)制备 的流程如
图所示。下列说法正确的是( )
A.“浸取”后的滤液中主要阳离子有: 、 、
B. 溶液中:
C.“沉钴”时将 换成 ,则制得的 纯度降低
D.“煅烧”时每生成1mol 反应转移2mol电子
二、非选择题:共4题,共61分。
14.(15分)高纯ZnO可用作电子元件材料。工业上利用锌焙砂(主要成分为ZnO,含有少量CuO、
、NiO等)生产高纯ZnO的流程示意图如下。(1)浸出
用一定浓度的 溶液和氨水的混合液浸取锌焙砂,得到锌氨 浸出液。
①ZnO发生反应的化学方程式为______。
②锌元素的浸出率随浸出液初始pH的变化关系如图所示,当浸出液初始pH大于10时,浸出率随pH增大
而减小的原因是______。
(2)除砷
①过二硫酸铵 中 价的O与 价O的个数比为______。
②滤渣主要成分为 (As为 )。理论上每生成1mol ,需要1.5mol 。其原
因是______。
(3)沉锌 蒸氨后需要冷却处理才能进行“沉锌”的原因是______。
(4)煅烧 280℃时煅烧 ,300min后固体残留质量占固体起始质量的 ,则 的分解率为
______。
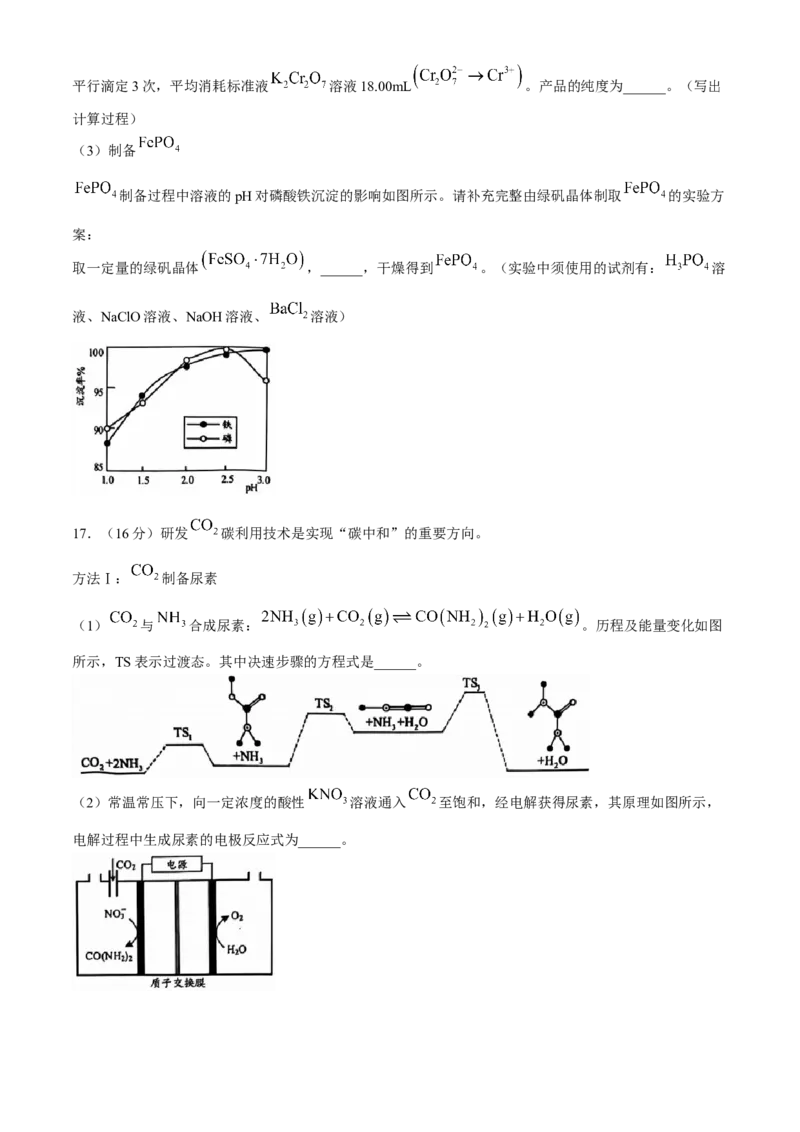
15.(15分)化合物H是抑郁症药物的重要中间体,其合成路线如下:
(1)D分子中含氧官能团名称为______。(2)E的结构简式为______。
(3)G→H中经历 的过程,写出X的结构简式为______。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:______。
ⅰ.分子中含有2个苯环;
ⅱ.每个苯环上只含有一种官能团,核磁共振氢谱有5个峰。
(5)补全以 和苯为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,
合成路线流程图示例见本题题干)。
______。
16.(15分) 可用于制备电动汽车电池的正极材料 。
已知: 、 难溶于水和碱,可溶于酸。
(1)制备
①以 、 、单质碳为原料在高温下制备 ,该反应只生成一种气体,该气体具有可燃
性,其反应方程式为______。
②检验产品中是否混有 杂质的方法是______。
③ 的晶胞结构示意图如图甲所示(“·”为 ,位置分别在顶角、棱中心和面心,正八面体和
正四面体由O围绕Fe和P形成,它们通过共顶点、共棱形成空间链结构)。电池充电时, 脱出
,形成 ,结构示意图如图乙所示, ______。
(2)测定 纯度
准确称取18.000g产品,用稀硫酸溶解,将所得溶液定容至250mL,然后取出25.00mL溶液放入锥形瓶中,
滴加3滴二胺磺酸钠指示剂,用0.1000mol/L 标准溶液滴定至溶液由浅绿变为蓝紫稳定半分钟,平行滴定3次,平均消耗标准液 溶液18.00mL 。产品的纯度为______。(写出
计算过程)
(3)制备
制备过程中溶液的pH对磷酸铁沉淀的影响如图所示。请补充完整由绿矾晶体制取 的实验方
案:
取一定量的绿矾晶体 ,______,干燥得到 。(实验中须使用的试剂有: 溶
液、NaClO溶液、NaOH溶液、 溶液)
17.(16分)研发 碳利用技术是实现“碳中和”的重要方向。
方法Ⅰ: 制备尿素
(1) 与 合成尿素: 。历程及能量变化如图
所示,TS表示过渡态。其中决速步骤的方程式是______。
(2)常温常压下,向一定浓度的酸性 溶液通入 至饱和,经电解获得尿素,其原理如图所示,
电解过程中生成尿素的电极反应式为______。方法Ⅱ: 催化加氢
(3)Fe、Co固体双催化剂的成分对相同时间内 转化率和产物选择性有重要作用,部分研究数据如下
表所示。
实验 CO选择 反应后固体的
转化 选择 选择
编号
率/%
性/%
性/% 性/%
成分
Fe和少量
1 1.1 100 0 0
2 30.5 36.8 42.9 20.3 Fe和Co
3 69.2 2.7 97.1 0.2 Co
①写出实验1中Fe与 反应的化学方程式:______。
②判断制备 的最佳催化剂并说明理由:______。
③从化合价角度分析,反应产物中______优先产生(填“ ”或“ ”)。
(4)某研究小组使用 双功能催化剂实现了 合成低碳烯烃,并给出了其可能
的反应历程(如图所示)。 首先在 表面解离成2个 ,随后参与到 的还原过程;
则催化生成的甲醇转化为低碳烯烃。
注:□表示氧原子空位,*表示吸附在催化剂上的微粒。
①画出中间体Ⅹ结构:______。
②若原料气中 比例过低、过高均会减弱催化剂活性,其可能原因是______。