文档内容
2024~2025 学年第一学期高三年级期初学情调研测试
化学试题
2024.9
(考试时间:75分钟满分: 100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Co-59
单项选择题:本题包括10小题,每小题 3分,共计30分。每小题只有一个选项符合题意。
1.我国提出2030年碳达峰、2060年碳中和的目标。下列关于CO₂的说法不
.
正
.
确
.
是
A. CO₂固态易升华 B. CO₂是酸性氧化物
C. CO₂属于非电解质 D. CO₂为极性分子
2. 检验微量砷的原理为 常温
下为无色气体。下列说法正确的是
₃ +12 ₃ +3₂ = ₂ ₃ ↓+12 ₃ +12 ↓∘ ₃
A. 基态O原子的轨道表示式为: B.NO₃的空间构型为平面三角形
C. 固态AsH₃属于共价晶体 D. HNO₃既含离子键又含共价键
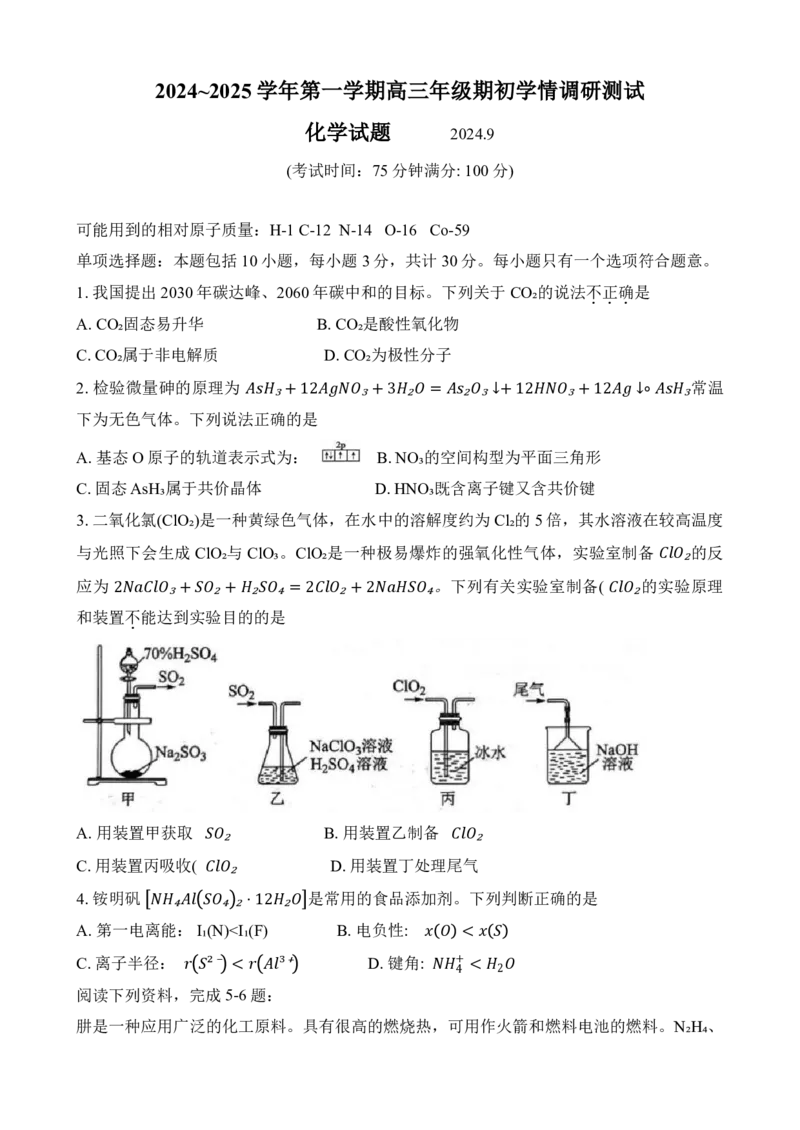
3.二氧化氯(ClO₂)是一种黄绿色气体,在水中的溶解度约为 Cl₂的5倍,其水溶液在较高温度
与光照下会生成 ClO₂与 ClO₃。ClO₂是一种极易爆炸的强氧化性气体,实验室制备 的反
应为 。下列有关实验室制备( 的实 ₂ 验原理
和装置不能达到实验目的的是
2 . ₃ + ₂ +₂ ₄ = 2 ₂ +2 ₄ ₂
A. 用装置甲获取 B. 用装置乙制备
C. 用装置丙吸收( ₂ D. 用装置丁处理尾 气 ₂
4.铵明矾
₂
是常用的食品添加剂。下列判断正确的是
A. 第一电离 能 ₄ : I₁ (₄ N₂) + 正 向 进 3 行,+需 满 2 足 3
2−
2− 2− 4 8 6
C. “脱硫 ” 后 上 4 层+清 液 3 中⇌: 3 + 4 3 2− > 37×10
)
2 2− − − + + 2
D2. 加 热 3Pb+(N2O ₃ )₂ 溶4液能 + 得 到 1 3Pb(+NO ₃ )₂ 固体 = + +2 (
13.甲醇-水催化重整可获得H₂.其主要反应为:
反应I
反应Ⅱ
₃ +₂ = ₂ +3₂ △ = 49.4 ⋅ ⁻
在 ₂ +、₂ = +₂ △ 时= 4,1若.2 仅 ⋅考 虑 ⁻ 上¹述反应,平衡时 CO 的选择
始 始
性、1.C0H×₃O1⁵0H 的 转化 率₂ 和 H₂:的 产率 ₃ 随 温 度=的6变;5化如图所示。
提示:
下列说法正确的是
A. 一定温度下,增大 可提高CO的选择性
2
B. 平衡时CH₃OH的转 化 率3 与 H₂O的转化率相等
C. 图中曲线 表示平衡时H₂产率随温度的变化
D. 一定温度 ② 下,降低体系压强,反应 I 的平衡常
数不变
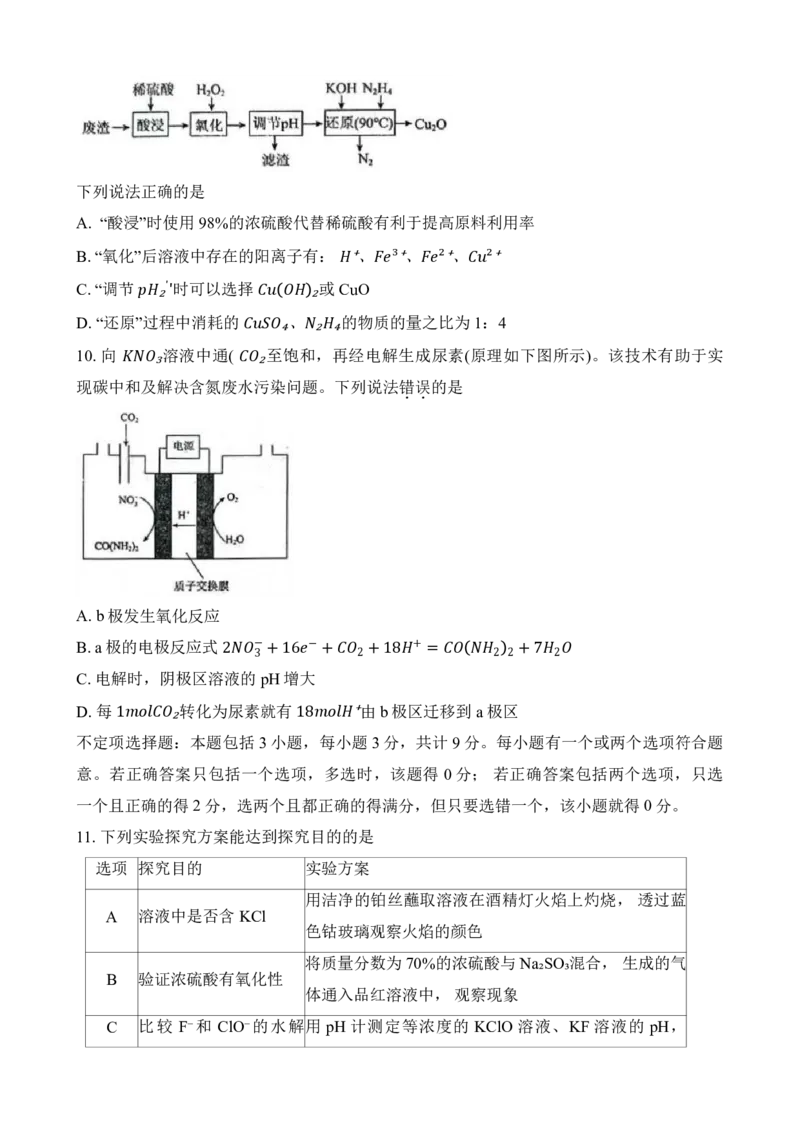
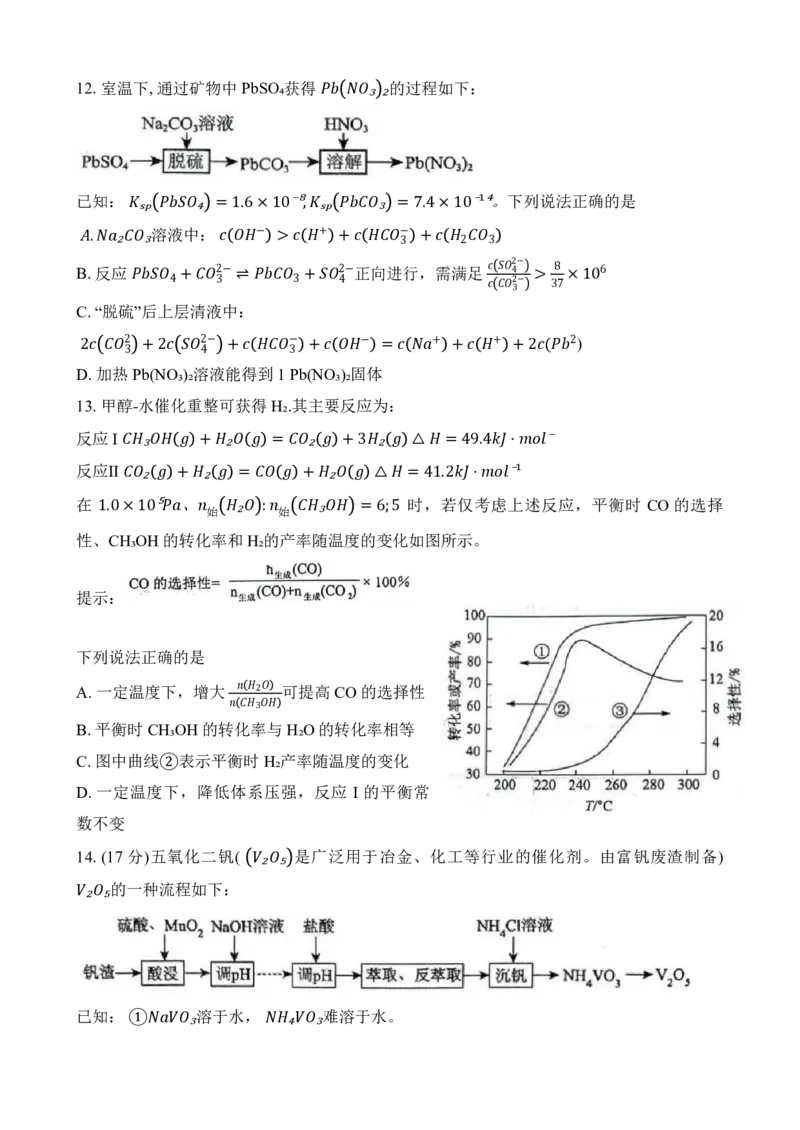
14. (17 分)五氧化二钒( 是广泛用于冶金、化工等行业的催化剂。由富钒废渣制备)
的一种流程如下:
₂ ₅
₂ ₅
已知: 溶于水, 难溶于水。
① ₃ ₄ ₃ 部分含钒(五价)物质在水溶液中的主要存在形式:
② pH <1.0 1.0~4.0 4.0~6.0 6.0~8.5 8.5~13.0 >13.0
主要存在形式 V₂O₅ 多钒酸根 多钒酸根
+ − 3−
2 3 4
备注 多钒酸盐在水中溶解度较小
(1)写出基态V原子的价层电子排布式 ▲ 。
(2)“酸浸”时, 将VO⁺转化为 的离子反应方程式为▲ 。
+
(3)通过“调pH
、
₂
萃取、反萃取”等
过
程2 ,可制得1 溶液。
已知 能被有机萃取剂(简称ROH)萃取,其萃取
原
理
₃
可表示为:
−
( 水 层3 )+ROH(有机层) RVO₃(有机层)+OH⁻(水层)。
−
反
萃3 取中, 反萃取率随
⇌
着pH的升高呈现先增大后减小的趋势,其原因是▲ 。
−
(4)“沉钒”时,
向
3pH为 8的 溶液中加入过量的 溶液,析出 沉淀。加入
过量的NH₄Cl溶液的目的是 ▲ ₃ 。 ₄ ₄ ₃
在空气中灼烧得 V₂O₅。写出该反应的化学方程式
▲5 。 ₄ ₃
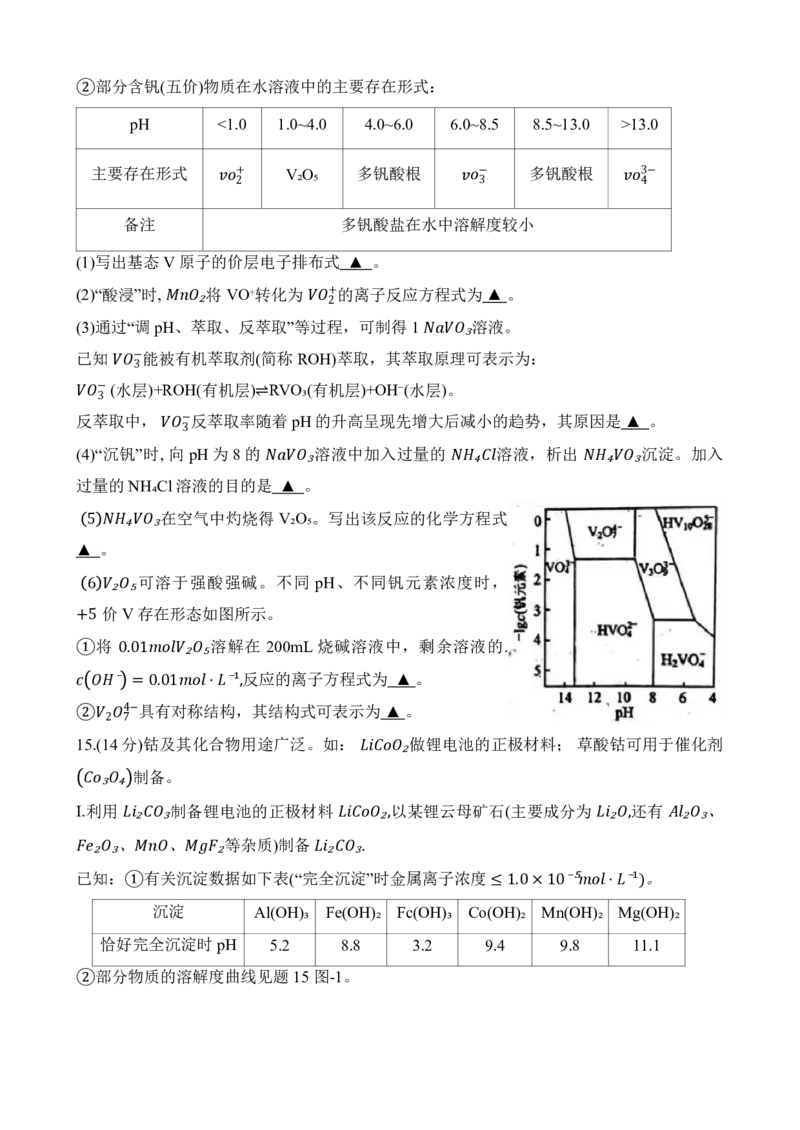
可溶于强酸强碱。不同 pH、不同钒元素浓度时,
6₂
价
₅
V存在形态如图所示。
+5 将 溶解在 200mL 烧碱溶液中,剩余溶液的.
① 0.01 ₂ ₅ 反应的离子方程式为 ▲ 。
⁻ =
具
0
有
.01
对
称
结
⋅⁻
构
¹
,
,
其结构式可表示为▲ 。
4−
②15. (124 分7 )钴及其化合物用途广泛。如: 做锂电池的正极材料; 草酸钴可用于催化剂
制备。
₂
Ⅰ. 利₃ 用₄ 制备锂电池的正极材料 以某锂云母矿石(主要成分为 还有 、
、 ₂ ₃ 、 等杂质)制备 ₂ , ₂ , ₂ ₃
已₂ 知₃ : 有 关沉 淀 ₂ 数据如下表(“完 ₂全 沉 ₃ 淀.”时金属离子浓度 。
① 沉淀 Al(OH)₃ Fe(OH)₂ Fc(OH)₃ Co(≤OH1).0₂ ×M1⁻0n⁵(O H )₂ ⋅⁻ M¹g)(OH)₂
恰好完全沉淀时pH 5.2 8.8 3.2 9.4 9.8 11.1
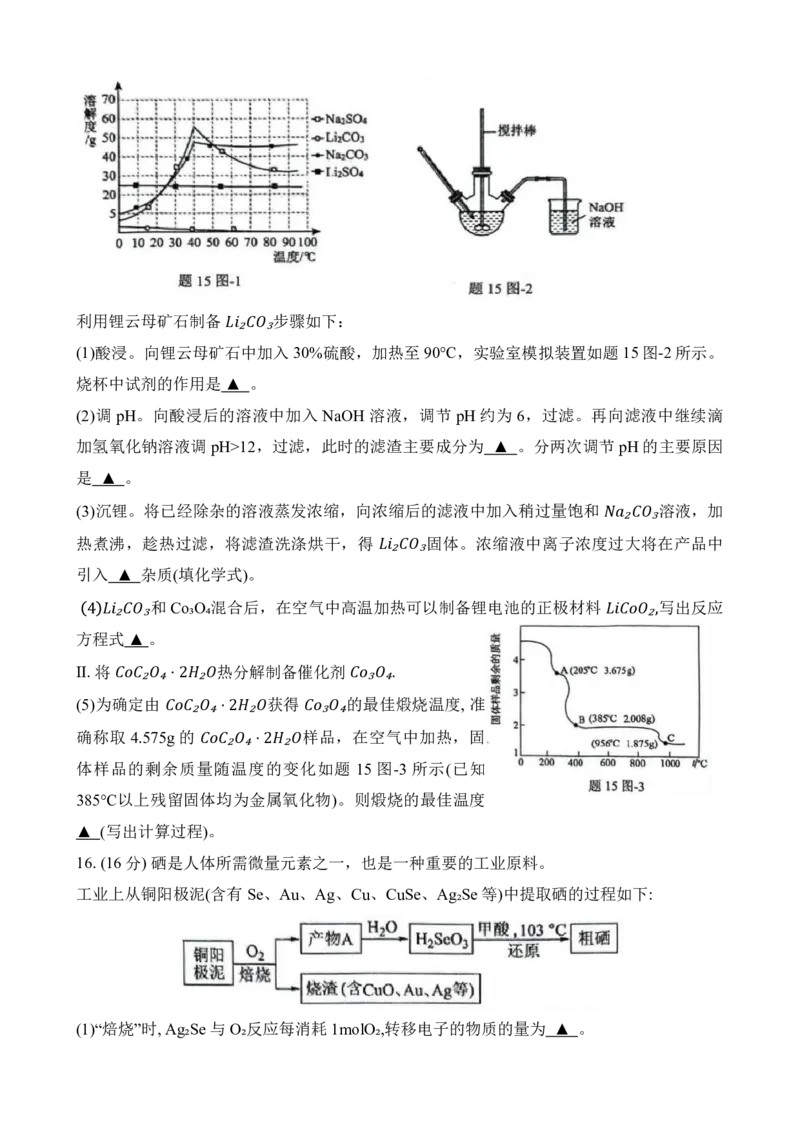
部分物质的溶解度曲线见题15图-1。
②利用锂云母矿石制备 步骤如下:
(1)酸浸。向锂云母矿石
₂
中
₃
加入 30%硫酸,加热至 90℃,实验室模拟装置如题 15图-2所示。
烧杯中试剂的作用是▲ 。
(2)调 pH。向酸浸后的溶液中加入 NaOH 溶液,调节 pH约为 6,过滤。再向滤液中继续滴
加氢氧化钠溶液调 pH>12,过滤,此时的滤渣主要成分为 ▲ 。分两次调节 pH的主要原因
是 ▲ 。
(3)沉锂。将已经除杂的溶液蒸发浓缩,向浓缩后的滤液中加入稍过量饱和 溶液,加
热煮沸,趁热过滤,将滤渣洗涤烘干,得 固体。浓缩液中离子浓度过大将在产品中
₂ ₃
引入 ▲ 杂质(填化学式)。 ₂ ₃
和Co₃O₄混合后,在空气中高温加热可以制备锂电池的正极材料 写出反应
方 4 程 ₂ 式 ▲₃ 。 ₂ ,
Ⅱ.将 热分解制备催化剂
(5)为确
定
₂
由
₄ ⋅2₂
获得 的
₃
最
₄
佳
.
煅烧温度, 准
确称取 4.575 g 的 ₂ ₄ ⋅2₂ 样 ₃ 品 ₄ ,在空气中加热,固
体样品的剩余质量 随 ₂ 温 ₄ 度 ⋅2 的 ₂ 变 化如题 15 图-3 所示(已知
385℃以上残留固体均为金属氧化物)。则煅烧的最佳温度
▲ (写出计算过程)。
16.(16分)硒是人体所需微量元素之一,也是一种重要的工业原料。
工业上从铜阳极泥(含有Se、Au、Ag、Cu、CuSe、Ag₂Se等)中提取硒的过程如下:
(1)“焙烧”时,Ag₂Se与O₂反应每消耗1molO₂,转移电子的物质的量为 ▲ 。(2)甲酸还原H₂ScO₃反应的化学方程式为 ▲ 。
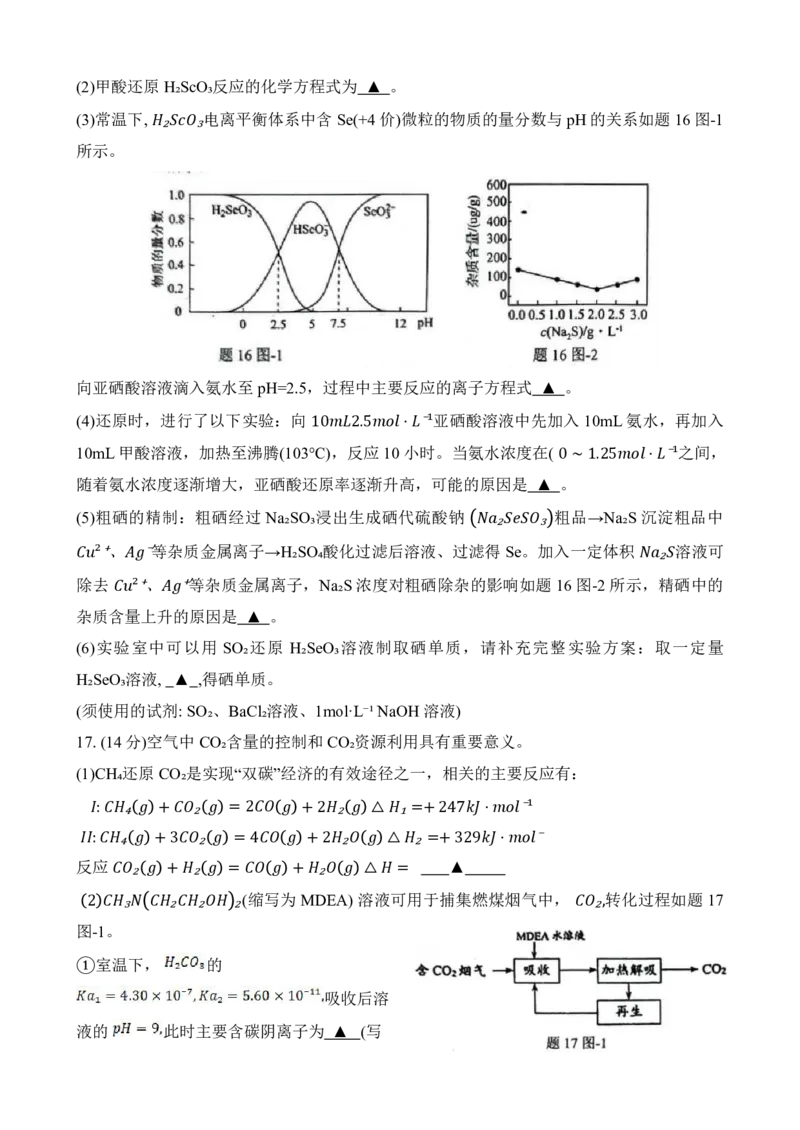
(3)常温下, 电离平衡体系中含 Se(+4 价)微粒的物质的量分数与pH的关系如题 16图-1
所示。
₂ ₃
向亚硒酸溶液滴入氨水至pH=2.5,过程中主要反应的离子方程式 ▲ 。
(4)还原时,进行了以下实验:向 亚硒酸溶液中先加入 10mL氨水,再加入
10mL甲酸溶液,加热至沸腾(103℃10) , 反 2. 应 5 1 0 ⋅ 小 ⁻ 时 ¹ 。当氨水浓度在( 之间,
随着氨水浓度逐渐增大,亚硒酸还原率逐渐升高,可能的原因是 ▲ 0 。 ∼ 1.25 ⋅⁻ ¹
(5)粗硒的精制:粗硒经过 Na₂SO₃浸出生成硒代硫酸钠 粗品→Na₂S 沉淀粗品中
、 等杂质金属离子→H₂SO₄酸化过滤后溶液、过滤 得₂ S e 。₃ 加入一定体积 溶液可
除 ⁺去² ⁻ 、 等杂质金属离子,Na₂S浓度对粗硒除杂的影响如题 16图-2所示 ,₂ 精 硒中的
杂质含 量 ⁺² 上升 ⁺ 的原因是 ▲ 。
(6)实验室中可以用 SO₂还原 H₂SeO₃溶液制取硒单质,请补充完整实验方案:取一定量
H₂SeO₃溶液, ▲ ,得硒单质。
(须使用的试剂: SO₂、BaCl₂溶液、1mol·L⁻¹NaOH溶液)
17.(14分)空气中 CO₂含量的控制和CO₂资源利用具有重要意义。
(1)CH₄还原CO₂是实现“双碳”经济的有效途径之一,相关的主要反应有:
: ₄ + ₂ = 2 +2₂ △₁ =+247 ⋅ ⁻ ¹
反应 ▲
: ₄ +3 ₂ = 4 +2₂ △₂ =+329 ⋅ ⁻
₂ +₂ =( 缩 写 为 +M₂ D EA ) 溶 △ 液 可 = 用于捕集燃煤烟气中, 转化过程如题 17
图 2-1 。 ₃ ₂ ₂ ₂ ₂ ,
室温下, 的
吸收后溶
①
液的 此时主要含碳阴离子为 ▲ (写离子符号)。
从结构的角度解释MDEA水溶液能吸收CO₂的理由是 ▲ 。
②(3)利用高炉炼铁尾气中的 制取有机物的过程如题17图-2。
相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电
解电压的变化题17图-3所示:
“电解”在质子交换膜电解池中进行,生成HCOOH的电极反应式为 ▲ ,当电解电压为
U₁时,生成(
C₂H₅OH和HCOOH的选择性之比为▲ 。
(4)二氧化碳加氢制甲烷是碳循环的重要应用。
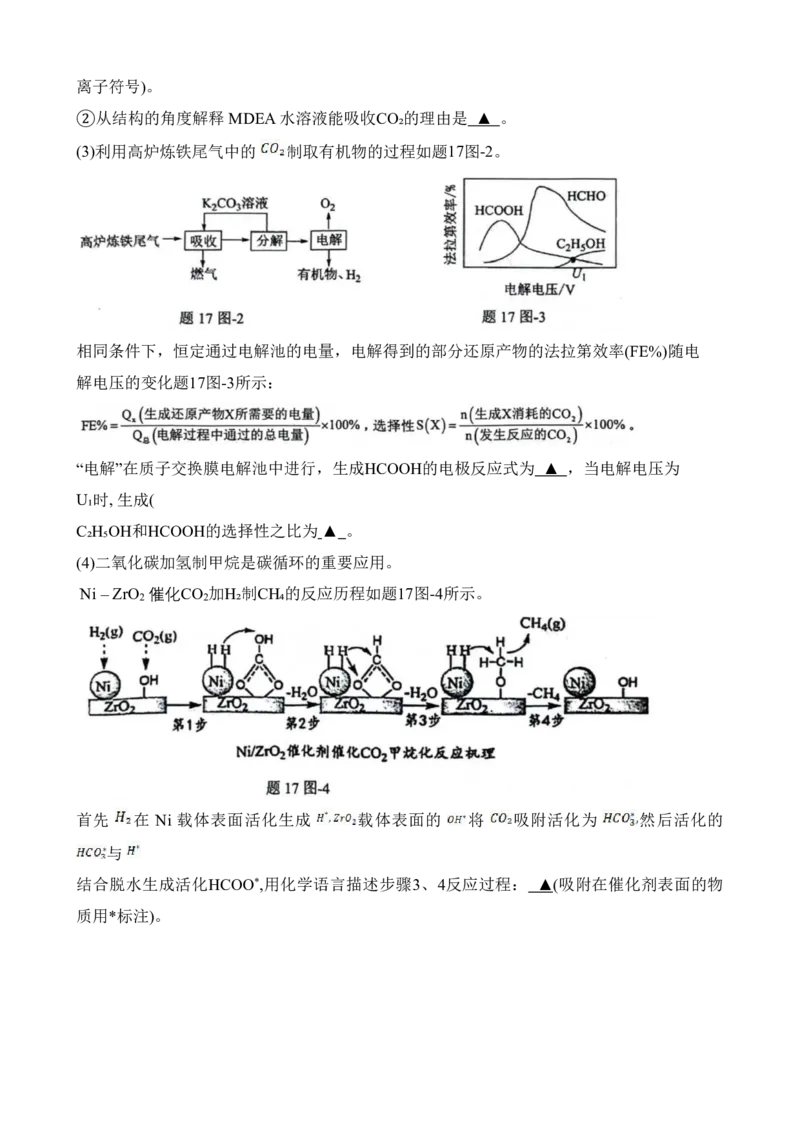
Ni –ZrO 催化CO 加H₂制CH₄的反应历程如题17图-4所示。
2 2
首先 在 Ni 载体表面活化生成 载体表面的 将 吸附活化为 然后活化的
与
结合脱水生成活化HCOO*,用化学语言描述步骤3、4反应过程: ▲(吸附在催化剂表面的物
质用*标注)。2024~2025 学年第一学期高三年级期初学情调研测试
化学参考答案
14.(17分,除特别说明,其余每空2分)
(1)3d34s2
(2)VO++MnO +2H+=
2
学科网(北京)股份有限公司
V O +2 +Mn2++H O(3分)
2
(3) pH升高,c(OH-)增大,有利于反应向反萃取方向进行, V O -3 的反萃取率增大;但c(OH-)过大,
+5价钒主要以 V O 3 -4 或多钒酸根的形式存在,VO-的反萃取率减小(3分)
3
(4)促进NH VO 充分沉淀
4 3
(5) 2 N H
4
V O
3
焙 烧
V
2
O
5
+ 2 N H
3
+ H
2
O
(6) V O +4OH-=V O4-+2H O (3分)
2 5 2 7 2
(双键写成配位键正确)
15,(14分,除特别说明,其余每空2分)
(1)吸收HF,防止污染空气
(2) Mg(OH) 、Mn(OH) 防止铝元素转化为
2 2
A lO −2 ,无法去除
(3)Na SO
2 4
高温
(4)6Li CO +4Co O +O 12LiCoO +6CO (3分)
2 3 3 4 2 2 2
(5)385℃
4.575g
n(CoC O ·2H O)= =0.025mol
2 4 2
183g/mol
O
O
V
O
O
O
V
O
O
4 -
1 2 3 4 5 6 7 8 9 10 11 12 13
D B B A B D A B C D C AC CD
{#{QQABIYIEogCIQJAAABhCUwG4CgGQkBEAAYgOABAIMAAAAANABAA=}#}根据Co原子守恒:n(Co O )=
3 4
学科网(北京)股份有限公司
0 .0
3
2 5
mol
则m(Co O )=
3 4 0 .0
3
2 5
×241≈2.008g,则最佳温度为385℃(3分)
16.(16分,除特别说明,其余每空2分)
(1)6mol (2)H SeO +2HCOOH
2 3
1 0 3 ℃
Se+2CO ↑+3H O (3分)
2 2
(3)H SeO +NH ·H O=NH++HSeO
2 3 3 2 4
−3 +H O (3分)
2
(4)在实验条件下,HSeO −3 比H SeO 更容易被甲酸还原,随着氨水浓度逐渐增大,溶液中HSeO
2 3
−3 -
浓度逐渐增大
(5)加硫酸时,硫离子与亚硫酸根反应成硫单质
(6)在不断搅拌下,向H SeO 溶液中缓缓通入SO 气体至不再产生沉淀为止,同时用 2 3 2 1 m o l L − 1
NaOH溶液吸收多余的尾气,静置过滤洗涤,直至取最后一次洗涤滤液,加入BaCl 溶液无沉淀生
2
成,干燥(4分)
17.(14分,除特别说明,其余每空2分)
(1)+41kJmol−1
(2)① H C O −3
② C H
3
N ( C H
2
C H
2
O H )
2
中氮原子含有孤电子对,能与氢离子形成配位键,促进CO 的吸收(或答
2
道 M D E A 为胺,有碱性能与CO 反应也给分)。
2
(3) CO +2e—+2H+=HCOOH (3分) 1:3
2
(4) 活化的HCOO与 H 结合,脱去水分子生成CH O,CH O再进一步结合
3 3
H 生成 C H
4
和 O H
(3分)
{#{QQABIYIEogCIQJAAABhCUwG4CgGQkBEAAYgOABAIMAAAAANABAA=}#}