文档内容
2015年四川省泸州市中考化学试卷
参考答案与试题解析
一、选择题(每小题3分,共24分,在每小题给出的4个选项中只有一个选项是符合题目要
求)
1.(3分)(2015•泸州)下列变化中属于化学变化的是( )
A.金块抽成金线 B.干冰升华 C.可燃冰燃烧 D.蔗糖溶解于水
考点:化学变化和物理变化的判别.
专题:物质的变化与性质.
分析:化学变化过程中有新物质生成,物理变化过程中没有新物质生成,是否生成新物质是
判断化学变化的依据.
解答:解:A、金块抽成金线的过程中,只是金的形状发生改变,没有生成新物质,属于物理变
化;
B、干冰升华过程中,只是二氧化碳由固体变成气体,没有生成新物质,属于物理变化;
C、可燃冰燃烧过程中,生成水和二氧化碳等物质,属于化学变化;
D、蔗糖溶解于水的过程中,只是蔗糖和水混合形成混合物,没有生成新物质,属于物
理变化.
故选:C.
点评:判断变化是否属于化学变化的唯一标准是:是否有新物质生成,如果有新物质生成,就
是化学变化,如果没有新物质生成,就不是化学变化.
2.(3分)(2015•泸州)化学上常对物质进行分类和研究,以下物质中属于酸的是( )
A.HNO B.MgO C.O D.NaCl
3 2
考点:常见的氧化物、酸、碱和盐的判别.
专题:物质的分类.
分析:根据酸是指在电离时产生的阳离子全部是氢离子的化合物;盐是由金属离子(或铵根
离子)和酸根离子组成的化合物;氧化物是指由两种元素组成且一种是氧元素的化合
物;据此进行分析解答.
解答:解:A、HNO 是电离时产生的阳离子全部是氢离子的化合物,属于酸,故选项正确.
3
B、MgO是由镁元素和氧元素组成的化合物,属于氧化物,故选项错误.
C、O 是由氧元素一种元素组成的纯净物,属于单质,故选项错误.
2
D、NaCl是由钠离子和氯离子组成的化合物,属于盐,故选项错误.
故选:A.
点评:本题难度不大,考查物质类别的判别,抓住酸、碱、盐等的特征、熟悉常见的物质的组
成是正确解答本题的关键.
3.(3分)(2015•泸州)下列对环境保护和人体健康没有价值的是( )
A.将垃圾分类回收利用
B.将工厂废液直接排入江河
C.远离烟草、拒绝毒品
D.改进燃煤技术,减少SO 与粉尘排放
2
考点:水资源的污染与防治;酸雨的产生、危害及防治;有机高分子材料的分类及鉴别;毒品
的危害性及预防.
专题:化学与环境保护.
分析:有利于环境保护就是对环境无污染,不能污染空气,不能污染水体,不能造成白色污染
等方面.
解答:解:A、分类回收垃圾可以减少对环境的污染,节省资源,故A正确;
B、将工厂废液直接排入江河能严重污染水体,不利于环境保护,故B错误;
C、远离烟草、拒绝毒品,有利于环境保护,故C正确;
1D、改进燃煤技术,减少SO 与粉尘排放,有利于环境保护,故D正确.
2
故选:B.
点评:通过回答本题知道了哪些做法有利于环境保护,我们应该如何去做,要知道垃圾的一
般处理方法,不要乱扔垃圾,要进行集中处理,要考虑废物的回收再利用,节约资源.
4.(3分)(2015•泸州)在KCrO 中,Cr元素的化合价是( )
2 2 7
A.+1价 B.+3价 C.+4价 D.+6价
考点:有关元素化合价的计算.
专题:化学式的计算.
分析:根据在化合物中正负化合价代数和为零,结合KCrO 的化学式进行解答即可.
2 2 7
解答:解:钾元素显+1价,氧元素显﹣2价,设铬元素的化合价是x,根据在化合物中正负化
合价代数和为零,可得:(+1)×2+2x+(﹣2)×7=0,则x=+6价.
故选:D.
点评:本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元
素的化合价的方法即可正确解答此类题.
5.(3分)(2015•泸州)下列说法正确的是( )
A.向酸性土壤里撒熟石灰,可调节土壤的pH
B.推广加碘盐是为了预防胃酸过多
C.钢铁在干燥的环境中比在潮湿的环境中更容易被腐蚀
D.玻璃钢、光导纤维和合成纤维都是有机合成材料
考点:中和反应及其应用;金属锈蚀的条件及其防护;合成材料的使用及其对人和环境的影
响;微量元素、维生素与健康的关系及摄取方法.
专题:金属与金属材料;常见的酸 酸的通性;化学与生活.
分析:A、根据熟石灰是碱性物质,可改良酸性土壤分析;
B、根据碘元素的作用分析;
C、根据铁生锈的条件分析;
D、根据常见的材料及典型的物质代表分析.
解答:解:A、熟石灰是碱性物质,可改良酸性土壤,改变土壤的pH,故说法正确;
B、碘元素可以预防甲状腺肿大,故说法错误;
C、钢铁生锈的条件是氧气和水并存,因此在潮湿的环境更容易生锈,故说法错误;
D、玻璃钢是复合材料,光导纤维是无机非金属材料,故说法错误;
故选项为:A.
点评:本题考查了化学成绩的基础知识,难度不大,依据相关的知识分析即可.
6.(3分)(2015•泸州)下列化学方程式书写正确的是( )
A.NaOH+HSO=NaSO+HO B.Fe+2NaCl=2Na+FeCl
2 4 2 4 2 2
C.6HCl+FeO=3HO+2FeCl D.3KCl+Al(NO)=AlCl+3KNO
2 3 2 3 3 3 3 3
考点:书写化学方程式、文字表达式、电离方程式.
专题:化学用语和质量守恒定律.
分析:氢氧化钠和稀硫酸反应生成硫酸钠和水;
铁不能和氯化钠反应;
稀盐酸和氧化铁反应生成氯化铁和水;
氯化钾和硝酸铝不能反应.
解答:解:A、氢氧化钠和稀硫酸反应的化学方程式为:2NaOH+HSO=NaSO+2HO,该选项书写
2 4 2 4 2
不正确;
B、铁和氯化钠不能反应,该选项书写不正确;
C、稀盐酸和氧化铁反应的化学方程式为:6HCl+FeO=3HO+2FeCl,该选项书写正确;
2 3 2 3
D、氯化钾和硝酸铝不能反应,该选项书写不正确.
故选:C.
点评:书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量
守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.
27.(3分)(2015•泸州)下列实验操作、现象、结论或解释不正确的一组是( )
组别 操作 现象 结论或解释
A 切开土豆,在剖面上滴两滴碘水 变蓝 土豆含有淀粉
B 在1mL无色溶液中滴加石蕊试液 溶液变红 原溶液呈碱性
C 取3mLHO 溶液微热,再向该溶液中先产生少量气泡,加MnO 后产MnO 对HO 分解有
2 2 2 2 2 2
加入少量MnO 生大量气泡 催化作用
2
D 取2mL鸡蛋清,加入几滴硫酸铜溶液鸡蛋清凝结 硫酸铜能使蛋白质
变性
A.A B.B C.C D.D
考点:化学实验方案设计与评价;催化剂的特点与催化作用;酸碱指示剂及其性质;鉴别淀
粉、葡萄糖的方法与蛋白质的性质.
专题:简单实验方案的设计与评价.
分析:A、根据淀粉遇碘变成蓝色分析;
B、根据酸性溶液能使石蕊试液变成红色分析;
C、根据二氧化锰能够加快过氧化氢的分解分析;
D、根据重金属离子能够使蛋白质变性分析.
解答:解:A、淀粉遇碘变蓝色,因此切开土豆,在剖面上滴两滴碘水,变蓝,说明土豆含有淀
粉,故实验正确;
B、酸性溶液能使石蕊试液变成红色,因此石蕊试液变成红色,说明原溶液呈酸性,而
不是呈碱性,故说法错误;
C、二氧化锰能够加快过氧化氢的分解,是催化剂,因此该说法正确;
D、硫酸铜中含有重金属离子铜离子,能够使蛋白质变性,故说法正确;
故选项为:B.
点评:本题考查了对实验方案、实验现象及实验结论的评价,考查的知识点较多,难度不大,
注意语言表达的准确性,能够培养学生的分析问题能力.
8.(3分)(2015•泸州)元素周期表中,同周期元素的结构和性质呈现一定的规律性变化.下
表列出的是第三周期元素的原子半径及主要化合价(部分信息未列出).下列有关说法不正
确的是( )
元素 Na Mg ① Si P ② Cl
原子的最外层电子数 1 2 3 4 5 6 7
原子半径(10﹣10m) 1.86 1.60 1.43 ③ 1.10 1.02 0.994
最高正价 +1 +2 ④ +4 +5 ⑤ +7
最低负价 ﹣4 ﹣3 ﹣1
A.⑤处的最高正价是+6,最低负价是﹣2
B.③处的数值介于1.10﹣1.43之间
C.第三周期元素(Na﹣Cl)的最高正价数等于其原子的最外层电子数
D.元素①的原子序数是13,①和②形成的化合物的化学式为AlS
考点:元素周期表的特点及其应用.
专题:化学用语和质量守恒定律.
分析:根据表格中各项的变化规律:第三周期元素从左至右依次为Na、Mg、Al、Si、P、S、Cl,
原子的最外层电子数依次增大;原子半径依次增大;最高正价从+1到+7,最低负价从
﹣4到﹣1,解答下列各题.
解答:解:A、化合价从+1至+7依次增大,从Si开始有变价,负价逐渐减小,故④为+3,⑤为
+6和﹣2,故A正确;
B、由表中信息可知:元素原子的半径逐渐增大,③处的数值介于1.10﹣1.43之间,故
B正确;
C、第三周期元素(Na→Cl)的最高正价数等于其原子的最外层电子数,故C正确;
D、第三周期元素从左至右依次为Na、Mg、Al、Si、P、S、Cl,所以①是Al;②是S,①和②
形成的化合物的化学式为AlS,故D错误;
2 3
3故选D.
点评:本题主要考查原子结构与元素周期表的有关知识,注意把握元素周期表的递变规律.
二、(本大题共4个小题,每空1分,共17分)
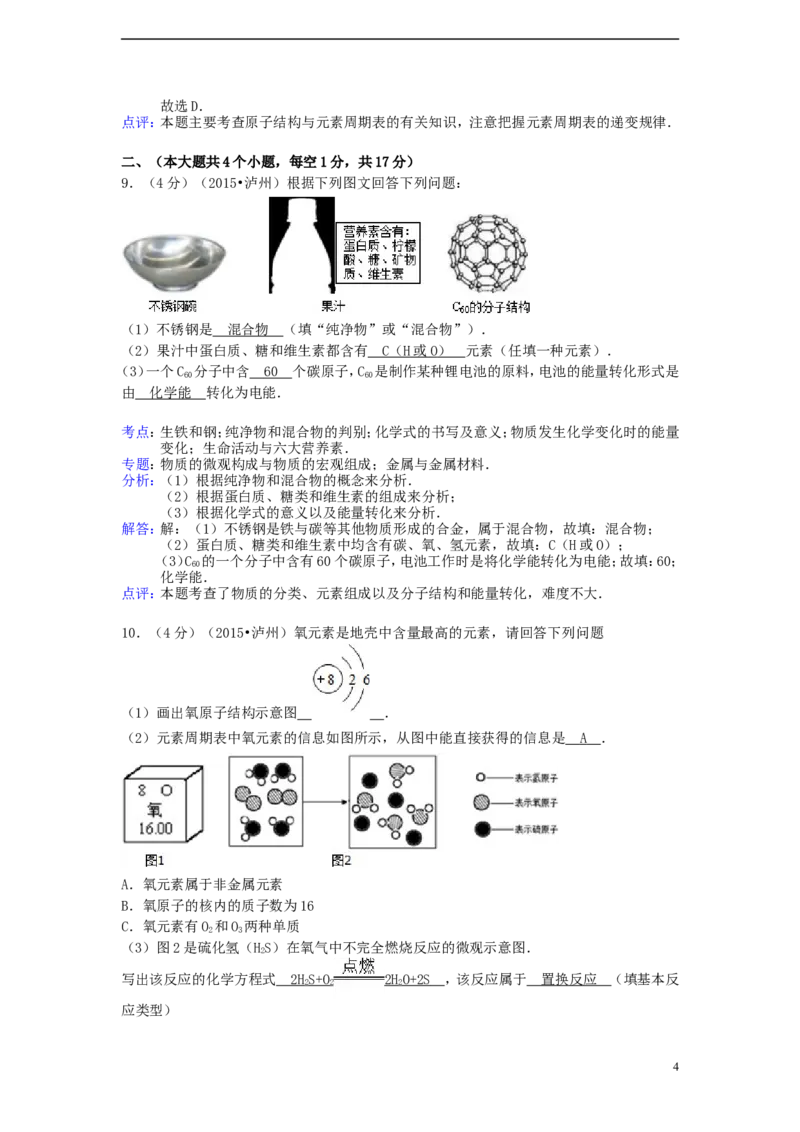
9.(4分)(2015•泸州)根据下列图文回答下列问题:
(1)不锈钢是 混合物 (填“纯净物”或“混合物”).
(2)果汁中蛋白质、糖和维生素都含有 C ( H 或 O ) 元素(任填一种元素).
(3)一个C 分子中含 6 0 个碳原子,C 是制作某种锂电池的原料,电池的能量转化形式是
60 60
由 化学能 转化为电能.
考点:生铁和钢;纯净物和混合物的判别;化学式的书写及意义;物质发生化学变化时的能量
变化;生命活动与六大营养素.
专题:物质的微观构成与物质的宏观组成;金属与金属材料.
分析:(1)根据纯净物和混合物的概念来分析.
(2)根据蛋白质、糖类和维生素的组成来分析;
(3)根据化学式的意义以及能量转化来分析.
解答:解:(1)不锈钢是铁与碳等其他物质形成的合金,属于混合物,故填:混合物;
(2)蛋白质、糖类和维生素中均含有碳、氧、氢元素,故填:C(H或O);
(3)C 的一个分子中含有60个碳原子,电池工作时是将化学能转化为电能;故填:60;
60
化学能.
点评:本题考查了物质的分类、元素组成以及分子结构和能量转化,难度不大.
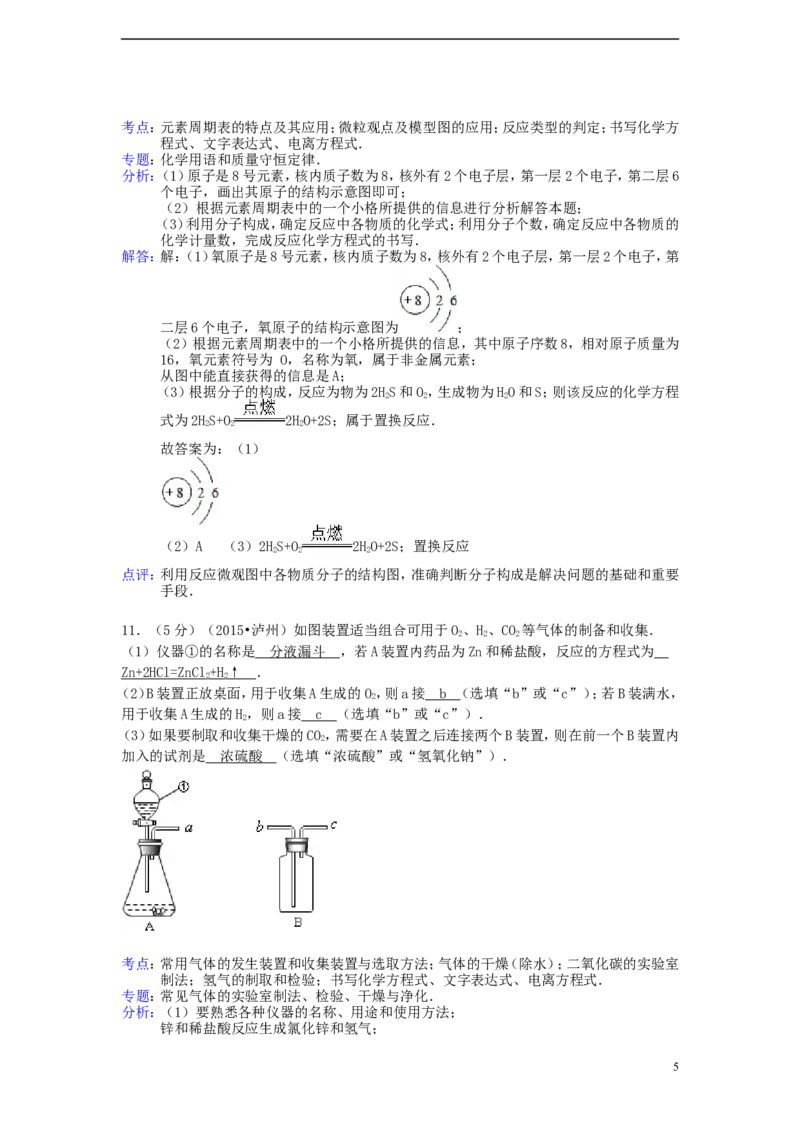
10.(4分)(2015•泸州)氧元素是地壳中含量最高的元素,请回答下列问题
(1)画出氧原子结构示意图 .
(2)元素周期表中氧元素的信息如图所示,从图中能直接获得的信息是 A .
A.氧元素属于非金属元素
B.氧原子的核内的质子数为16
C.氧元素有O 和O 两种单质
2 3
(3)图2是硫化氢(HS)在氧气中不完全燃烧反应的微观示意图.
2
写出该反应的化学方程式 2 HS+O 2H O+2 S ,该反应属于 置换反应 (填基本反
2 2 2
应类型)
4考点:元素周期表的特点及其应用;微粒观点及模型图的应用;反应类型的判定;书写化学方
程式、文字表达式、电离方程式.
专题:化学用语和质量守恒定律.
分析:(1)原子是8号元素,核内质子数为8,核外有2个电子层,第一层2个电子,第二层6
个电子,画出其原子的结构示意图即可;
(2)根据元素周期表中的一个小格所提供的信息进行分析解答本题;
(3)利用分子构成,确定反应中各物质的化学式;利用分子个数,确定反应中各物质的
化学计量数,完成反应化学方程式的书写.
解答:解:(1)氧原子是8号元素,核内质子数为8,核外有2个电子层,第一层2个电子,第
二层6个电子,氧原子的结构示意图为 ;
(2)根据元素周期表中的一个小格所提供的信息,其中原子序数8,相对原子质量为
16,氧元素符号为 O,名称为氧,属于非金属元素;
从图中能直接获得的信息是A;
(3)根据分子的构成,反应为物为2HS和O,生成物为HO和S;则该反应的化学方程
2 2 2
式为2HS+O 2HO+2S;属于置换反应.
2 2 2
故答案为:(1)
(2)A (3)2HS+O 2HO+2S;置换反应
2 2 2
点评:利用反应微观图中各物质分子的结构图,准确判断分子构成是解决问题的基础和重要
手段.
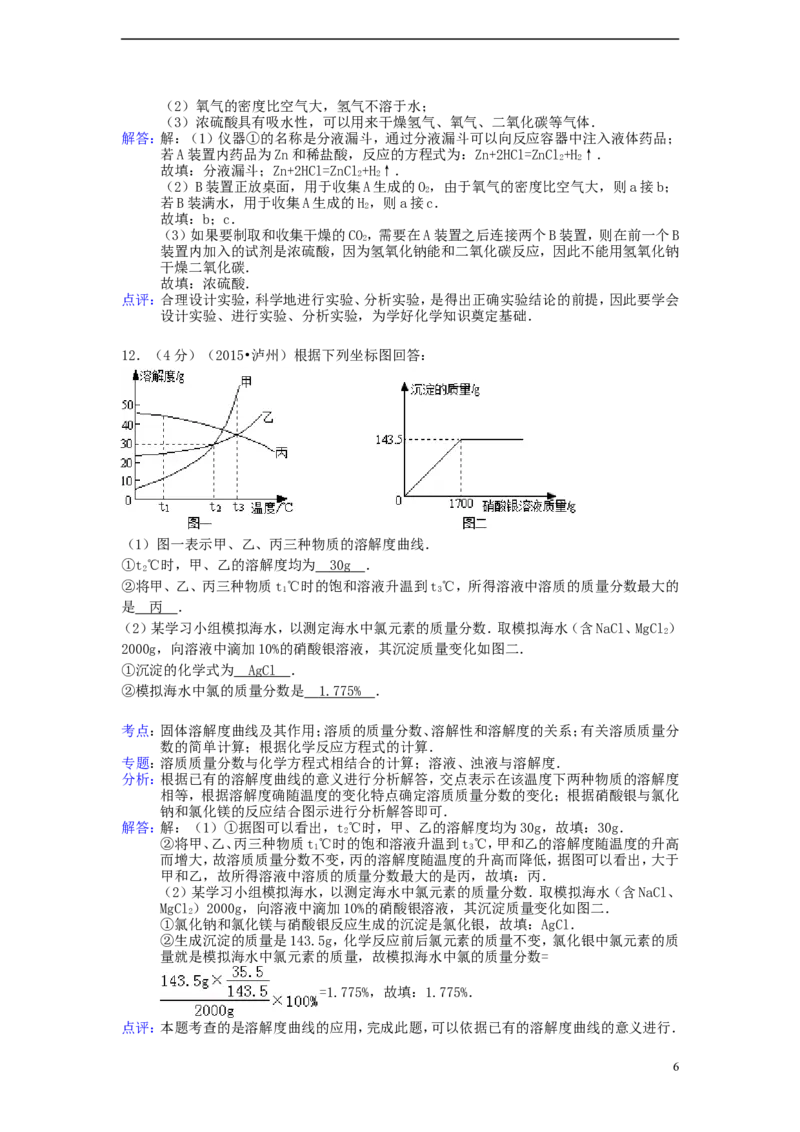
11.(5分)(2015•泸州)如图装置适当组合可用于O、H、CO 等气体的制备和收集.
2 2 2
(1)仪器①的名称是 分液漏斗 ,若A装置内药品为Zn和稀盐酸,反应的方程式为
Zn+2HCl=ZnCl+H ↑ .
2 2
(2)B装置正放桌面,用于收集A生成的O,则a接 b (选填“b”或“c”);若B装满水,
2
用于收集A生成的H,则a接 c (选填“b”或“c”).
2
(3)如果要制取和收集干燥的CO,需要在A装置之后连接两个B装置,则在前一个B装置内
2
加入的试剂是 浓硫酸 (选填“浓硫酸”或“氢氧化钠”).
考点:常用气体的发生装置和收集装置与选取方法;气体的干燥(除水);二氧化碳的实验室
制法;氢气的制取和检验;书写化学方程式、文字表达式、电离方程式.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
锌和稀盐酸反应生成氯化锌和氢气;
5(2)氧气的密度比空气大,氢气不溶于水;
(3)浓硫酸具有吸水性,可以用来干燥氢气、氧气、二氧化碳等气体.
解答:解:(1)仪器①的名称是分液漏斗,通过分液漏斗可以向反应容器中注入液体药品;
若A装置内药品为Zn和稀盐酸,反应的方程式为:Zn+2HCl=ZnCl+H↑.
2 2
故填:分液漏斗;Zn+2HCl=ZnCl+H↑.
2 2
(2)B装置正放桌面,用于收集A生成的O,由于氧气的密度比空气大,则a接b;
2
若B装满水,用于收集A生成的H,则a接c.
2
故填:b;c.
(3)如果要制取和收集干燥的CO,需要在A装置之后连接两个B装置,则在前一个B
2
装置内加入的试剂是浓硫酸,因为氢氧化钠能和二氧化碳反应,因此不能用氢氧化钠
干燥二氧化碳.
故填:浓硫酸.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会
设计实验、进行实验、分析实验,为学好化学知识奠定基础.
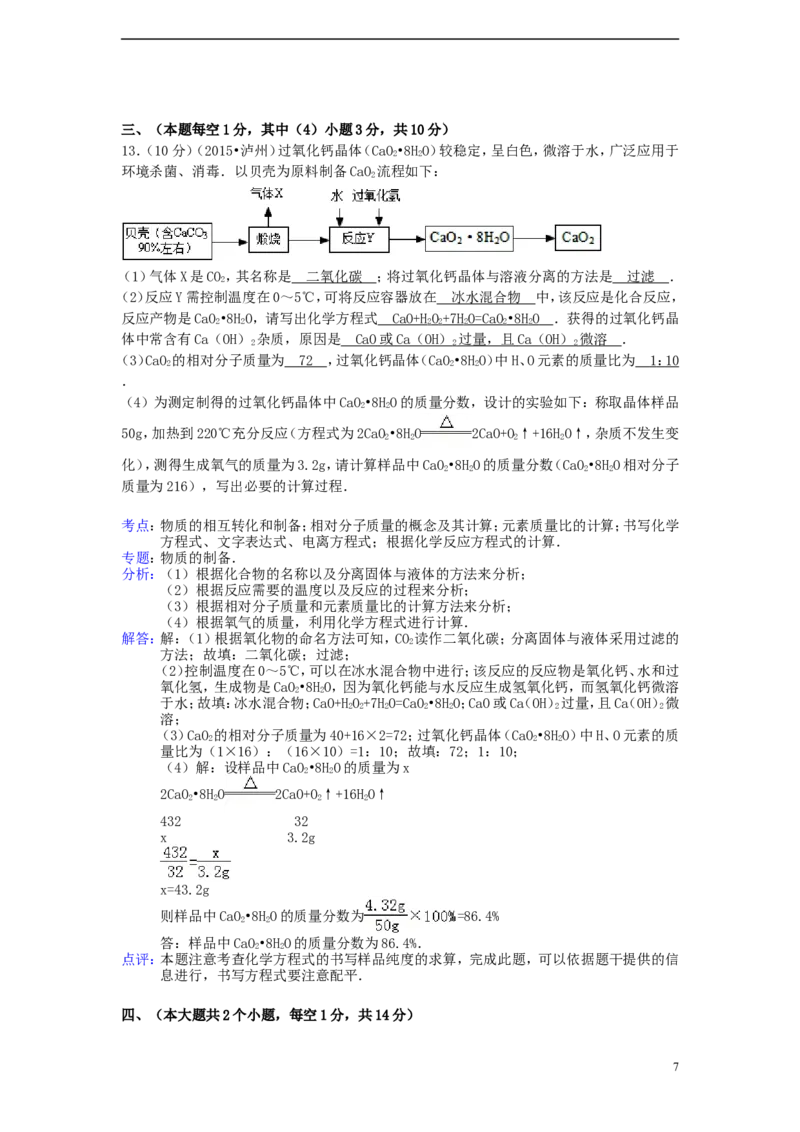
12.(4分)(2015•泸州)根据下列坐标图回答:
(1)图一表示甲、乙、丙三种物质的溶解度曲线.
①t℃时,甲、乙的溶解度均为 30 g .
2
②将甲、乙、丙三种物质t℃时的饱和溶液升温到t℃,所得溶液中溶质的质量分数最大的
1 3
是 丙 .
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数.取模拟海水(含NaCl、MgCl)
2
2000g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二.
①沉淀的化学式为 AgC l .
②模拟海水中氯的质量分数是 1.775 % .
考点:固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;有关溶质质量分
数的简单计算;根据化学反应方程式的计算.
专题:溶质质量分数与化学方程式相结合的计算;溶液、浊液与溶解度.
分析:根据已有的溶解度曲线的意义进行分析解答,交点表示在该温度下两种物质的溶解度
相等,根据溶解度确随温度的变化特点确定溶质质量分数的变化;根据硝酸银与氯化
钠和氯化镁的反应结合图示进行分析解答即可.
解答:解:(1)①据图可以看出,t℃时,甲、乙的溶解度均为30g,故填:30g.
2
②将甲、乙、丙三种物质t℃时的饱和溶液升温到t℃,甲和乙的溶解度随温度的升高
1 3
而增大,故溶质质量分数不变,丙的溶解度随温度的升高而降低,据图可以看出,大于
甲和乙,故所得溶液中溶质的质量分数最大的是丙,故填:丙.
(2)某学习小组模拟海水,以测定海水中氯元素的质量分数.取模拟海水(含NaCl、
MgCl)2000g,向溶液中滴加10%的硝酸银溶液,其沉淀质量变化如图二.
2
①氯化钠和氯化镁与硝酸银反应生成的沉淀是氯化银,故填:AgCl.
②生成沉淀的质量是143.5g,化学反应前后氯元素的质量不变,氯化银中氯元素的质
量就是模拟海水中氯元素的质量,故模拟海水中氯的质量分数=
=1.775%,故填:1.775%.
点评:本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行.
6三、(本题每空1分,其中(4)小题3分,共10分)
13.(10分)(2015•泸州)过氧化钙晶体(CaO•8HO)较稳定,呈白色,微溶于水,广泛应用于
2 2
环境杀菌、消毒.以贝壳为原料制备CaO 流程如下:
2
(1)气体X是CO,其名称是 二氧化碳 ;将过氧化钙晶体与溶液分离的方法是 过滤 .
2
(2)反应Y需控制温度在0~5℃,可将反应容器放在 冰水混合物 中,该反应是化合反应,
反应产物是CaO•8HO,请写出化学方程式 CaO+ HO+7HO=CaO•8H O .获得的过氧化钙晶
2 2 2 2 2 2 2
体中常含有Ca(OH) 杂质,原因是 Ca O 或 C a ( O H ) 过量,且 C a ( O H ) 微溶 .
2 2 2
(3)CaO 的相对分子质量为 7 2 ,过氧化钙晶体(CaO•8HO)中H、O元素的质量比为 1 : 1 0
2 2 2
.
(4)为测定制得的过氧化钙晶体中CaO•8HO的质量分数,设计的实验如下:称取晶体样品
2 2
50g,加热到220℃充分反应(方程式为2CaO•8HO 2CaO+O↑+16HO↑,杂质不发生变
2 2 2 2
化),测得生成氧气的质量为3.2g,请计算样品中CaO•8HO的质量分数(CaO•8HO相对分子
2 2 2 2
质量为216),写出必要的计算过程.
考点:物质的相互转化和制备;相对分子质量的概念及其计算;元素质量比的计算;书写化学
方程式、文字表达式、电离方程式;根据化学反应方程式的计算.
专题:物质的制备.
分析:(1)根据化合物的名称以及分离固体与液体的方法来分析;
(2)根据反应需要的温度以及反应的过程来分析;
(3)根据相对分子质量和元素质量比的计算方法来分析;
(4)根据氧气的质量,利用化学方程式进行计算.
解答:解:(1)根据氧化物的命名方法可知,CO 读作二氧化碳;分离固体与液体采用过滤的
2
方法;故填:二氧化碳;过滤;
(2)控制温度在0~5℃,可以在冰水混合物中进行;该反应的反应物是氧化钙、水和过
氧化氢,生成物是CaO•8HO,因为氧化钙能与水反应生成氢氧化钙,而氢氧化钙微溶
2 2
于水;故填:冰水混合物;CaO+HO+7HO=CaO•8HO;CaO或Ca(OH)过量,且Ca(OH)微
2 2 2 2 2 2 2
溶;
(3)CaO 的相对分子质量为40+16×2=72;过氧化钙晶体(CaO•8HO)中H、O元素的质
2 2 2
量比为(1×16):(16×10)=1:10;故填:72;1:10;
(4)解:设样品中CaO•8HO的质量为x
2 2
2CaO•8HO 2CaO+O↑+16HO↑
2 2 2 2
432 32
x 3.2g
x=43.2g
则样品中CaO•8HO的质量分数为 =86.4%
2 2
答:样品中CaO•8HO的质量分数为86.4%.
2 2
点评:本题注意考查化学方程式的书写样品纯度的求算,完成此题,可以依据题干提供的信
息进行,书写方程式要注意配平.
四、(本大题共2个小题,每空1分,共14分)
714.(4分)(2015•泸州)将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH
变化曲线如图.某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了
如下探究:
【猜想假设】
猜想Ⅰ:pH增大是因为 混合后溶液体积增大 ;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 NaOH+HCl=NaCl+ H O .
2
【实验探究】
为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧
化钠溶液、0.4%的盐酸、水.)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7.
(2)向2mL0.4%的盐酸中加入VmL 水 ,用pH计测得混合液的pH < 7(填“>”、“=”
或“<”).
综合(1)和(2)证明猜想Ⅱ成立.
考点:中和反应及其应用;溶液的酸碱性与pH值的关系;书写化学方程式、文字表达式、电离
方程式.
专题:科学探究.
分析:稀盐酸显酸性,pH小于7,氢氧化钠溶液显碱性,pH大于7;
稀盐酸和氢氧化钠反应生成氯化钠和水.
解答:解:【猜想假设】
猜想Ⅰ:pH增大是因为混合后溶液体积增大,溶液体积变大时,氢离子浓度变小,pH升
高;
猜想Ⅱ:pH增大是因为发生了反应,稀盐酸和氢氧化钠反应的化学方程式为:
NaOH+HCl=NaCl+HO.
2
故填:混合后溶液体积增大;NaOH+HCl=NaCl+HO.
2
【实验探究】
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7,
说明稀盐酸和氢氧化钠发生了中和反应.
(2)向2mL0.4%的盐酸中加入VmL水,用pH计测得混合液的pH<7,通过比较可知猜想
Ⅱ成立.
故填:水;<.
点评:实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实
验,为揭示物质之间相互作用的实质奠定基础.
15.(10分)(2015•泸州)草木灰是农家肥料,主要含钾盐.请回答相关问题.
【分离提纯】
(1)在烧杯里放一定量的草木灰,加入水,同时用玻璃棒搅拌.浸出溶液中主要含有的金属阳
离子是 K + .
(2)把烧杯中的草木灰连同浸出液一起过滤.如果滤液仍然浑浊,处理的方法是 重新过滤
(或再过滤一次) .
(3)把滤液倒入蒸发皿里,加热,用玻璃棒搅拌.当蒸发到 出现大量固体 时,停止加热.
【成分探究】
取(3)所得的晶体少量溶于水,分到两支试管中.
8(4)第一支:滴加盐酸,产生能使澄清的石灰水变浑浊的气体.请写出化学方程式:
①加盐酸: KCO+2HCl=2KCl+CO↑+H O ;
2 3 2 2
②产生浑浊: C a ( O H ) +CO=CaCO↓+H O .
2 2 3 2
(5)第二支:滴加酚酞溶液后,溶液变为 红 色,说明溶液呈碱性.为证明溶液呈碱性是由
CO2﹣引起的,再向试管中加入 CaC l 溶液 〔可供选择试剂:澄清石灰水、KCl溶液(呈中
3 2
性)、CaCl 溶液(呈中性)〕,此时发生反应的方程式为 KCO+CaCl=CaCO ↓+2KC l ,当看
2 2 3 2 3
到 红色褪去(或消失),产生白色沉淀 时即可证明.因此,草木灰 不能 (填“能”或
“不能”)与铵态氮肥混合施用.
考点:实验探究物质的组成成分以及含量;蒸发与蒸馏操作;盐的化学性质;书写化学方程
式、文字表达式、电离方程式.
专题:科学探究.
分析:(1)根据钾盐中的离子分析;
(2)如果一次过滤不干净再过滤一次;
(3)根据蒸发的操作分析;
(4)二氧化碳能使澄清的石灰水变浑浊,根据反应物、生成物和条件书写化学方程式;
(5)碱性溶液能使酚酞溶液变红色,根据CO2﹣的验证分析.铵态氮肥不能与草木灰混
3
合使用.
解答:解:(1)草木灰是农家肥料,主要含钾盐,钾盐溶液中主要含有的金属阳离子是K+.故
填:K+;
(2)如果滤液仍然浑浊,重新过滤;故填:重新过滤(或再过滤一次).
(3)等到蒸发皿中出现较多量的固体时,停止加热,利用蒸发皿的余热使滤液蒸干.故
填:出现大量固体;
(4)二氧化碳能使澄清的石灰水变浑浊,说明生成二氧化碳,证明是碳酸盐或碳酸氢
盐;结合(5)可知为碳酸钾,碳酸钾与盐酸反应生成氯化钾、水和二氧化碳,方程式为
KCO+2HCl=2KCl+CO↑+HO;二氧化碳与氢氧化钙反应生成碳酸钙和水,方程式为Ca
2 3 2 2
(OH)+CO=CaCO↓+HO;故填:KCO+2HCl=2KCl+CO↑+HO;Ca(OH)+CO=CaCO↓+HO;
2 2 3 2 2 3 2 2 2 2 3 2
(5)碱性溶液能使酚酞溶液变红色,要验证溶液呈碱性是由CO2﹣引起的,第一要验证
3
并除去碳酸根,第二不能引入氢氧根,再证明溶液的酸碱性,所以选用CaCl 溶液,反
2
应的方程式为KCO+CaCl=CaCO↓+2KCl.如果溶液的红色褪去(或消失),产生白色沉
2 3 2 3
淀,说明溶液呈碱性是由CO2﹣引起的,草木灰呈碱性,铵态氮肥与碱性物质反应能释
3
放氨气,降低肥效,所以铵态氮肥不能与草木灰混合使用.故填:CaCl 溶液;
2
KCO+CaCl=CaCO↓+2KCl;红色褪去(或消失),产生白色沉淀;不能.
2 3 2 3
点评:本题考查了常见混合物分离操作及成分的确定,完成此题,可以依据物质的性质进行.
9