文档内容
苏州市 2023~2024 学年第二学期学业质量阳光指标调研卷
高二化学
2024.06
注意事项:
1.本试卷分为选择题和非选择题两部分,试卷满分 100 分。考试时间75 分钟。
2.将选择题答案填涂在答题卡的对应位置上,非选择题的答案写在答题卡的指定栏目内。
可能用到的相对原子质量:H1 C12 N14 O16 S32 Cu64
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题意。
1. 中国天宫空间站的太阳翼伸展机构的部件由碳化硅颗粒增强铝基复合材料(其组成可表示为 SiC/Al)制
成, 该材料不具有的性质是 ()
A.耐高温 B.密度大 C.耐腐蚀 D.抗磨损
高温
2.反应 2Na Cr O + 3C CO ↑ +2Cr O + 2Na CO 可制备超细氧化铬。下列说法正确的是 ()
2 2 7 2 2 3 2 3
A.基态 Cr 原子外围电子排布式为 3d4 4s2 B. CO 为极性分子
2
C. Na CO 属于共价化合物 D. CO
2-
的空间结构为平面正三角形
2 3 3
3.实验室利用 NH 和SO 制备 NH HSO 晶体。下列实验装置和操作能达到实验目的的是 ()
3 2 4 3
A.用装置甲制备 SO
2
B.用装置乙制备 NH
3
C.用装置丙制备 NH HSO 溶液
4 3
D.用装置丁蒸干溶液获得 NH HSO 晶体
4 3
4.氨硼烷( NH BH )、钛铁合金(Ti-Fe)、 甲醇( CH OH )均是应用潜力较大的储氢载体。下列说法
3 3 3
正 确的是 ()A.原子半径: r (B) < r (N )
B. 电负性: x(C) > x(O)
C. 甲醇分子中键角: H - C - H > C - O - H
D.基态原子最外层电子数 n : n (Ti) > n (Fe)
5. H O 是地球上分布最广泛的物质。下列说法正确的是 ()
2
A. H O 的电子式为
2
B. 100℃时,纯水的pH = 7
C. D 16O 中,质量数之和是质子数之和的两倍
2
D.0℃ 、101kPa 时,水分子间的平均距离 d : d (液态) > d (固
态) 6.下列有关化学反应的说法正确的是 ()
A.室温下 Fe 在浓硝酸中发生钝化 B.室温下MnO 和浓盐酸反应制取 Cl
2 2
C.室温下 Al 和 NaOH 溶液反应生成 Al(OH) D.室温下 Na 与空气中 O 反应生成 Na O
3 2 2 2
阅读下列材料,完成 7~9 题:
氧元素及其化合物的应用广泛。 O 性质活泼,遇活泼金属可以形成过氧化物( O
2-
)或超氧化物( O
-
2 2 2
)。
超氧化物是强氧化剂,与H O 剧烈反应放出O 。加热 KClO 或重金属氧化物可得到 O 。工业上采用
2 2 3 2
电
解KHSO 溶液制备 H O ,阴极生成 H ,阳极生成过二硫酸根离子( S O
2-
), S O
2-
再与水反应得
4 2 2 2 2 8 2 8
到
H O 。
2 2
7.下列说法正确的是 ()
A. 16 O 、 18 O 互称为同素异形体
2 2
B. H O+ 和H O 的中心原子轨道杂化类型均为 sp3
3 2
C. H O 分子中的化学键均为极性共价键
2 2
D. KClO 晶体中存在K+ 与 Cl- 、 O2- 之间的强烈相互作
3
用 8.下列化学反应表示正确的是 ()
△
A.加热 Ag O 分解制 O : Ag O 2Ag + O ↑
2 2 2 2
B. 电解 KHSO 溶液制H O 的阳极反应: 2SO 2- - 2e- S O 2-
4 2 2 4 2 8-
C. 电解 KHSO 溶液制H O 的阴极反应: 2H O + 2e H ↑ +2OH
4 2 2 2 2
D.超氧化钾( KO )与水反应: 4O - + 2H O 4OH- + 3O ↑
2 2 2 2
9.下列氧化物的结构与性质或性质与用途具有对应关系的是 ()
A. SO 具有还原性,可用作漂白剂
2
B.MgO 难溶于水,可用作耐火材料
C. H O 分子之间形成氢键, H O 的热稳定性强
2 2
D. H O 分子中存在过氧键, H O 具有氧化性
2 2 2 2
10.在给定条件下,下列选项所示的物质间转化均能实现的是 ()
11.前四周期主族元素 X 、Y 、Z 、W 的原子序数依次增大。X 的一种单质是目前已知的自然存在的硬度最
大 的物质,Y 是金属元素,其基态原子 s 能级上的电子数和 p 能级上的电子数相等,Z 是同周期主族元素
中原 子半径最小的元素,X 、Y 、W 三种元素的原子最外层电子数之和等于 10 。下列说法正确的是 ()
A.X 的最高价氧化物对应水化物的酸性比 Z 的弱
B.Y 和 Z 的简单离子具有相同的电子层结
构 C.W 在元素周期表中位于第四周期ⅥA
族
D.X 元素形成的单质均为分子晶体
12.下列实验方案能达到实验目的是 ()
选
实验目的 实验方案
项
A 探究 Fe2+ 能否催化双氧水分解 向 2mL5% H O 溶液中滴加几滴FeSO 溶液,观察气泡产生情况
2 2 4
B 探究 Na SO 溶液是否变质 取少量 Na SO 溶液,向其中滴加几滴 BaCl 溶液,观察现象
2 3 2 3 2
制备 Cu (NH ) 7」SO . H O 向 2mL5% CuSO 溶液中滴加浓氨水至沉淀溶解,再加入
C 3 4 4 2 4
晶体 8mL95% 乙醇溶液,过滤
D 制备 Fe (OH) 胶体 向 50mL1.0mol .L-1NaOH 溶液中加入 5~6 滴饱和FeCl 3 溶液,
3
加 热煮沸
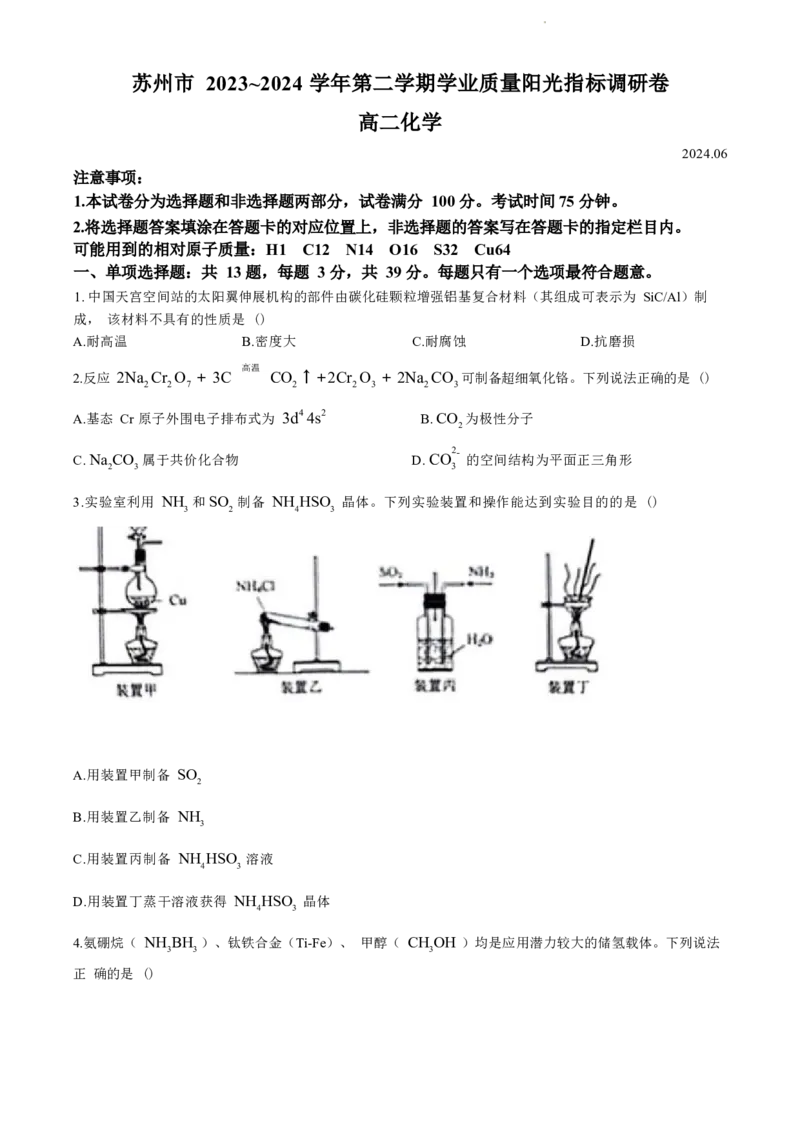
13. 由废钯催化剂(主要含 Pd ,还有少量 Al O 、 SiO 等杂质)提取 Pd 的流程如下:
2 3 2已知:“浸出 ”步骤中生成配合物 H [PdCl ] 。下列说法正确的是 ()
2 4
A.浸出过程中双氧水作还原剂
B.浸渣的主要成分为 H SiO
2 3
C.氨化过程含 Pd 物质发生反应的化学方程式为:
H [PdCl ]+ 6NH . H O Pd(NH ) Cl + 2NH Cl + 6H O
2 4 3 2 3 4 2 4 2
D.金属 Pd 的晶胞如题图所示,晶胞中含有 14 个钯原子
二、非选择题:共 4 题,共 61 分。
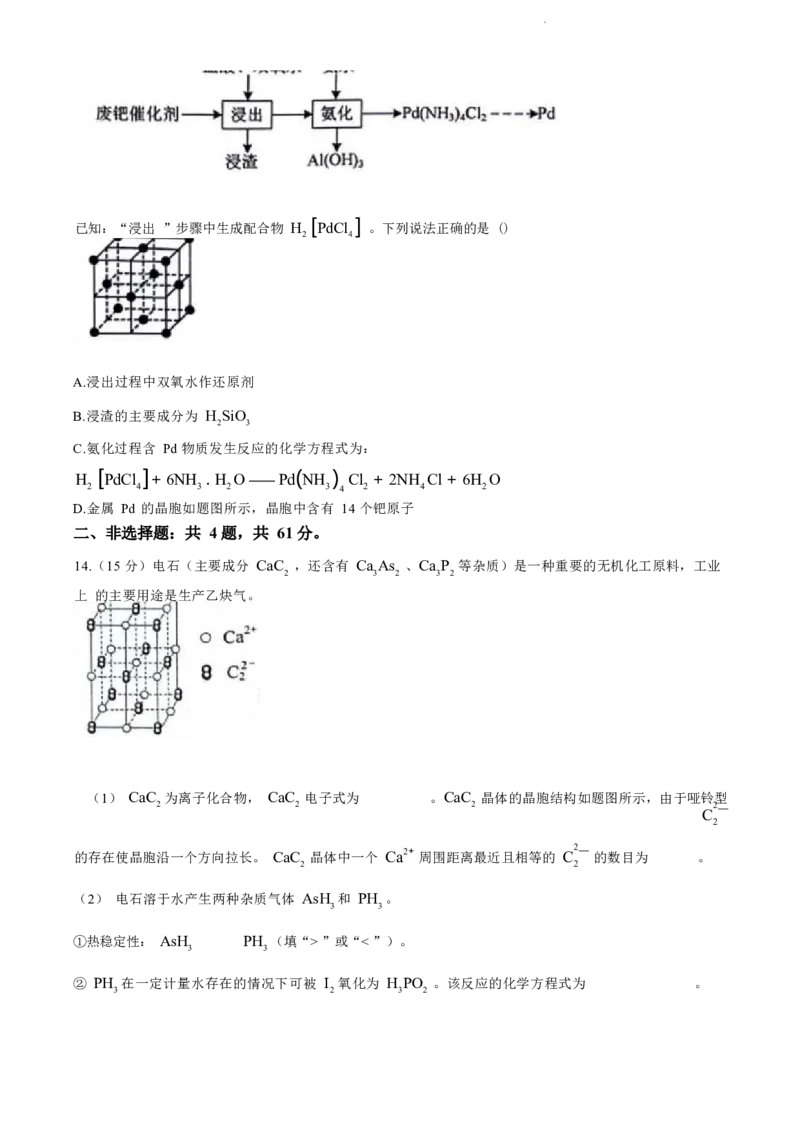
14.(15 分)电石(主要成分 CaC ,还含有 Ca As 、Ca P 等杂质)是一种重要的无机化工原料,工业
2 3 2 3 2
上 的主要用途是生产乙炔气。
(1) CaC 为离子化合物, CaC 电子式为 。CaC 晶体的晶胞结构如题图所示,由于哑铃型
2 2 2 2
C —
2
2
的存在使晶胞沿一个方向拉长。 CaC 晶体中一个 Ca2+ 周围距离最近且相等的 C — 的数目为 。
2 2
(2) 电石溶于水产生两种杂质气体 AsH 和 PH 。
3 3
①热稳定性: AsH PH (填“> ”或“< ”)。
3 3
② PH 在一定计量水存在的情况下可被 I 氧化为 H PO 。该反应的化学方程式为 。
3 2 3 2(3) 电石使用会产生电石渣,电石渣主要含 CaO ,还含少量 MgO 、 Al O 和SiO 等。
2 3 2
①Mg 和 Al 的第一电离能: I (Mg) I (Al) (填“> ”或“< ”)。
1 1
②1mol SiO 晶体中含有 Si—O 共价键的数目为 。
2
③CaO 晶体的熔点比 MgO 晶体低的原因是 。
15.(15 分)硫氰化亚铜(CuSCN)在国民经济和科研领域应用广泛,可利用氯化铜溶液或脱硫废液制得。
Ⅰ.利用氯化铜溶液制备硫氰化亚铜
第一步:在 CuCl 和盐酸的混合溶液中加入铜粉生成稳定的配合物 H[ CuCl ];
2 2
第二步:加入 NaSCN 溶液,将 H[ CuCl ]转化为 CuSCN 沉淀。
2
(1)第一步反应的离子方程式为 。
(2) SCN — 与 CS 的结构相似, SCN — 中 σ 键和 π 键的个数比为 。
2
(3)测定 CuSCN 样品的纯度。准确称取 0.2500g 硫氰化亚铜样品,加入NaOH 溶液处理后,过滤得到含
SCN —
待测液,将待测液总体积的 转移至锥形瓶中,滴加稀硝酸酸化,加入 10.00mL 0. 1000mol . L
—1
AgNO
3
溶
液, 以Fe3+ 作指示剂,用 0.04000mol . L—1 NH SCN 标准溶液滴定至终点,平行滴定 3 次,平均消耗
4
NH SCN 标准溶液 20.00mL 。已知: Ag+ + SCN — AgSCN ↓ (白色)。
4
①滴定终点观察到的现象为 。
②计算样品中 CuSCN 的纯度。(写出计算过
程) Ⅱ.利用脱硫废液制备硫氰化亚铜
将脱硫废液[主要含 NH SCN 、 (NH ) S O ]与 CuSO 溶液混合,调节溶液 pH= 1~3 ,反应生成
4 4 2 2 3 4
CuSCN 沉淀和连四硫酸铵[ (NH ) S O ]等物质。
4 2 4 6
2 2
(4) 已知: S O — 的结构式为 。 S O — 结构中存在两种不同环境的 S 原子,不存在 S=S
2 3 4 6
键和
O-O 键。 S O
2—
的结构式可表示为 。
4 6
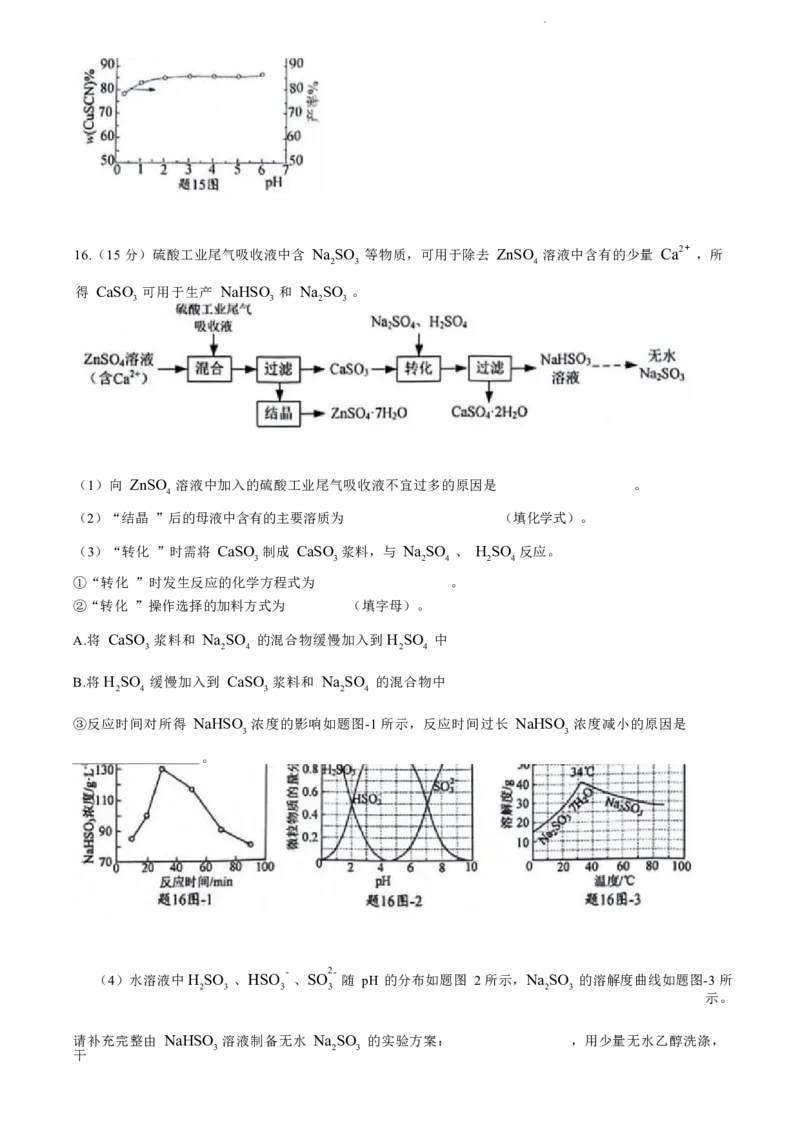
(5)控制其他条件不变,CuSCN 的纯度及产率随 pH 的变化如题图所示。当溶液pH <1时,随 pH 降低
CuSCN 的纯度及产率均降低的原因是 。16.(15 分)硫酸工业尾气吸收液中含 Na SO 等物质,可用于除去 ZnSO 溶液中含有的少量 Ca2+ ,所
2 3 4
得 CaSO 可用于生产 NaHSO 和 Na SO 。
3 3 2 3
(1)向 ZnSO 溶液中加入的硫酸工业尾气吸收液不宜过多的原因是 。
4
(2)“结晶 ”后的母液中含有的主要溶质为 (填化学式)。
(3)“转化 ”时需将 CaSO 制成 CaSO 浆料,与 Na SO 、 H SO 反应。
3 3 2 4 2 4
①“转化 ”时发生反应的化学方程式为 。
②“转化 ”操作选择的加料方式为 (填字母)。
A.将 CaSO 浆料和 Na SO 的混合物缓慢加入到H SO 中
3 2 4 2 4
B.将H SO 缓慢加入到 CaSO 浆料和 Na SO 的混合物中
2 4 3 2 4
③反应时间对所得 NaHSO 浓度的影响如题图-1所示,反应时间过长 NaHSO 浓度减小的原因是
3 3
___________________。
(4)水溶液中H SO 、HSO - 、SO 2- 随 pH 的分布如题图 2 所示,Na SO 的溶解度曲线如题图-3 所
2 3 3 3 2 3
示。
请补充完整由 NaHSO 溶液制备无水 Na SO 的实验方案: ,用少量无水乙醇洗涤,
3 2 3
干燥,密封包装。
17.(16 分)水合肼( N H . H O )是化工生产中的重要原料,具有强还原
2 4 2
性。 Ⅰ.水合肼的制备
(1)利用 NaClO-NaOH 混合溶液与尿素[ CO(NH ) ]水溶液在 105℃反应制得水合肼,该反应的化学反
应 2 2
方程式为 。
(2)合成 N H . H O 的装置如题图-1 所示,操作时,不能将尿素水溶液加入到 NaClO-NaOH 混合溶液
2 4 2 中,
其原因是 。
(3)工业生产上通常在制备过程中加入一定量的丙酮。丙酮先与水合肼快速形成丙酮连氮,反应后将丙酮
连氮蒸出,再将丙酮连氮转化为 N H . H O ,丙酮循环使用,其过程可表示如下:
2 4 2
相对于制备过程中不加丙酮,加入丙酮的优点是 。
Ⅱ.水合肼的应用
用水合肼处理铜氨废液获得纳米铜粉。已知:弱碱性铜氨废液中主要含 Cu2+ 、Cl- 、NH + ;铜氨废液中
4
Cu2+
2+
和 NH 之间存在平衡:「LCu (NH ) 7」 - - 一 -Cu 2+ +4NH 。
3 3 4 3
(4)水合肼直接将溶液中的
Cu2+
还原成纳米铜粉,同时产生一种无毒气体。要得到 1mol 纳米铜粉,理
论
上需要消耗水合肼的物质的量为 。
(5)水合肼呈弱碱性,随着反应体系 pH 升高,纳米铜粉的产率随溶液 pH 的变化如题图-2 所示,pH >
10
时,纳米铜粉的产率随溶液 pH 的升高而下降的原因是 。+
(6)水合肼处理铜氨废液后的废水中主要含有 NH ,需要进行处理后排放。
4
+
①向废水中加入一定量的 Na HPO .12H O 和 MgCl .6H O ,将 NH 转化为 NH MgPO .6H O
2 4 2 2 2 4 4 4 2
沉淀
去除,该反应的离子反应方程式为 。
②控制 n
( Mg2+ )
: n
(
NH
+)
: n
(
HPO
2 )
= 1.2 :1: 0.9 ,溶液中氨氮去除率和余磷量如题图-3 所示:当
4 4—
pH > 13 时,氨氮去除率迅速下降,余磷量快速升高的原因是 。