文档内容
第四章 物质结构 元素周期律
第三节 化学键
第1课时 离子键
1.(2020·全国高一课时练习)下列说法正确的是( )
A.熔融状态下能导电的物质一定是离子化合物
B.金属元素与非金属元素一定形成离子化合物
C.阴、阳离子通过静电引力所形成的化学键称为离子键
D.在化合物 中,两个氯离子之间不存在离子键
【答案】D
【解析】
A.能导电的物质不一定是电解质,金属单质在熔融状态下也能导电,A项错误;
B.金属元素和非金属元素也有可能形成共价化合物,如 ,B项错误;
C.阴、阳离子通过静电作用所形成的化学键称为离子键,静电作用包括静电引力和静电斥力,C项错误。
D.氯化钙电子式为 ,两个氯离子不靠近,不存在离子键,D正确。
【点睛】
本题易错点为B,注意 为共价化合物。同样,非金属之间也不一定形成共价化合物,如氯化铵是离
子化合物。
2.下列物质属于离子化合物的是( )
A.CO B.Ne C.HCl D.NaCl
2
【答案】D
【解析】
A.CO 中C原子与O原子间通过共价键形成共价化合物,A不合题意;
2
B.Ne为单原子单质分子,B不合题意;
C.HCl中H原子与Cl原子间通过共价键形成共价化合物,C不合题意;
D.NaCl由Na+与Cl-间通过离子键形成离子化合物,D符合题意;
故选D。3.下列物质中,含有离子键的是( )
A.NH B.CO C.N D.MgCl
3 2 2 2
【答案】D
【解析】
A. 氨气是共价化合物,只含共价键,故A不选;
B. 二氧化碳是共价化合物,只含共价键,故B不选;
C. 氮气是单质,只含共价键,故C不选;
D. MgCl 是离子化合物,且只含离子键,故选D;
2
4.下列性质中,可以证明某化合物中一定存在离子键的是( )
A.可溶于水 B.有较高的熔点
C.水溶液能导电 D.熔融状态能导电
【答案】D
【解析】
A.可溶于水的化合物,不一定是离子化合物,如HCl等,A项错误;
B.具有较高熔点的化合物,不一定是离子化合物,如二氧化硅等,B项错误;
C.水溶液能导电的化合物,不一定是离子化合物,如醋酸、硫酸等,C项错误;
D.熔融状态下能导电的化合物中含有阴阳离子,所以一定是离子化合物,一定含有离子键,D项正确;
5.下列微粒的电子式书写错误的是( )
A.氯原子 B.氧离子
C.氟化钙 D.硫化钠
【答案】C
【解析】在书写离子化合物的电子式时,每个离子都要单独写,而且要符合其实际相邻关系。
A.氯原子核外有7个电子,其电子式为 ,A正确;
B.氧离子为氧原子得到2个电子,形成为阴离子,电子式为 ,B正确;
C.氟化钙为离子化合物,电子式为 ,C错误;D.硫化钠为离子化合物,电子式为 ,D正确;
6.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题。关于锂的叙述不正确的是(
)
A.锂是较轻的金属 B.LiOH的碱性比NaOH弱
C.锂的化学性质比钠活泼 D.LiO是离子化合物
2
【答案】 C
【详解】
A.锂是碱金属,碱金属单质密度从上到下逐渐增大(Na、K反常),则锂是较轻的金属,故A正确;
B.元素的金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Na>Li,则LiOH的碱性比
NaOH弱,故B正确;
C.钠和锂为同主族元素,最外层都为一个电子,钠原子的半径比锂原子的大,更易失去最外层电子,则
钠的化学性质比锂活泼,故C错误;
D.LiO是离子化合物,故D正确;
2
答案选C。
7.短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金
属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是( )
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)<r(Y)<r(Z)<r(W)
【答案】B
【分析】
Y是迄今发现的非金属性最强的元素,可知Y应为F,X原子的最外层有6个电子,且原子序数小于F,X
应为O元素,在周期表中Z位于IA族,由原子序数关系可知Z为Na元素,W与X属于同一主族,W应
为S元素。
【详解】
A.元素X、W的简单阴离子分别为O2‒、S2‒,离子的电子层结构不同,A项错误;
B.Y为F,Z为Na,由Y、Z两种元素组成的化合物为NaF,是离子化合物,B项正确;
C.非金属性F>S,元素的非金属性越强,对应的氢化物越稳定,故W的简单气态氢化物的热稳定性不如
Y的强,C项错误;D.原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则半径r(F)<r(O)<
r(S)<r(Na),即原子半径:r(Y)<r(X)<r(W)<r(Z),D项错误;
答案选B。
8.下列说法中不正确的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物
C.NaCl中所有的原子均为8电子稳定结构
D.熔融的NaHSO 发生NaHSO=Na++HSO -,此时破坏的只有离子键
4 4 4
【答案】B
【详解】
A.元素的非金属性越强,其相应氢化物的稳定性就越强。由于元素的非金属性:F>Cl>Br>I,所以
HF、HCl、HBr、HI的热稳定性依次减弱,A正确;
B.熔融状态下能导电的化合物为离子化合物,其中一定含离子键;金属与非金属元素形成的化合物不一
定是离子化合物,如氯化铝是共价化合物,B错误;
C.NaCl中所有的原子均为8电子稳定结构,C正确;
D.NaHSO 溶于水时发生NaHSO=Na++H++ ,此时破坏了离子键和共价键,D正确;
4 4
故选B。
二、填空题
9.下列物质中,①HO ②O ③NaO ④NaOH ⑤NaBr ⑥AlCl ⑦Ne ⑧HO
2 2 2 2 3 2 2
(1)存在离子键的是__________________
(2)属于离子化合物的是___________________
【答案】⑤ ③④⑤
【详解】①HO为共价化合物,只存在H-O极性共价键;
2
②O 只存在O=O非极性共价键;
2
③NaO 为离子化合物,存在离子键、O-O极性共价键;
2 2
④NaOH为离子化合物,存在离子键、H-O极性共价键;
⑤NaBr为离子化合物,只存在离子键;
⑥AlCl 为共价化合物,只存在极性共价键
3
⑦Ne为单原子分子,不存在化学键
⑧HO 为共价化合物,存在O-O极性共价键和H-O极性共价键
2 2综上所述,只存在只存在离子键的是⑤;属于离子化合物的是③④⑤。
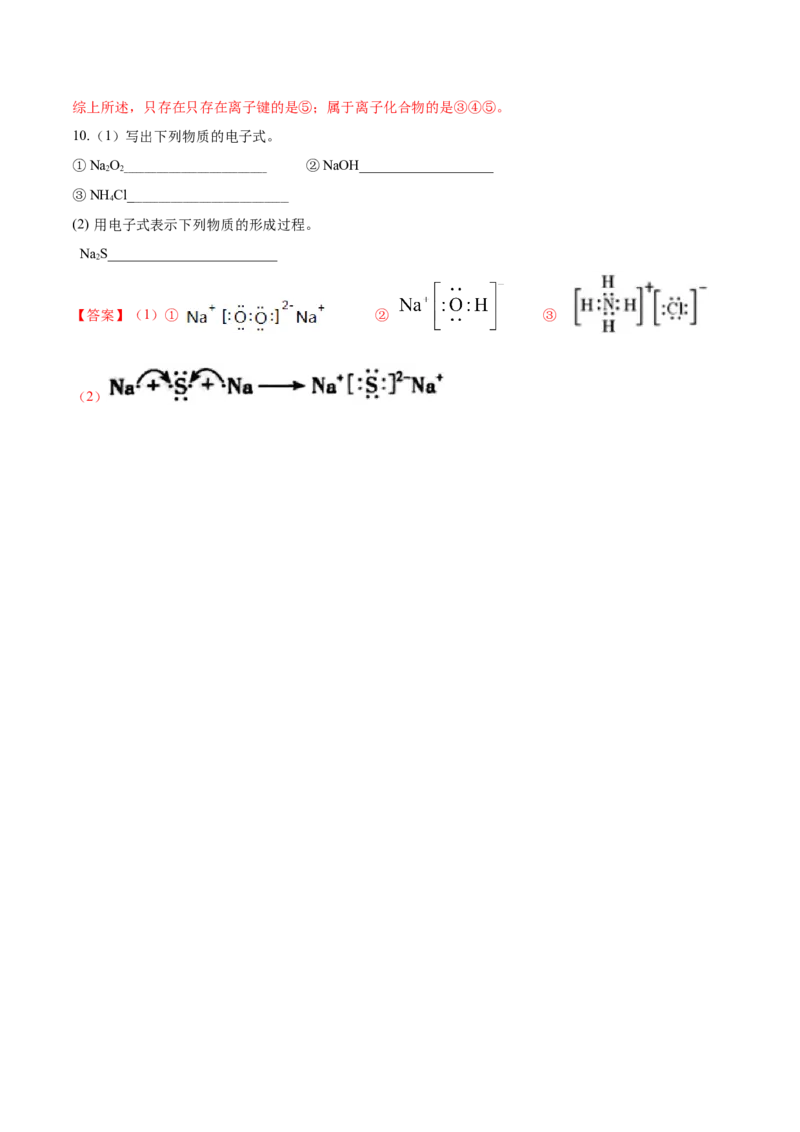
10.(1)写出下列物质的电子式。
①NaO ②NaOH___________________
2 2___________________________________
③NH Cl_
4 ______________________________________
(2) 用电子式表示下列物质的形成过程。
NaS________________________
2
【答案】(1)① ② ③
(2)