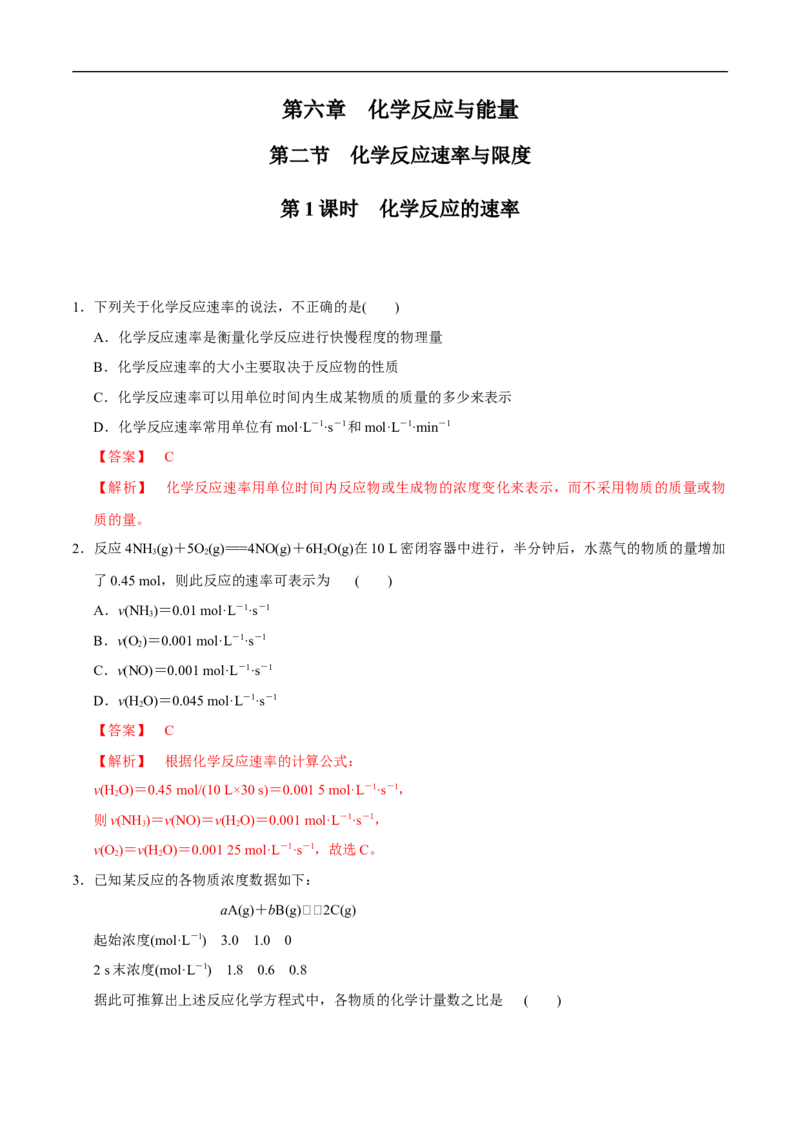文档内容
第六章 化学反应与能量
第二节 化学反应速率与限度
第1课时 化学反应的速率
1.下列关于化学反应速率的说法,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率的大小主要取决于反应物的性质
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1
【答案】 C
【解析】 化学反应速率用单位时间内反应物或生成物的浓度变化来表示,而不采用物质的质量或物
质的量。
2.反应4NH (g)+5O(g)===4NO(g)+6HO(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加
3 2 2
了0.45 mol,则此反应的速率可表示为 ( )
A.v(NH )=0.01 mol·L-1·s-1
3
B.v(O )=0.001 mol·L-1·s-1
2
C.v(NO)=0.001 mol·L-1·s-1
D.v(H O)=0.045 mol·L-1·s-1
2
【答案】 C
【解析】 根据化学反应速率的计算公式:
v(H O)=0.45 mol/(10 L×30 s)=0.001 5 mol·L-1·s-1,
2
则v(NH )=v(NO)=v(H O)=0.001 mol·L-1·s-1,
3 2
v(O )=v(H O)=0.001 25 mol·L-1·s-1,故选C。
2 2
3.已知某反应的各物质浓度数据如下:
aA(g)+bB(g)2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是 ( )A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
【答案】 B
【解析】 各物质的反应速率之比等于它们在化学方程式中的化学计量数之比。 v(A)==0.6
mol/(L·s),v(B)==0.2 mol/(L·s),v(C)==0.4 mol/(L·s)。化学计量数之比为 0.6∶0.2∶0.4,即
3∶1∶2。
4.反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol·L-1·min-1;
②v(B)=0.45 mol·L-1·min-1;
③v(C)=0.015 mol·L-1·min-1;
④v(D)=0.45 mol·L-1·min-1
则此反应在不同条件下进行最快的是( )
A.②③ B.①③ C.②④ D.②
【答案】 D
【解析】 化学反应速率之比等于化学反应方程式中的化学计量数之比,即v(A)∶v(B)∶v(C)∶v(D)=
3∶1∶2∶2,则用A表示的化学反应速率分别为:①v(A)=0.6 mol·L-1·min-1;②中v(A)=3v(B)=0.45
mol·L-1·min-1×3=1.35 mol·L-1·min-1;③中v(A)=v(C)=×0.015 mol·L-1·min-1=0.022 5 mol·L-1·min-
1;④中v(A)=v(D)=×0.45 mol·L-1·min-1=0.675 mol·L-1·min-1,所以在不同条件下,进行最快的是②,
D项正确。
5.向四个体积相同的密闭容器中分别充入一定量的 SO 和O ,开始反应时,按反应速率由大到小的排
2 2
列顺序正确的是( )
甲:500 ℃,10 mol SO 和5 mol O 反应
2 2
乙:500 ℃,VO 作催化剂,10 mol SO 和5 mol O 反应
2 5 2 2
丙:450 ℃,8 mol SO 和5 mol O 反应
2 2
丁:500 ℃,8 mol SO 和5 mol O 反应
2 2
A.甲、乙、丙、丁 B.乙、甲、丙、丁
C.乙、甲、丁、丙 D.丁、丙、乙、甲
【答案】 C
【解析】 温度高,浓度大,且使用催化剂,反应速率最快,乙组最快。其次是甲,最慢的是丙。
6.为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位同学分别设计了如下四个实验,你认为
结论不正确的是( )
A.将铜片放入稀硫酸中,无现象。若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成
B.将除去氧化膜的大小相同、质量相同的镁条和铝条与相同浓度盐酸反应,前者速率大于后者
C.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生
氧气的快慢不同
D.相同条件下等质量的块状和粉末状大理石与相同浓度盐酸反应时,粉末状的反应速率快
【答案】 A
【解析】 加入硝酸银溶液后,铜在酸性条件下与硝酸根离子(相当于稀硝酸)反应产生NO,不可能生
成H,错误。
2
7.在2A+B3C+4D反应中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
【答案】 B
【解析】 正确的思路应是根据反应速率与化学方程式中化学计量数之间的关系将各物质的反应速率
转化为用同一种物质表示的速率。A项中据v(A)推知v(B)=0.25 mol·L-1·s-1,C项中据v(C)推出v(B)=
0.27 mol·L-1·s-1,D项中据v(D)推出v(B)=0.25 mol·L-1·s-1,故反应速率最快的是B选项。
8.反应A+3B===2C+2D在四种不同情况下的反应速率可分别为
①v(A)=0.15 mol/(L·s) ②v(B)=0.6 mol/(L·s)
③v(C)=0.4 mol/(L·s) ④v(D)=0.45 mol/(L·s)
该反应进行的快慢顺序为________。
【答案】 ④>③=②>①
【解析】 根据反应速率之比等于各反应物、生成物的化学计量数之比,把各种不同物质表示的反应
速率转化为同一物质(本题中以物质A为标准)表示的反应速率,则有
v(A)∶v(B)=1∶3,则②表示的反应速率为v(A)=0.2 mol/(L·s);
v(A)∶v(C)=1∶2,则③表示的反应速率为v(A)=0.2 mol/(L·s);
v(A)∶v(D)=1∶2,则④表示的反应速率为v(A)=0.225 mol/(L·s)。
故反应进行的快慢顺序为④>③=②>①。
9.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和生活
质量的提高。下列各图所示的措施中,是为了增大化学反应速率的是( )【答案】 C
【解析】 A项为防止铁门生锈,B项为防止橡胶老化,D项为防止木头腐烂,三者均为了减慢化学反
应速率。C项是为了使炉火更旺,加快化学反应速率。
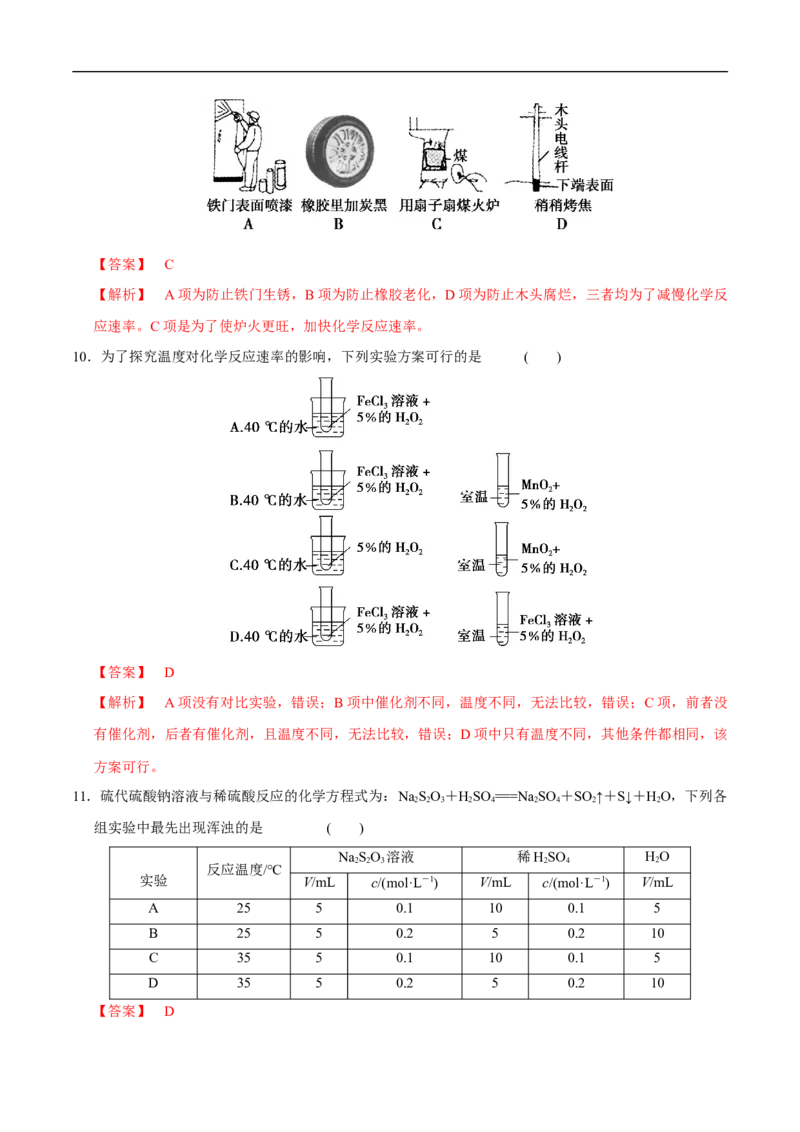
10.为了探究温度对化学反应速率的影响,下列实验方案可行的是 ( )
【答案】 D
【解析】 A项没有对比实验,错误;B项中催化剂不同,温度不同,无法比较,错误;C项,前者没
有催化剂,后者有催化剂,且温度不同,无法比较,错误;D项中只有温度不同,其他条件都相同,该
方案可行。
11.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:NaSO+HSO ===Na SO +SO ↑+S↓+HO,下列各
2 2 3 2 4 2 4 2 2
组实验中最先出现浑浊的是 ( )
NaSO 溶液 稀HSO HO
2 2 3 2 4 2
反应温度/℃
实验 V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
【答案】 D【解析】 影响化学反应速率的因素众多,本题从浓度和温度两个因素考查,非常忠实于必修2,只要
抓住浓度越大,温度越高,反应速率越大,便可以选出正确答案D。
12.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO 溶液
4
D.不用铁片,改用铁粉
【答案】 B
【解析】 加热、发生原电池反应、增大固体反应物的表面积,都能加快反应速率;浓硫酸使铁发生
钝化,阻止了进一步的反应。故正确答案为B。
13.一般情况下,金属越活泼,与酸反应的速率越快。为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究
性学习小组设计了如下的实验:
①取A、B、C三支试管,分别加入2 mL浓度相同的盐酸溶液。
②分别加入足量的、质量相等的Mg粉、Zn粉、Fe粉,立即把三个相同的气球分别套在各试管口上。
(1)写出铁与盐酸反应的化学方程式: ________________________________。
(2)气球膨胀速度最快的是________(填试管编号)。
(3) 该 实 验 表 明 , 实 验 室 一 般 选 用 锌 而 不 选 用 镁 、 铁 制 取 氢 气 的 主 要 原 因 是
_________________________________________________________________。
(4)步骤②是实验获得成功的关键,你认为在操作过程中各小组成员之间应该如何操作?
【答案】 (1)Fe+2HCl===FeCl +H↑ (2)A
2 2
(3)镁与盐酸反应产生氢气过快不易控制,而铁与盐酸反应产生氢气较慢影响实验时间
(4)应把金属粉末先分别放入气球中再将气球套在试管上,同时将气球提起,让金属同时落入盐酸中以
保证反应同时开始又不损失氢气。
14.(1)在反应A(g)+3B(g)===2C(g)中,若以物质A表示的该反应的化学反应速率为 0.2 mol·L-1·min-1,
则以物质B表示此反应的化学反应速率为__________ mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N 和3 mol H ,在一定条件下发生反应,3 s后测得N 为1.9 mol,
2 2 2则以H 的浓度变化表示的反应速率为_______________。
2
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g)2C(g),在
最初2 s内,消耗A的平均速率为0.06 mol·L-1·s-1,则在2 s时,容器中有______ mol A,此时C的物质
的量浓度为________。
【答案】 (1)0.6 (2)0.05 mol·L-1·s-1
(3)8.8 0.08 mol·L-1
【解析】 (1)根据化学方程式中的计量数关系,=,v(B)=3v(A)=3×0.2 mol·L-1·min-1=0.6 mol·L-
1·min-1。
(2)解法一:3 s 内消耗的 N 的物质的量为 2 mol-1.9 mol=0.1 mol,根据化学方程式 N +
2 2
3H2NH ,可以计算出3 s内消耗的H 的物质的量为0.3 mol,根据化学反应速率的计算公式,
2 3 2
v(H )==0.05 mol·L-1·s-1。
2
解法二:先计算出以N 表示的化学反应速率v(N )== mol·
2 2
L-1·s-1,再根据化学方程式的计量数关系,计算出以H 表示的化学反应速率v(H )=3v(N )=0.05 mol·L
2 2 2
-1·s-1。
(3) 3A(g) + B(g) 2C(g)
1.0 0.5 0
0.04 0.08
0.08
则2 s时,n(A)=0.88 mol·L-1×10 L=8.8 mol
c(C)=0.08 mol·L-1。
15.下表是稀硫酸与某金属反应的实验数据:
实验 金属质 V(H SO )/ 溶液温度/℃ 金属消
金属状态 2 4 失的时
序号 量/g c(H SO )/ mL 间/s
2 4
(mol·L-1) 反应前 反应后
1 0.10 丝 0.5 50 20 34 500
2 0.10 粉末 0.5 50 20 35 50
3 0.10 丝 0.7 50 20 36 250
4 0.10 丝 0.8 50 20 35 200
5 0.10 粉末 0.8 50 20 36 25
6 0.10 丝 1.0 50 20 35 125
7 0.10 丝 1.0 50 35 50 50
8 0.10 丝 1.1 50 20 34 1009 0.10 丝 1.1 50 30 44 40
分析上述数据,完成下列问题:
(1)实验4和5表明________________对反应速率有影响,________反应速率越快,能表明同一规律的
实验还有________。(填实验序号)
(2)仅表明反应物浓度对反应速率产生影响的实验有________。(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化 值 (约 15 ℃) 相近,推测其原因:
__________________________________________________________________。
【答案】 (1)固体反应物的表面积 表面积越大 1、2
(2)1、3、4、6、8或2、5 (3)反应温度 6、7或8、9
(4)因为所有反应中,金属的质量和硫酸溶液体积均相等,并且硫酸过量,产生的热量相等,所以溶液
的温度变化值相近
【解析】 本题考查影响化学反应速率的因素,同时考查分析图表、解决问题的能力。既要注意表格
中金属的状态不同,又要通过对比各种数据,综合分析得出答案。