文档内容
吉林省“BEST 合作体”2024-2025 学年度上学期期末考试
高一化学试题答案及评分标准
一、 单项选择题(每题3 分,共45 分)
1-15 CADAC CBDAA CBACD
二、 非选择题(共55 分)
16.(共14 分)
(1) ②③⑤⑥⑨(2 分, 多选、少选均不得分) ①⑧⑨(2 分, 多选、少选均不得分)
(2)C(2 分,其他答案均不得分)
(3)①(2 分,其他答案均不得分)
(4)
(2 分,不加沉淀符号扣1 分,配平错误不得分)
(2 分)
(5)ad(2 分,各1 分,多选不得分)
17.(共12 分)
(1)②⑧①⑥④⑤⑦③(2 分,其他答案均不得分)
(2)71.6(2 分,其他答案均不得分)
(3)20.0(2 分,其他答案均不得分)
(4) 定容时用胶头滴管滴加蒸馏水时,胶头滴管不能伸入容量瓶内(2 分) 移液时,玻璃棒顶端应该
在容量瓶刻度线以下(2 分)
(5)B(2 分, 多选、少选均不得分)
18.
(共14 分)
(1)
(2 分,不加气体符号扣1 分,不写条件扣1 分,配平错误不得分)
(2) 蒸发浓缩(2 分) 冷却结晶(2 分)
(3)CO2和NaCl(2 分,各1 分)
(4)稀硝酸和硝酸银溶液(HNO3和AgNO3)(2 分,各1 分)
(5)92%(2 分)
(6)D(2 分,其他答案均不得分)
19.
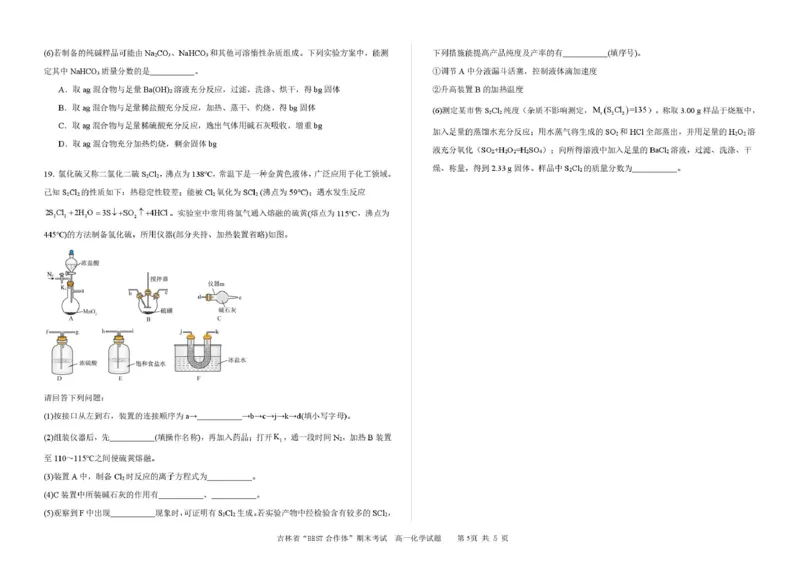
(共15 分)
(1)h→i→f→g(2 分)
(2)检查装置气密性(1 分)
(3)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O(2 分,不加气体符号扣1 分,不写条件扣1 分,配平错误不得
分)
(4)吸收未反应的氯气防止污染空气(2 分)吸收空气中的水蒸气,防止其进入装置F 使氯化硫水解(2
分)
(5)金黄色液体(2 分) ①(2 分)
(6)90%(2 分)
1.C
【详解】A.彩烟中含有彩色物质和N2等,属于混合物,A 错误;
B.蒸汽遇冷凝结成雾,是气态变为液态的液化过程,是物理变化,B 错误;
C.蒸汽遇冷形成的雾属于胶体中的气溶胶,是一种分散系,C 正确;
D.飞机拉烟原理是吊舱中的彩色物质被加压
吹出,送入高温燃气中,形成“彩烟”,而丁达尔效应是由
于胶体粒子对光的散射作用产生的,这两种现象原理不相同,D 错误;
故选C。
2.A
【详解】A.硝酸是酸,氢氧化钾是碱,碳酸钙是盐,二氧化硫属于酸性氧化物,氧化钙属于碱性氧化
物,A 正确;
B.一氧化碳不是酸性氧化物,属于不成盐氧化物,B 错误;
C.Cu2(OH)2CO3属于盐类,不属于碱,过氧化钠不是碱性氧化物,是过氧化物,C 错误;
D.Mn2O7,不是碱性氧化物,是酸性氧化物,D 错误;
故选A。
3.D
【详解】A.
与
的最简式均为
,则所组成的混合气体中N、O 原子个数为1:2,
中
m(O)=2.3×
=1.6g,所含氧原子总数为
,故A 正确;
B.过氧化钠与
反应的化学方程式为2
+2Na2O2=2Na2CO3+O2,
过氧化钠的物质的量为
0.5mol,与足量
反应时,2Na2O2~O2~2e-,则转移电子数为
,故B 正确;
C.
的
水溶液中
的物质的量为0.1mol,
含有的氧原子数为
,
但水中也有氧原子,所以氧原子数大于
,故C 正确;
D.
明矾
溶液体积未知,无法计算Al3+的物质的量,无法计算完全反应生成
胶粒数,故D 错误;
故答案为:D。
4.A
【详解】A.若Na 和水反应放热,大试管内温度升高,气体膨胀,U 型管内红墨水左侧液面降低、右侧
液面升高,故A 能达到实验目的;
B.应透过蓝色钴玻璃观察钾元素的焰色,故B 不能达到实验目的;
C.固体钠在空气中燃烧应用坩埚,不能用烧杯,故C 不能达到实验目的;
D.比较Na2CO3、NaHCO3的稳定性,应该把碳酸氢钠放在温度较低的小试管内,碳酸钠放在温度较高的
大试管内,故D 不能达到实验目的;
答案选A。
5.C
【详解】A.
的氧化性弱于
,故
不能将
氧化成
,A 正确;
B.
、
的氧化性依次减弱,铁离子会氧化碘离子为碘单质,然后碘单质使淀粉变蓝,B 正确;
C.
、
、
的氧化性依次减弱,因为I-的还原性强于Fe2+,所以氯气通入FeI2溶液中,氯气先氧
化碘离子为碘单质,后氧化亚铁离子为铁离子,所以不可能存在反应
,C 错
误;
D.
、
的氧化性依次减弱,则
会氧化氯离子为氯气,
被还原为钴离子,因此可以用
制氯气,反应的方程式为:
(浓)
,D 正确;
答案选C。
6.
C
【详解】A.根据前面分析试剂a 是铁、试剂b 是稀盐酸,故A 错误;
B.操作Ⅰ、操作Ⅱ都是过滤,所用仪器相同,操作Ⅲ是蒸发结晶,所用一起和操作Ⅰ、操作Ⅱ不相同,
故B 错误;
C.试剂c 是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl-,故C 正确;
D.Cl-能使酸性高锰酸钾溶液褪色,因此不能用酸性KMnO4溶液可检验溶液W 中是否还有Fe2+,故D
错误。
综上所述,答案为A。
7.B
【详解】A.反应I 的方程式为
,该反应中氧化剂是氧气,还原剂
是硫酸亚铁,氧化剂和还原剂的物质的量之比为1:4,A 正确;
B.反应过程中,不断向体系中通入二氧化硫,最终转化成硫酸,反应的总方程式为
,硫酸的浓度会增大,B 错误;
C.根据总反应式
,每脱除1 mol SO2,溶液中H+的物质的量增加 2 mol,C 正
确;
D.反应Ⅱ是铁离子和二氧化硫发生氧化还原反应生成二价铁离子和硫酸的过程,反应的离子方程式为
,D 正确;
答案选B。
8.D
【详解】A.同温同压下,密度与摩尔质量成正比,三种气体密度最大的是Z,故A 错误;
B.没有明确分子构成,原子数目相同的三种气体,不能确定物质的量大小,则不能确定质量大小,故B
错误;
C.25℃、101kPa 条件下,三种气体体积均为2.24L。则它们的物质的量均小于0.1mol;0℃、101kPa 条件
下,三种气体体积均为2.24L,它们的物质的量均为0.1mol,故C 错误;
D.2gY 气体的物质的量为
, 1gZ 气体的物质的量
,2gY 气体和1gZ 气
体的物质的量比为4:1,同温同体积,其压强比为4∶1,故D 正确;
选D。
9.A
【详解】A.Al(OH)3既能与强酸反应又能与强碱反应,所以Al(OH)3为两性氢氧化物,故A 正确;
D.向某溶液中滴加BaCl2溶液,生成白色沉淀,再加入盐酸,沉淀不溶解,该溶液中含有SO
或Ag+,
故D 错误;
选A。
10.A
【详解】A.由于浓KOH 溶液过量,所以
溶液中的
、
完全反应.故化学方程式:
,
、KOH 和
均可以拆,故离子方程式为:
,故A 正确;
B.明矾溶液中滴加
溶液,恰好使
沉淀完全,得出明矾和
的比例为1:2,故离子
方程式为:
,故B 错误;
C.向
溶液中通入足量氯气后,
和
均被完全氧化,故化学方程式:
,离子方程式为:
,故C 错误;
答案选A。
11.C
【详解】A.a 为O2,O2可与灼热的铜反应生成黑色的氧化铜,A 正确;
B.b 为H2O,水蒸气可与红热的铁在高温下反应生成四氧化三铁和氢气,B 正确;
C.c 为CO2,镁条在CO2中燃烧生成氧化镁和碳,燃烧的镁条不熄灭,C 错误;
D.d 为Cl2,Cl2可与碘化钾反应生成碘单质,碘单质能使湿润的淀粉试纸变蓝,D 正确;
答案选C。
12.B
【详解】A.反应①中Mn 元素的化合价由+7 价降至+2 价,I 元素的化合价由-1 价升至0 价,根据得失电
子守恒、原子守恒和电荷守恒,反应①的离子方程式是:10I-+2
+16H+=2Mn2++5I2+8H2O,故
n(Mn2+)∶n(I2)=2∶5,A 项错误;
B.根据反应①可得关系式10I-~2
,可以求得n=0.0002,则反应②的
n(I-)∶n(
)=0.001∶(10×0.0002)=1∶2,反应②中Mn 元素的化合价由+7 价降至+4 价,反应②对应的关系
式为I-~2
~MnO2~
~6e-,
中I 元素的化合价为+5 价,根据离子所带电荷数等于正负化合价的
代数和知x=3,反应②的离子方程式是:I-+2
+H2O=2MnO2↓+
+2OH-,B 项正确;
C.已知
的氧化性随酸性减弱而减弱,对比反应①和②的产物,I-的还原性随酸性减弱而增强,C
项错误;
D.根据反应①和②的离子方程式知,反应①消耗H+、产生水、pH 增大,反应②产生OH-、消耗水、
pH 增大,D 项错误;
答案选B。
13.A
【详解】A.钠离子、钙离子、镁离子等阳离子被氢离子代替,根据电荷守恒可知,经过阳离子交换树脂
后,水中阳离子总数增加,A 错误;
B.阴离子被氢氧根离子代替,水中的NO 、SO
、Cl-通过阴离子树脂后被除去,B 正确;
C.通过净化处理后,溶液中离子的浓度降低,水的导电性降低,C 正确;
D.水能发生部分电离,属于弱电解质,D 正确;
故选A。
14.C
【详解】A.同周期元素,从左到右原子半径依次减小,则C、O、F 的原子半径大小顺序为C>O>F,
故A 正确;
B.同周期元素,从左到右元素的非金属性依次增强,同主族元素,从上到下元素的非金属性依次减弱,
则C、O、Si 的非金属性强弱顺序为O>C>Si,故B 正确;
C.位于元素周期表右上角的氟元素的非金属性最强,单质具有很强的氧化性,故C 错误;
D.原子序数为82 的元素为铅元素,与硅元素都位于元素周期表ⅣA 族,故D 正确;
故选C。
15.D
【详解】A.反应产生的
和
使气囊变大,将Ⅲ中的气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水
的体积即为产生
和
的总体积,所以滴加稀硫酸前必须关闭
,打开
,选项A 错误;
B.加入酸后Q 中发生反应的化学方程式为
、
,反应产生
和
,球形干燥管b 中应装有碱石灰,用于除
去气体中的
,选项B 错误;
C.由B 分析可知量筒Ⅰ中水的体积即为产生
和
的总体积,量筒Ⅱ收集的是
的体积,选项C 错
误;
答案选D。
16.
(1)②③⑤⑥⑨ ①⑧⑨
(2)C
(3)①
(4)
(5)ad
【详解】(1)由上述分析可知②③⑤⑥⑨。
(2)由上述分析可知 ①⑧⑨。
(3)A.磷酸与氢氧化钠反应能生成
、
、
3 种盐,A 错误;
B.
、
是酸式盐,
是正盐,B 错误;
C.磷酸是三元酸、亚磷酸是二元酸、次磷酸是一元酸,C 正确;
D.根据分析,
既有氧化性又具有还原性,D 错误;
答案选C。
(4)曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,根据图知,b 点溶液溶质为NaOH:
;d 点②中溶质为Na2SO4:
;
(5)由分析知a 点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;b 点溶液溶质为NaOH;c 点①中
稀硫酸过量,溶质为硫酸,d 点②中溶质为Na2SO4,a、b、c、d 四点对应的溶液中呈中性的是ad。
17.(1)②⑧①⑥④⑤⑦③
(2)71.6
(3)20.0
(4)定容时用胶头滴管滴加蒸馏水时,胶头滴管不能伸入容量瓶内 移液时,玻璃棒顶端应该在容量瓶
刻度线以下
(5)B
【详解】(1)配制溶液时,步骤为计算、称量、溶解、冷却、转移、洗涤、定容、摇匀,顺序为
②⑧①⑥④⑤⑦③。
(2)配制240mL3mol/L 的过氧化脲溶液,需要使用250mL 的容量瓶,则需要过氧化脲的物质的量为
0.25L×3mol/L=0.75mol,质量为0.75mol×94g/mol÷0.985=71.6g。
(3)稀释前后溶质的物质的量不变,则需要量取3mol/L 的过氧化脲溶液的体积为
0.1L×0.6mol/L÷3mol/L=20mL。
(4)定容时用胶头滴管滴加蒸馏水时,胶头滴管不能伸入容量瓶内,这是第一处错误;移液时,玻璃棒
顶端应该在容量瓶刻度线以下,这是第二处错误。
(5)A.用量筒量取3mol/L 的过氧化脲溶液时仰视读数,导致量取的过氧化脲溶液的体积偏大,溶液浓
度偏高,A 错误;
B.摇匀后发现液面下降,补加蒸馏水至刻度线,溶液的体积偏大,浓度偏低,B 正确;
C.定容时俯视刻度线,导致溶液的体积偏小,浓度偏大,C 错误;
D.容量瓶内有少量蒸馏水对溶液的配制没有影响,D 错误;
故答案选B。
18.(1)
(2)蒸发浓缩 冷却结晶
(3)CO2和NaCl
(4)稀硝酸和硝酸银溶液(HNO3和AgNO3)
(5)92%
(6)D
【详解】(1)碳酸氢钠受热分解生成碳酸钠、CO2和水,则步骤III 煅烧碳酸氢钠的化学方程式为
;
(2)根据
和
溶解度曲线,
的溶解度随温度升高变化很大,而
的溶解度随温度升
高变化很小,从混合溶液中得
,系列操作IV 包括:通入
、加入
固体,蒸发浓缩、冷却
结
晶、过滤、洗涤、干燥;
(3)据以上分析此可知,煅烧碳酸氢钠生成的CO2和获得的母液食盐水可循环利用,所以可以循环使用
的物质有:CO2和NaCl;
(4)根据“AgCl 是白色既不溶于水、也不溶于稀HNO3的物质,而Ag2CO3是白色沉淀,只是不溶于水,
但能够溶于HNO3的性质”检验Na2CO3中Cl-的存在;因此检验产品Na2CO3中是否含有氯离子,需要的试
剂有稀硝酸和硝酸银溶液(HNO3和AgNO3);
(5)对固体
充分加热,产生二氧化碳和水蒸气,反应的化学方程式为:
将气体先通过足量浓硫酸,吸收水蒸气,再通过足量
,
与二氧化碳反应生成碳酸钠和氧气,化学方程式为:
,根据方程式以及
差量法可知,当增重0.560g(0.02mol CO 的质量)时,消耗的二氧化碳的物质的量为0.02mol,根据关系式
可知,消耗的
的物质的量为0.04mol,所以固体
的质量为
0.04mol
g/mol
g;故
的纯度为
。
(6)若只含有碳酸钠和碳酸氢钠,加足量稀盐酸充分反应后bg 固体为氯化钠的质量,设碳酸钠的物质的
量为x、碳酸氢钠的物质的量为y,则106x+84y=a,2x+y=
,解方程计算出a、b,然后可计算出混合
物中碳酸氢钠的质量分数,由于含有其他可溶惰性杂质组成,则不能计算NaHCO3质量分数;
【详解】A.碳酸钠和碳酸氢钠均能与氢氧化钡溶液反应生成碳酸钡沉淀,结合分析,由于含有其他可溶
惰性杂质组成,则不能计算NaHCO3质量分数,A 错误;
B.由分析,不能计算NaHCO3质量分数,B 错误;
C.碳酸钠、碳酸氢钠均会和稀硫酸生成二氧化碳气体被碱石灰吸收,结合分析,由于含有其他可溶惰性
杂质组成,则不能计算NaHCO3质量分数,C 错误;
D.只有碳酸氢钠加热分解,由差量法可计算碳酸氢钠的质量,然后再计算碳酸氢钠的质量分数, D 正
确;
19.(1)h→i→f→g
(2)检查装置气密性
(3)MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
(4)吸收未反应的氯气,防止污染空气,同时吸收空气中的水蒸气,防止其进入装置F,使一氯化硫水解
(5)金黄色液体 ①
(6)90%
【详解】(1)根据分析可知:接口从左到右,装置的连接顺序为a→h→i→f→g→b→c→j→k→d→e;
(2)组装仪器后,首先要检查装置气密性,然后加入药品,打开K1,一段时间N2,排出装置的空气,加
热B 装置至110~115℃之间使硫黄熔融,发生反应;
(3)在装置A 中用浓盐酸与MnO2混合加热制备Cl2,反应的离子方程式为:MnO2+4H++2Cl-
Mn2+
+Cl2↑+2H2O;
(4)在C 装置中所装碱石灰的作用有吸收未反应的氯气,防止污染空气,同时吸收止空气中的水蒸气,
防止其进入装置F,使氯化硫水解;
(5)观察到F 中出现金黄色液体现象时,可证明有S2Cl2生成;若实验产物中,经检验含有较多的
SCl2。
①调节A 中分液漏斗活塞,控制液体滴加速度,控制氯气的生成速率,可以减少SCl2的生成,①正确;
②S2Cl2的热稳定性较差,升高装置B 的加热温度,S2Cl2会分解,降低S2Cl2的生成,③错误;
故合理选项是①;
(6)根据题意有反应:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,SO2+H2O2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl
,有关系式:2S2Cl2~SO2~BaSO4,则样品中S2Cl2的质量百分含量为
=90%。