文档内容
3.1.2 铁的氢氧化物,铁盐亚铁盐 练习(原卷版)
1.实验室制取氢氧化铁的一组试剂是( )
A.氯化铁溶液和烧碱溶液 B.氧化铁和烧碱溶液
C.氧化铁和水 D.铁和水蒸气
2.在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是
A.生成物为氢氧化铁 B.该反应是化合反应
C.该反应是氧化还原反应 D.氢氧化亚铁作氧化剂
3.把一定量铁粉放入FeCl 溶液中,过滤,除去杂质,在滤液中加入适量硝酸,再加入过量氨水,有红褐
3
色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A.Fe(OH) ;FeO B.Fe(OH) ; Fe O
2 3 2 3
C.Fe O ;Fe(OH) D.Fe(OH) Fe(OH) ; Fe O
2 3 3 3 2 3 4
4.将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.有黄绿色气体产生 D.无明显变化
5.下列有关铁及其化合物的说法正确的是( )
A.铁的氧化物有FeO、Fe O、Fe O,它们都是黑色的固体
2 3 3 4
B.铁的氢氧化物Fe(OH) 、Fe(OH) 的混合物可能是灰绿色
2 3
C.鉴别Fe2+中混有Fe3+,可先加入Cl 水,再加入KSCN溶液
2
D.铁的合金生铁比纯铁硬度大,熔点高。
6.为了检验某FeCl 溶液是否变质,可向溶液中加入( )
2
A.KSCN溶液 B.铁片 C.NaOH溶液 D.石蕊溶液
7.往FeCl 溶液中滴加溴水,溶液变为黄色,下列说法正确的是
2
A.由于溶液存在Br ,所以溶液为黄色
2
B.往所得溶液中加入硫氰化钾溶液,可判断是否生成了Fe3+
C.往所得溶液中加入足量氢氧化钾溶液,不能判断是否生成了Fe3+
D.往所得溶液中加入淀粉碘化钾溶液,可判断是否生成了Fe3+
8.对铁及其化合物的叙述不正确的是( )
A.可用KSCN溶液检验Fe3+ B.Fe(OH) 能在空气中稳定存在
2
C.Fe能从CuSO 溶液中置换出Cu D.Fe O 与Al可发生铝热反应
4 2 3
9.阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素 C,可使食物中的铁离子还原成亚铁
离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____。
A.Fe B.Fe2+ C.Fe3+
(2)工业盐的主要成分是NaNO ,曾多次发生过因误食NaNO 而中毒的事件,其原因是NaNO 把人体内
2 2 2
的Fe2+转化为Fe3+而失去与O 结合的能力,这说明NaNO 具有___性。下列不能实现上述转化的物质是
2 2
____。
A.Cl B.O C.FeCl D.KMnO (H+)
2 2 3 4
(3)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有_____性。
(4)在Fe+4HNO(稀)===Fe(NO ) +NO↑+2HO的反应中,HNO 表现了____性和_____性,则56g Fe参
3 3 3 2 3
加反应时,被还原的HNO 为____g。
3
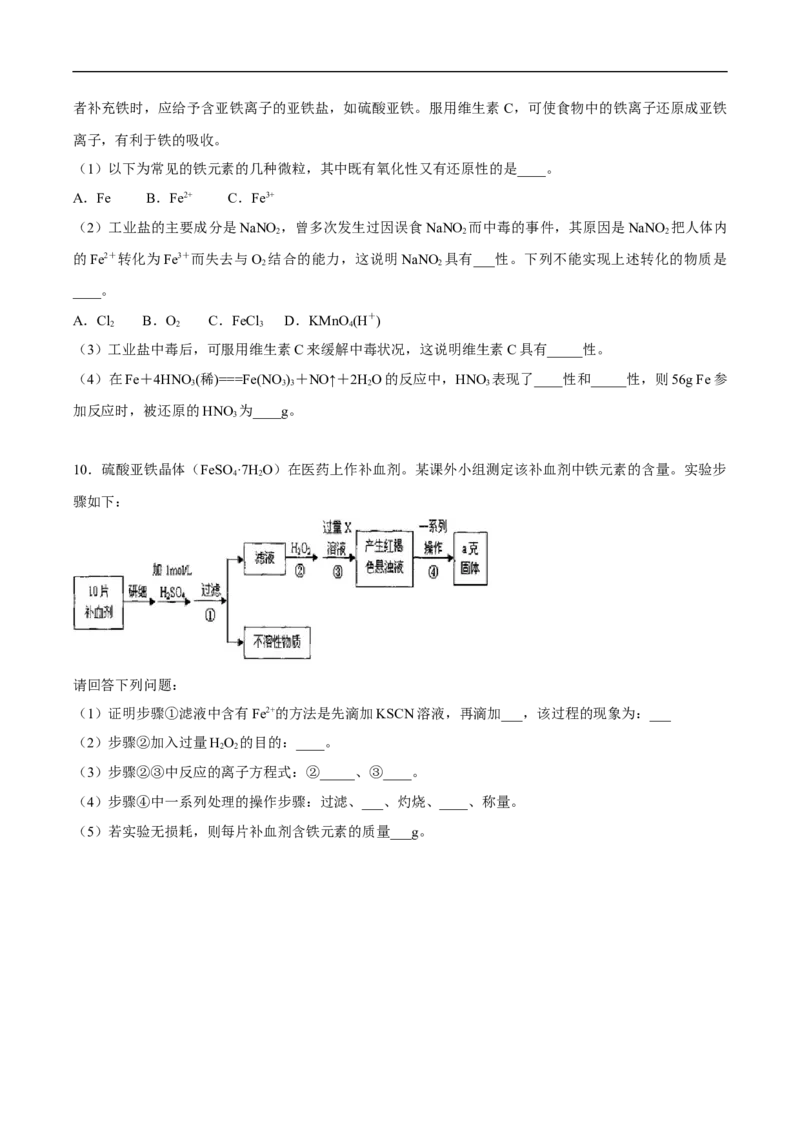
10.硫酸亚铁晶体(FeSO ·7H O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步
4 2
骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加___,该过程的现象为:___
(2)步骤②加入过量HO 的目的:____。
2 2
(3)步骤②③中反应的离子方程式:②_____、③____。
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、____、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量___g。