文档内容
8.1.2 海水资源的开发利用 煤、石油和天然气的综合利用
练习(解析版)
1.下列有关石油、煤、天然气的叙述正确的是 ( )
A.石油分馏可得到汽油、煤油和柴油等,裂解可得到乙烯、丙烯等
B.煤中含有的苯、甲苯等,煤干馏可得到芳香烃,石油的催化重整也可得到芳香烃
C.石油的分馏、煤的气化和液化都属于化学变化
D.石油、煤、天然气、可燃冰、沼气都属于化石燃料
【答案】A
【详解】
A.石油分馏可以得到汽油、煤油等产品,裂解得到乙烯等化工产品,A正确;
B.煤中不含有的苯、甲苯,煤干馏发生复杂的物理、化学变化后可得焦炭、煤焦油、粗氨水、焦
炉气,其中焦炉气、煤焦油中含有芳香烃;芳香烃也可以来自于石油的催化重整,B错误;
C.煤的气化生成CO和氢气,液化生成甲醇,均为化学变化,而石油分馏与混合物沸点有关,为
物理变化,C错误;
D.石油、煤、天然气、可燃冰都属于化石燃料,沼气不是化石燃料,D错误。
答案选A。
2.下列说法错误的是
A.石油的催化重整是获得芳香烃的主要途径
B.煤焦油中含有苯、二甲苯等化工原料
C.天然气和可燃冰的主要成分都是甲烷
D.石油裂解的主要目的是为了得到更多的汽油
【答案】D
【详解】
A.石油的催化重整可以得到芳香烃,是得到芳香烃的主要途径,A正确,不选;
B.煤的干馏产物煤焦油中含有苯和二甲苯,苯、二甲苯等为重要的化工原料,B正确,不选;
C.天然气主要成分为甲烷,可燃冰为天然气水合物化学式CH₄·nH₂O,主要成分为甲烷,C正确,
不选;
D.石油裂化的目的是为了得到更多的汽油,石油裂解的目的是为了得到乙烯等化工原料,D错误,
符合题意。
答案选D。
3.海带中含有碘元素。从海带中提取的碘的步骤如下:
①海带焙烧成灰加入水搅拌②过滤③向滤液中加入稀HSO 和HO ④加入CCl 萃取⑤分液。下列
2 4 2 2 4
说法中不正确的是( )
A.步骤②中用到的玻璃仪器有漏斗、烧杯、玻璃棒
B.步骤③中涉及的离子方程式为:2I-+H O+2H+=I +2H O
2 2 2 2
C.步骤④中可用酒精代替CCl
4D.步骤⑤中获得I 从分液漏斗下口倒出
2
【答案】C
【详解】
A.步骤②为过滤,所需要的玻璃仪器为:漏斗、玻璃棒、烧杯,故A不符合题意;
B.步骤③中碘离子被双氧水氧化生成碘,发生的离子反应为:2I-+H O+2H+=I +2H O,故B不符
2 2 2 2
合题意;
C.步骤④为萃取,酒精与水互溶,不能用酒精代替,故C符合题意;
D.四氯化碳的密度比水的密度大,萃取后有机层在下层,获得I 从分液漏斗下口放出,故D不符
2
合题意;
故答案为:C。
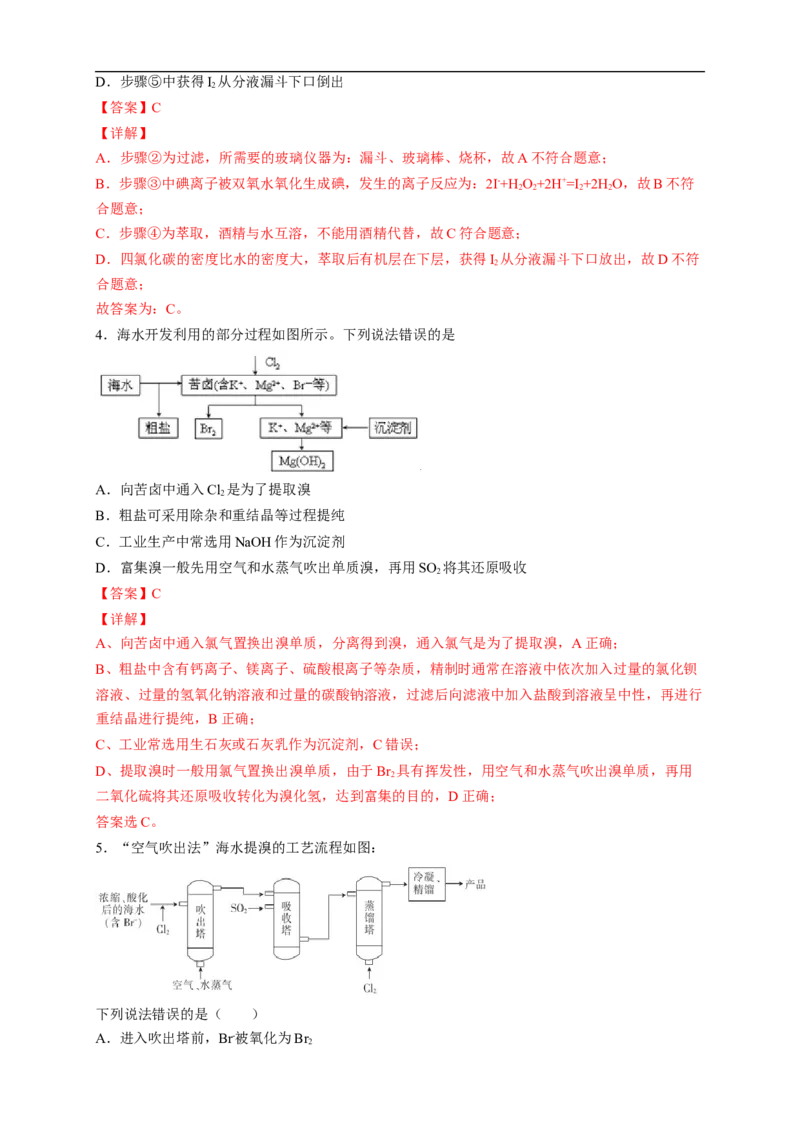
4.海水开发利用的部分过程如图所示。下列说法错误的是
A.向苦卤中通入Cl 是为了提取溴
2
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO 将其还原吸收
2
【答案】C
【详解】
A、向苦卤中通入氯气置换出溴单质,分离得到溴,通入氯气是为了提取溴,A正确;
B、粗盐中含有钙离子、镁离子、硫酸根离子等杂质,精制时通常在溶液中依次加入过量的氯化钡
溶液、过量的氢氧化钠溶液和过量的碳酸钠溶液,过滤后向滤液中加入盐酸到溶液呈中性,再进行
重结晶进行提纯,B正确;
C、工业常选用生石灰或石灰乳作为沉淀剂,C错误;
D、提取溴时一般用氯气置换出溴单质,由于Br 具有挥发性,用空气和水蒸气吹出溴单质,再用
2
二氧化硫将其还原吸收转化为溴化氢,达到富集的目的,D正确;
答案选C。
5.“空气吹出法”海水提溴的工艺流程如图:
下列说法错误的是( )
A.进入吹出塔前,Br-被氧化为Br
2B.从吹出塔进入吸收塔的物质为混合物
C.蒸馏塔中只发生了物理变化
D.经过吸收塔后,溴元素得到富集
【答案】C
【详解】
A.通入氯气发生2Br-+Cl=2Cl-+Br ,溴易挥发,可热空气吹出,则进入吹出塔前,Br-被氧化为
2 2
Br ,故A正确;
2
B.从吹出塔进入吸收塔的物质为混合物,含二氧化硫、溴、水等,在吸收塔中发生
Br +SO+2H O═4H++SO2-+2Br-,故B正确;
2 2 2 4
C.蒸馏塔中发生的反应为2Br-+Cl=2Cl-+Br ,为化学变化,故C错误;
2 2
D.经过吸收塔后,可将溶液中的Br-浓度远大于进入吹出塔之前的海水中的 Br-溴浓度,因此得
到了富集,故D正确;
故答案为C。
6.从海水中提取镁的工艺流程可表示如下:
下列说法不正确的是( )。
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl 时阴极产生氯气
2
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合、分解和复分解反应
【答案】B
【详解】
A.海水中镁元素含量高,原料来源于海水,提取镁原料来源丰富,故A正确;
B.电解熔融MgCl 可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e-=Mg,故B
2
错误;
C.MgCl •6HO在一定条件下加热得到无水MgCl ,若直接加热MgCl •6HO,会促进Mg2+水解,
2 2 2 2 2
得不到无水MgCl ,因Mg2+水解呈酸性,在氯化氢气流中可抑制Mg2+水解,同时带走水蒸气,故
2
一定条件为在HCl气流中,目的是抑制Mg2+水解,故C正确;
D.上述工艺流程中涉及②为分解反应③为化合反应,④为复分解反应,⑤⑥为复分解反应,⑦为
分解反应,故D正确;
故选B。
7.下列关于煤和石油的加工过程属于物理变化的是A.煤的干馏 B.煤的汽化和液化
C.石油的分馏 D.石油的裂化和裂解
【答案】C
【详解】
A.煤的干馏是将煤隔绝空气加强热使其分解的过程,有新物质生成,属于化学变化,故A错误;
B.煤经过气化生成水煤气,液化生成甲醇,有新物质生成,都属于化学变化,由水煤气加工得到液态烃和
甲醇,有新物质生成,属于化学变化,故B错误;
C.石油的分馏是控制各物质沸点的不同来实现物质的分离的方法,属于物理变化过程,所以C选项是
正确的;
D.石油的催裂化和裂解是在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质
量较小、沸点较低的烃的过程,属于化学变化,故D错误。
所以C选项是正确的。
8.下列说法不正确的是( )
A.煤中含有苯、甲苯、二甲苯等化合物,这些物质可以通过煤的干馏,从煤焦油中蒸馏而得
B.石油催化裂化是为提高轻质油的产量与质量,裂化制得的汽油能使溴水和酸性高锰酸钾溶液褪
色
C.石油、煤、天然气是属于一次能源
D.沼气的主要成分是甲烷,是一种生物质能
【答案】A
【详解】
A.煤的干馏是隔绝空气加强热使之分解,是化学变化,煤中不含有苯、甲苯、二甲苯,A错误;
B.是由裂化的目的是得到更多的轻质油,此汽油中含有不饱和键,能使溴水和酸性高锰酸钾溶液
褪色,B正确;
C.一次能源是指自然界中以原有形式存在的、未经加工转换的能量资源,又称天然能源,石油、
煤、天然气均属一次能源,C正确;
D.沼气的主要成分为甲烷,因沼气来自于微生物的作用,微生物提供的能量叫做生物质能,D正
确;
故选A。
9.海洋是一个巨大的资源宝库,海水开发利用的部分过程如图所示。下列有关说法不正确的是(
)
A.①粗盐制精盐除采用过滤泥沙外,还必须除去 Ca2+、Mg2+、SO 2-等杂质
4
B.工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤
C.第②步的反应是将 MgCl •6H O 晶体在空气中直接加热脱去结晶水得无水 MgCl
2 2 2
D.第③步到第⑤步空气吹出法提取海水中溴通常使用 SO 作还原剂
2
【答案】C【详解】
A. ①粗盐制精盐除采用过滤泥沙外,还必须除去Ca2+、Mg2+、SO 2−等杂质,故A正确;
4
B. 利用沉淀溶解平衡转化,工业生产中常选用石灰乳作为 Mg2+的沉淀剂,并对沉淀进行洗涤,故
B正确;
C. 镁离子要水解,因此第②步的反应是将 MgCl ⸱6H O 晶体在HCl气流中加热脱去结晶水得无水
2 2
MgCl ,故C错误;
2
D. 第③步到第⑤步空气吹出法提取海水中溴通常使用SO 作还原剂,SO 与Br 反应生成HBr和
2 2 2
HSO ,故D正确;
2 4
答案为C。
10.海带中提取碘的实验中,下列物质分离方法未涉及的是( )
A.灼烧 B.萃取
C.过滤 D.蒸发
【答案】D
【详解】
①用称取5g干海带,用刷子把海带表面的附着物(不要用水洗),用酒精润湿后,放在坩埚中,海带
表面有较多白色的附着物,不用水洗是为了防止海带中的碘化物溶于水而损失。用酒精润湿是为了
让海带充分燃烧;
②把坩埚置于泥三角上,用酒精灯加热灼烧海带成至成灰,停止加热,自然冷却干海带烧成的白色
灰烬,将有机碘化物转化为无机碘化物;
③将海带灰转移到小烧杯中,加入20ml蒸馏水,搅拌,煮沸2~3min,使可溶物溶解,冷却。海带
灰煮沸时溶液浑浊,使碘离子进入溶液;
④过滤,收集滤液,弃去滤渣,得到含碘离子的溶液;
⑤向滤液中滴入1mL氯水,振荡,溶液由无色变为棕黄色,氯气将碘离子氧化成碘单质;
⑥将氧化后溶液转移到分液漏斗中,向其中加入2mL四氯化碳,振荡,静置。加入四氯化碳振荡
后溶液分层,有色层在下层,碘单质在有机溶剂中的溶解度比在水中大。
综上所述,海带中提取碘的实验中涉及到灼烧、萃取、过滤,没有涉及到蒸发,答案选D。
11.下列关于石油的说法正确的是
A.石油属于可再生矿物能源 B.石油主要含有碳、氢两种元素
C.石油裂解气的主要成分是甲烷 D.石油分馏的各馏分均是纯净物
【答案】B
【详解】
A.煤、石油、天然气均是不可再生矿物能源,A错误;
B.石油成分很复杂,主要含C、H两种元素,B正确;
C.石油裂解气的主要成分是乙烯,C错误;
D.石油分馏的产物有:石油气、汽油、煤油、柴油、沥青等物质,各馏分均是混合物,D错误。
答案选B。
12.将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮的氧化物等,带来严重
的环境污染。煤干馏是提高煤利用率、生产重要化工原料、降低污染物排放量的有效措施之一。
某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如下,请回答有关问题:(1)煤干馏的条件是________________________________________________________
(2)盛有冷水的烧杯的作用是________________________________________________。
(3)实验后检验生成粗氨水的操作是_________________________________________。
(4)已知一氧化碳不能使溴水褪色,若将具支试管出来的气体通入溴水中,发现溴水褪色,则说
明产生了_____________________________________________________________。
(5)检验具支试管出来的气体的性质后,将尾气点燃,火焰的颜色为______________。
(6)从煤焦油中分离出苯及其同系物的实验方法是_________________________________________。
【答案】隔绝空气加强热 使粗氨水和煤焦油冷凝 将具支试管取出加热,用事先润湿的红色
石蕊试纸放在试管口,若试纸变蓝,则产生了粗氨水 乙烯等不饱和烃类物质 淡蓝色 蒸
馏
【详解】
(1)据煤干馏的定义可知其条件为隔绝空气加强热;
(2)冷水浴的作用是冷凝,使粗氨水和煤焦油冷凝下来;
(3) 实验后检验生成粗氨水的操作是将具支试管取出加热,用事先润湿的红色石蕊试纸放在试管口,
若试纸变蓝,则产生了粗氨水;
(4)溴水褪色,证明煤干馏时产生了乙烯等不饱和的烃类物质;
(5) 检验具支试管出来的气体的性质后,将尾气点燃,CO、C H 等燃烧时火焰呈淡蓝色;
2 4
(6)煤焦油中苯及其同系物与其他成分互溶,故只能通过分馏的方法将其分离。
13.海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的
问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷
却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+HO―→NaOH+H↑+Cl↑(未
2 2 2
配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸
1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的
方法。该方法流程如下:请写出②④的化学反应方程式:______,________。
【答案】ⅠA 物理变化 NaCl 585 NaOH+SO ===NaHSO NaHSO +
2 3 3
HCl===NaCl+HO+SO ↑
2 2
【详解】
(1)Na为11号元素,位于周期表中第3周期、第ⅠA族,故答案为ⅠA;
(2) 蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水,没有新物质生成,因此蒸馏法属于物
理变化,故答案为:物理变化;
(3)电解饱和食盐水的化学方程式为:2NaCl+2HO 2NaOH+H↑+Cl↑,食盐的化学式为
2 2 2
NaCl ,制取盐酸的化学方程式为H+Cl 2HCl,由n(HCl)=
2 2
,可知m(NaCl)=107 mol×58.5 g·mol-1=585×106 g=585 t,故
答案为:NaCl ;585;
(4)由流程可看出用氢氧化钠溶液吸收含SO 的废气,产物为亚硫酸氢钠,化学方程式为NaOH+
2
SO ===NaHSO ;亚硫酸氢钠与氯化氢反应可得到氯化钠并回收SO ,化学方程式为NaHSO+
2 3 2 3
HCl===NaCl+HO+SO ↑,故本题答案为:NaOH+SO ===NaHSO ;NaHSO+HCl===NaCl+
2 2 2 3 3
HO+SO ↑。
2 2