文档内容
第五章 化工生产中的重要非金属元素
单元测试卷
时间:90分钟 满分:100分
一、 选择题(本题共12小题,每小题4分,共48分。每小题只有一个选项符合题意)
1.氮的固定是指( )
A.植物从土壤中吸收氮肥
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
C.将空气中的氮气转变为氮的化合物
D.硝酸和氨气反应生成氮肥
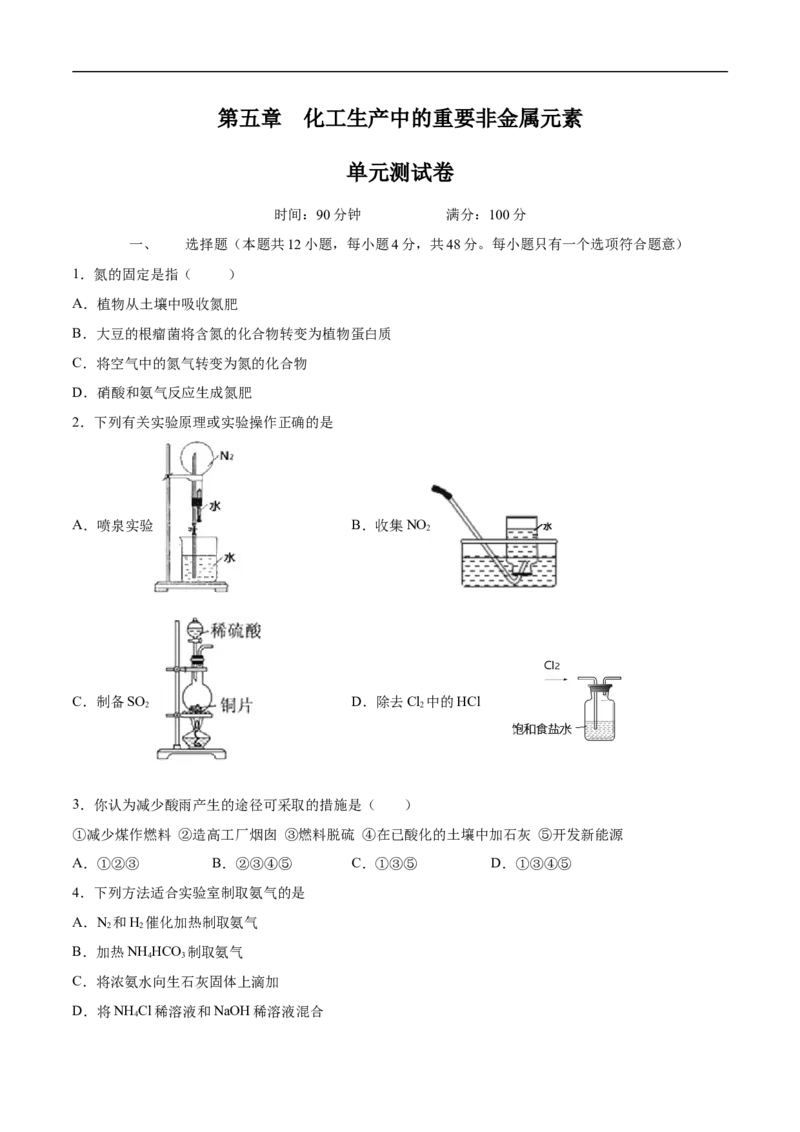
2.下列有关实验原理或实验操作正确的是
A.喷泉实验 B.收集NO
2
C.制备SO D.除去Cl 中的HCl
2 2
3.你认为减少酸雨产生的途径可采取的措施是( )
①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
4.下列方法适合实验室制取氨气的是
A.N 和H 催化加热制取氨气
2 2
B.加热NH HCO 制取氨气
4 3
C.将浓氨水向生石灰固体上滴加
D.将NH Cl稀溶液和NaOH稀溶液混合
45.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
6.下列关于化学与生产、生活的认识错误的是
A.CO、SO 、N 等均是造成温室效应的气体
2 2 2
B.节能减排符合低碳经济的要求
C.使用清洁能源是防止酸雨发生的重要措施之一
D.大量焚烧田间秸秆会污染空气
7.下列离子的检验方法中,正确的是
A.先用盐酸酸化,再加AgNO 溶液产生白色沉淀,则原溶液中存在Cl-离子
3
B.先加过氧化氢溶液,再加硫氰化钾溶液,产生血红色,则原溶液中存在Fe2+离子
C.加入足量的盐酸溶液,产生无色无味的气体,且能使澄清石灰水变浑浊,则原溶液中存在CO2-离子
3
D.加入过量盐酸酸化,无沉淀产生,再加入BaCl 溶液,产生白色沉淀,则说明原溶液中存在SO 2-离子
2 4
8.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的一水合氨少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
9.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 陈述Ⅰ 陈述Ⅱ
A S有可燃性 S在纯氧中燃烧生成SO
3
B SiO 有导电性 SiO 可用于制备光导纤维
2 2
C 浓硫酸有强氧化性 浓硫酸可用于干燥H 和CO
2
D Fe3+有氧化性 FeCl 溶液可用于回收废旧电路板中的铜
3
A.A B.B C.C D.D
10.下列物质都具有漂白性,漂白原理与其它几种不同的是( )
A.氯水 B.SO C.HO D.HClO
2 2 2
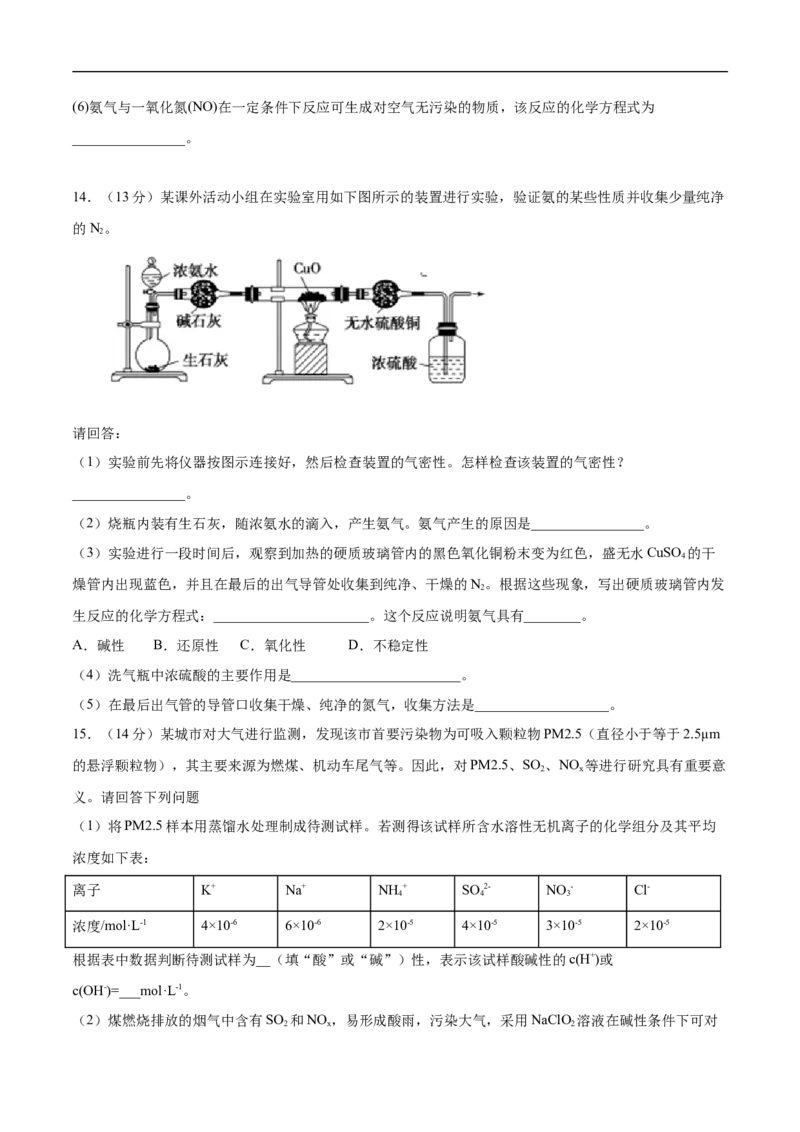
11.下图是进行气体性质实验的常用装置,液体一定不能充满试管的是A.若a为水,b是HCl B.若a为水,b是NO
2
C.若a为水(滴有酚酞),b是NH D.若a为NaOH溶液,b是Cl
3 2
12.如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2 mol/L
B.1 mol Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 mol/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 mol
二、非选择题
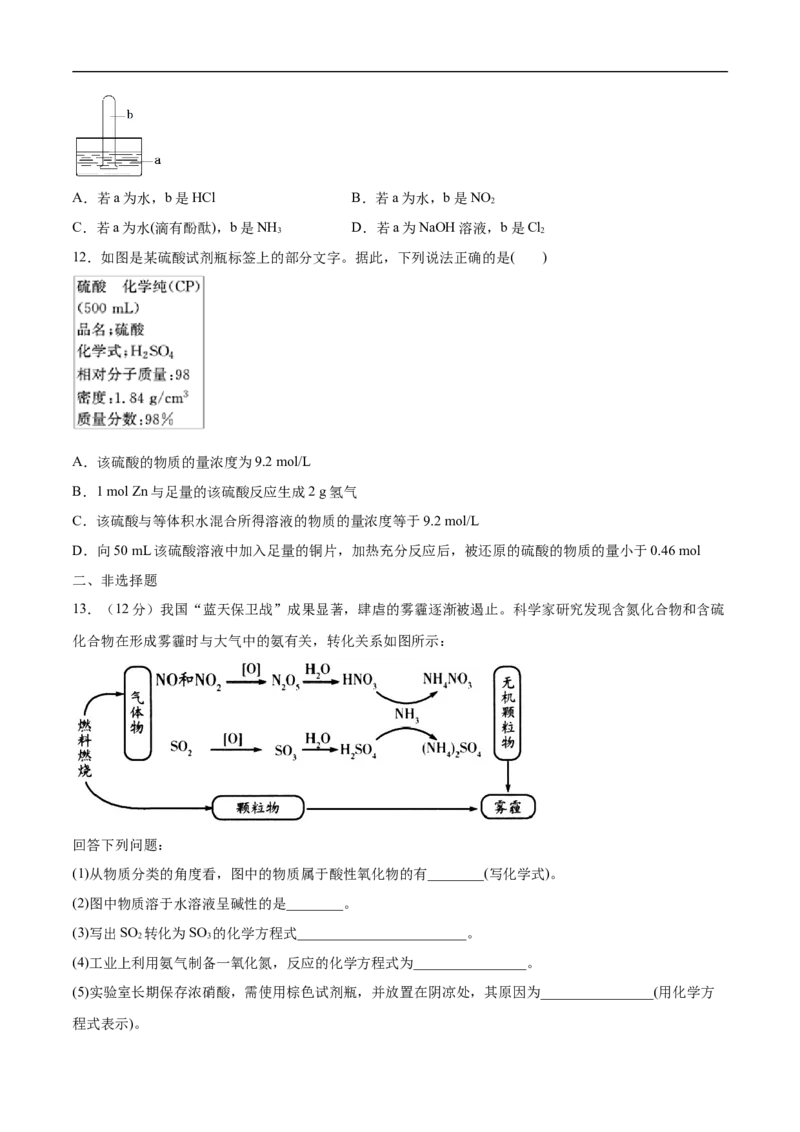
13.(12分)我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫
化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO 转化为SO 的化学方程式________________________。
2 3
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方
程式表示)。(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为
________________。
14.(13分)某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净
的N。
2
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?
________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO 的干
4
燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N。根据这些现象,写出硬质玻璃管内发
2
生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
15.(14分)某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm
的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO 、NO 等进行研究具有重要意
2 x
义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均
浓度如下表:
离子 K+ Na+ NH + SO 2- NO - Cl-
4 4 3
浓度/mol·L-1 4×10-6 6×10-6 2×10-5 4×10-5 3×10-5 2×10-5
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或
c(OH-)=___mol·L-1。
(2)煤燃烧排放的烟气中含有SO 和NO ,易形成酸雨,污染大气,采用NaClO 溶液在碱性条件下可对
2 x 2烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO -+(____)NO+(____)OH-=(____)Cl-+(____)NO -+______
2 3
(3)为减少SO 对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO 。
2 2
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO 的是__(填字母代号)。
2
a.Ca(OH) b.Na CO c.CaCl d.NaHSO
2 2 3 2 3
(4)汽车尾气中NO 和CO的生成及转化。
x
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、
无毒性的两种气体,其化学反应方程式为___。
16.(15分)硫酸型酸雨的形成原理可简化表示如下:
回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO 的性质,可让工厂的烟道气通过________除去SO ,达到减少污染的目的。
2 2
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不
变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源