文档内容
高一化学必修第一册同步单元AB卷(新教材人教版)
高一化学上学期期末模拟卷(一)
说明:本试卷分选择题非选择题,满分100分,考试时间90分钟。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56
一、选择题:本题共20个小题,每小题2分。共40分,在每小题给出的四个选项中,只有一项是符合题
目要求的。
1. 下列有关物质分类的叙述正确的是
A.CaCl 、NaOH、HCl、HD四种物质都属于化合物
2
B.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
C.溶液、浊液、胶体都属于混合物
D.CO、CO等非金属氧化物均属于酸性氧化物
2
2. 下列物质间的转化需要通过氧化还原反应才能实现的是
A. CO→NaHCO B.Fe(OH) →Fe(OH)
2 3 2 3
C. CaCO →NaCO D.CuO→Cu(NO )
3 2 3 3 2
3. 下列反应的离子方程式书写正确的是
A.用稀硫酸清洗铁锈(Fe O):Fe O+6H+===2Fe3++3HO
2 3 2 3 2
B.铝片与硝酸汞溶液反应:Al+Hg2+===Al3++Hg
C.硫酸铜溶液和氢氧化钡溶液混合:Ba2++SO===BaSO ↓
4
D.碳酸氢钙溶液与盐酸反应:Ca(HCO )+2H+===Ca2++2HO+2CO↑
3 2 2 2
4. 某运载火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,二者剧烈反应产生大
量气体并释放出大量的热,该反应的化学方程式为R+2NO===3N ↑+4HO↑+2CO↑,则下列叙述错误的
2 4 2 2 2
是
A. 此反应是氧化还原反应
B. 反应瞬间产生大量高温气体,推动火箭飞行
C. 在反应中NO 作还原剂
2 4
D. R的分子式为C HN
2 8 2
5. 下列说法正确的是
A.78 g Na O 固体中阴、阳离子总数为4N
2 2 A
B.7.8 g Na O 与水反应,转移0.2N 电子
2 2 A
B. NaO 与CO 反应:2NaO+2CO===2Na CO+O,则NaO 与SO 反应:
2 2 2 2 2 2 2 3 2 2 2 2
2NaO+2SO ===2Na SO +O
2 2 2 2 3 2
D.将NaO 投入到紫色石蕊试液中,溶液先变蓝后褪色
2 2
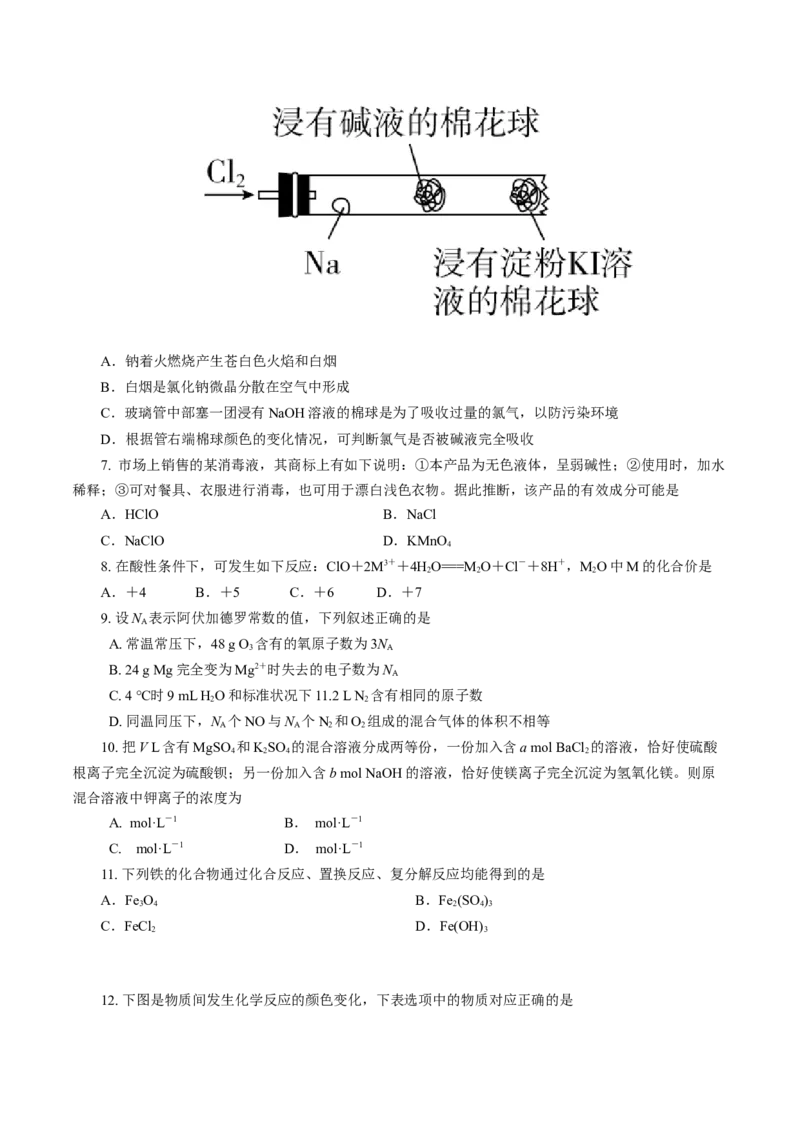
6. 某兴趣小组设计“氯气与金属钠反应”的装置。实验操作:先给钠预热,到钠熔融成圆球时,停止
加热,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是A.钠着火燃烧产生苍白色火焰和白烟
B.白烟是氯化钠微晶分散在空气中形成
C.玻璃管中部塞一团浸有NaOH溶液的棉球是为了吸收过量的氯气,以防污染环境
D.根据管右端棉球颜色的变化情况,可判断氯气是否被碱液完全吸收
7. 市场上销售的某消毒液,其商标上有如下说明:①本产品为无色液体,呈弱碱性;②使用时,加水
稀释;③可对餐具、衣服进行消毒,也可用于漂白浅色衣物。据此推断,该产品的有效成分可能是
A.HClO B.NaCl
C.NaClO D.KMnO
4
8. 在酸性条件下,可发生如下反应:ClO+2M3++4HO===M O+Cl-+8H+,MO中M的化合价是
2 2 2
A.+4 B.+5 C.+6 D.+7
9. 设N 表示阿伏加德罗常数的值,下列叙述正确的是
A
A. 常温常压下,48 g O 含有的氧原子数为3N
3 A
B. 24 g Mg完全变为Mg2+时失去的电子数为N
A
C. 4 ℃时9 mL H O和标准状况下11.2 L N 含有相同的原子数
2 2
D. 同温同压下,N 个NO与N 个N 和O 组成的混合气体的体积不相等
A A 2 2
10. 把V L含有MgSO 和KSO 的混合溶液分成两等份,一份加入含a mol BaCl 的溶液,恰好使硫酸
4 2 4 2
根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原
混合溶液中钾离子的浓度为
A. mol·L-1 B. mol·L-1
C. mol·L-1 D. mol·L-1
11. 下列铁的化合物通过化合反应、置换反应、复分解反应均能得到的是
A.Fe O B.Fe (SO )
3 4 2 4 3
C.FeCl D.Fe(OH)
2 3
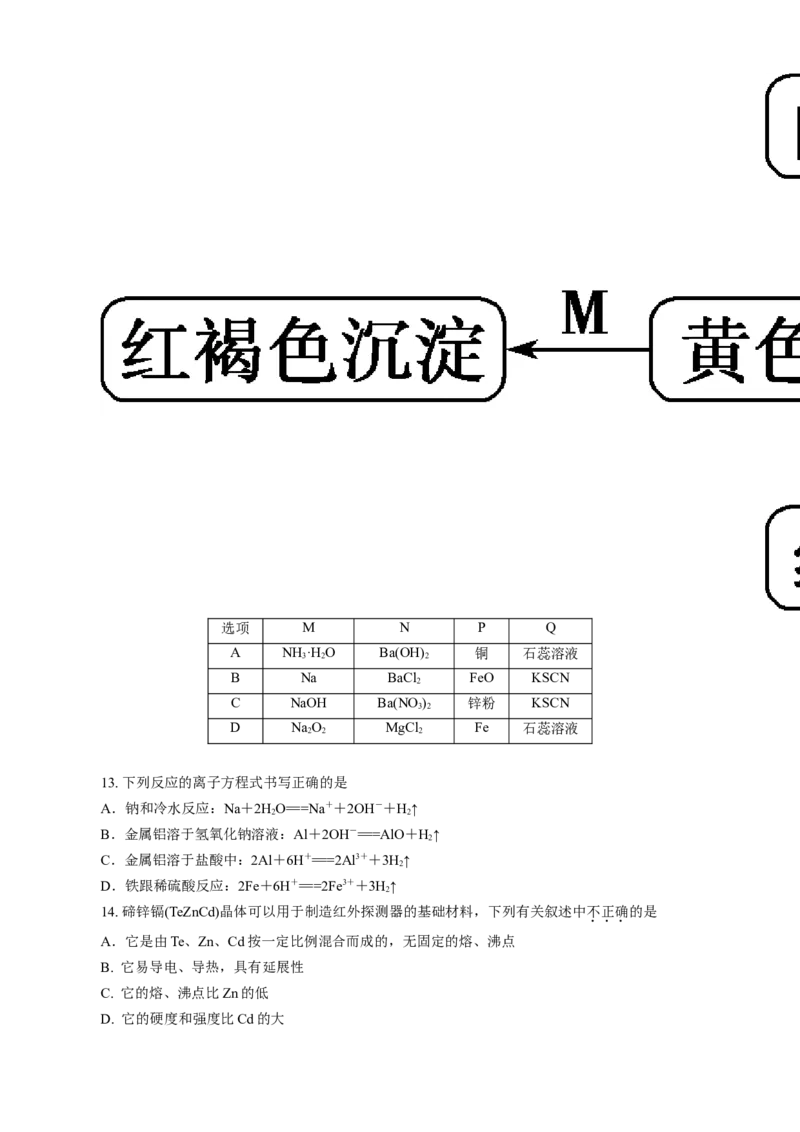
12. 下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是选项 M N P Q
A NH ·H O Ba(OH) 铜 石蕊溶液
3 2 2
B Na BaCl FeO KSCN
2
C NaOH Ba(NO ) 锌粉 KSCN
3 2
D NaO MgCl Fe 石蕊溶液
2 2 2
13. 下列反应的离子方程式书写正确的是
A.钠和冷水反应:Na+2HO===Na++2OH-+H↑
2 2
B.金属铝溶于氢氧化钠溶液:Al+2OH-===AlO+H↑
2
C.金属铝溶于盐酸中:2Al+6H+===2Al3++3H↑
2
D.铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H↑
2
14. 碲锌镉(TeZnCd)晶体可以用于制造红外探测器的基础材料,下列有关叙述中不正确的是
A.它是由Te、Zn、Cd按一定比例混合而成的,无固定的熔、沸点
B. 它易导电、导热,具有延展性
C. 它的熔、沸点比Zn的低
D. 它的硬度和强度比Cd的大15. 在自然界中,锗有70Ge、72Ge等多种稳定的核素。下列有关说法中正确的是
A.70Ge、72Ge互称同素异形体
B.70Ge、72Ge互称同位素
C.70Ge、72Ge的核外电子排布不同
D.70Ge、72Ge的质子数、质量数、核外电子数相等
16. 铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同主族元素,元素符号是
Tl,以下对铊的性质的推断不正确的是
A.铊是易导电的银白色金属
B.能生成+3价离子化合物
C.Tl(OH) 是两性氢氧化物
3
D.Tl3+的氧化能力比Al3+弱
17. 现有如下说法:
①在水分子内氢、氧原子间均以化学键相结合;②金属和非金属化合一定形成离子键;③离子键是阳
离子和阴离子化合而形成的;④根据电离方程式 HCl===H++Cl-,可知HCl分子里存在离子键;⑤H 分
2
子和Cl 分子的反应过程是H 、Cl 分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的
2 2 2
过程。
上述各种说法正确的是
A.①②⑤正确 B.都不正确
C.④正确,其他不正确 D.仅①正确
18. 如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是
A.Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由Z与X两种元素组成的化合物能与水反应
19. 四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,
X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。
下列说法正确的是
A.简单离子半径:WZ
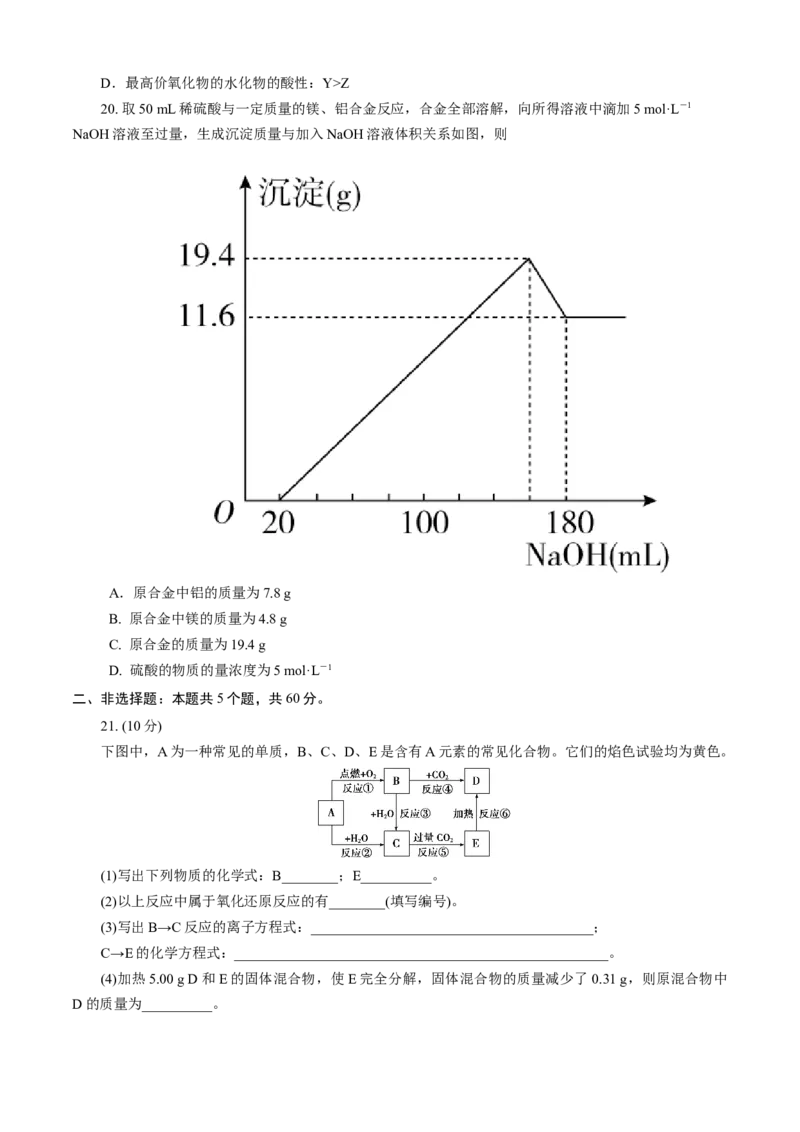
20. 取50 mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol·L-1
NaOH溶液至过量,生成沉淀质量与加入NaOH溶液体积关系如图,则
A.原合金中铝的质量为7.8 g
B. 原合金中镁的质量为4.8 g
C. 原合金的质量为19.4 g
D. 硫酸的物质的量浓度为5 mol·L-1
二、非选择题:本题共5个题,共60分。
21. (10分)
下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。
(1)写出下列物质的化学式:B________;E__________。
(2)以上反应中属于氧化还原反应的有________(填写编号)。
(3)写出B→C反应的离子方程式:________________________________________;
C→E的化学方程式:_____________________________________________________。
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中
D的质量为__________。22. (12分)
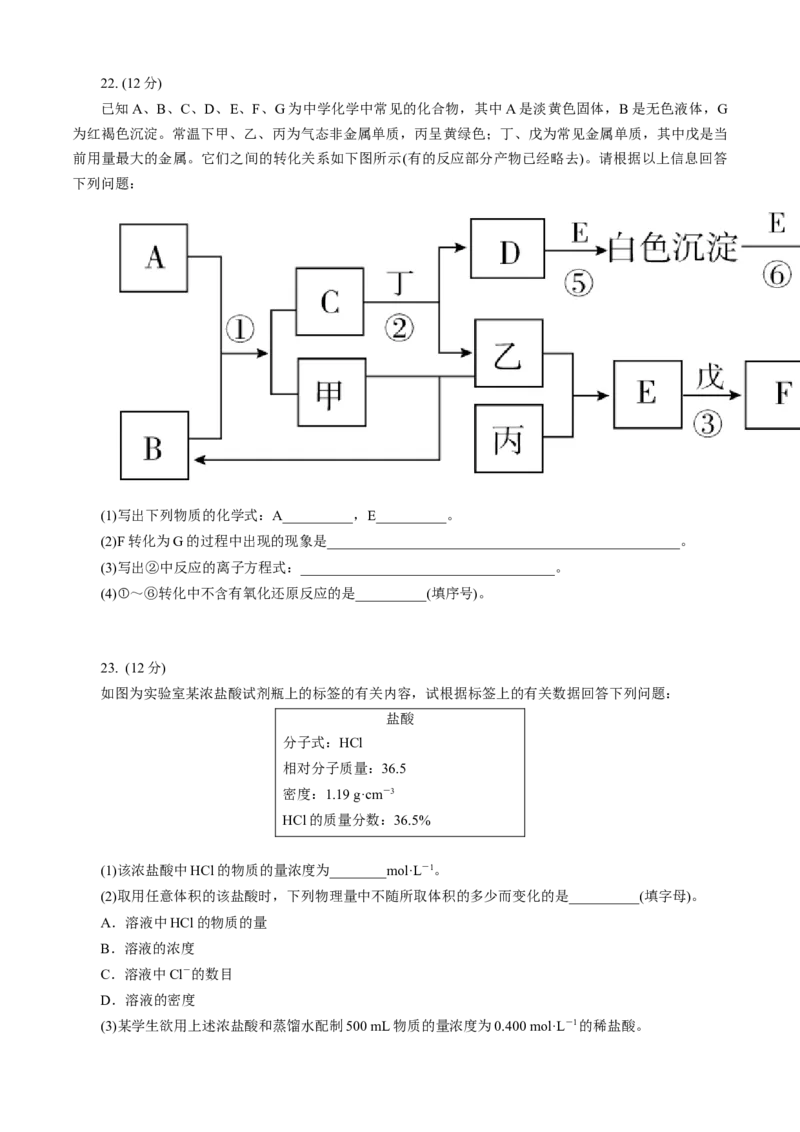
已知A、B、C、D、E、F、G为中学化学中常见的化合物,其中A是淡黄色固体,B是无色液体,G
为红褐色沉淀。常温下甲、乙、丙为气态非金属单质,丙呈黄绿色;丁、戊为常见金属单质,其中戊是当
前用量最大的金属。它们之间的转化关系如下图所示(有的反应部分产物已经略去)。请根据以上信息回答
下列问题:
(1)写出下列物质的化学式:A__________,E__________。
(2)F转化为G的过程中出现的现象是__________________________________________________。
(3)写出②中反应的离子方程式:____________________________________。
(4)①~⑥转化中不含有氧化还原反应的是__________(填序号)。
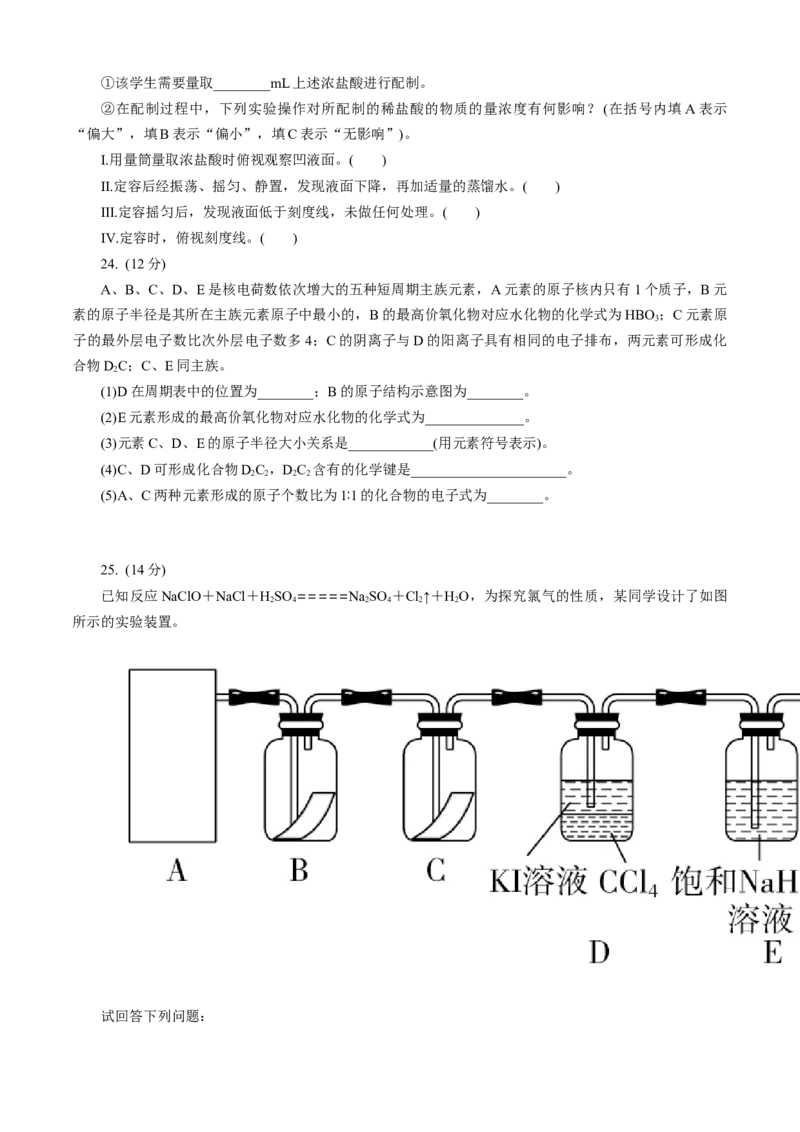
23. (12分)
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19 g·cm-3
HCl的质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是__________(填字母)。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液中Cl-的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。①该学生需要量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示
“偏大”,填B表示“偏小”,填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面。( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
Ⅲ.定容摇匀后,发现液面低于刻度线,未做任何处理。( )
Ⅳ.定容时,俯视刻度线。( )
24. (12分)
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元
素的原子半径是其所在主族元素原子中最小的,B的最高价氧化物对应水化物的化学式为HBO ;C元素原
3
子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化
合物DC;C、E同主族。
2
(1)D在周期表中的位置为________;B的原子结构示意图为________。
(2)E元素形成的最高价氧化物对应水化物的化学式为______________。
(3)元素C、D、E的原子半径大小关系是____________(用元素符号表示)。
(4)C、D可形成化合物DC ,DC 含有的化学键是______________________。
2 2 2 2
(5)A、C两种元素形成的原子个数比为1∶1的化合物的电子式为________。
25. (14分)
已知反应NaClO+NaCl+HSO =====NaSO +Cl↑+HO,为探究氯气的性质,某同学设计了如图
2 4 2 4 2 2
所示的实验装置。
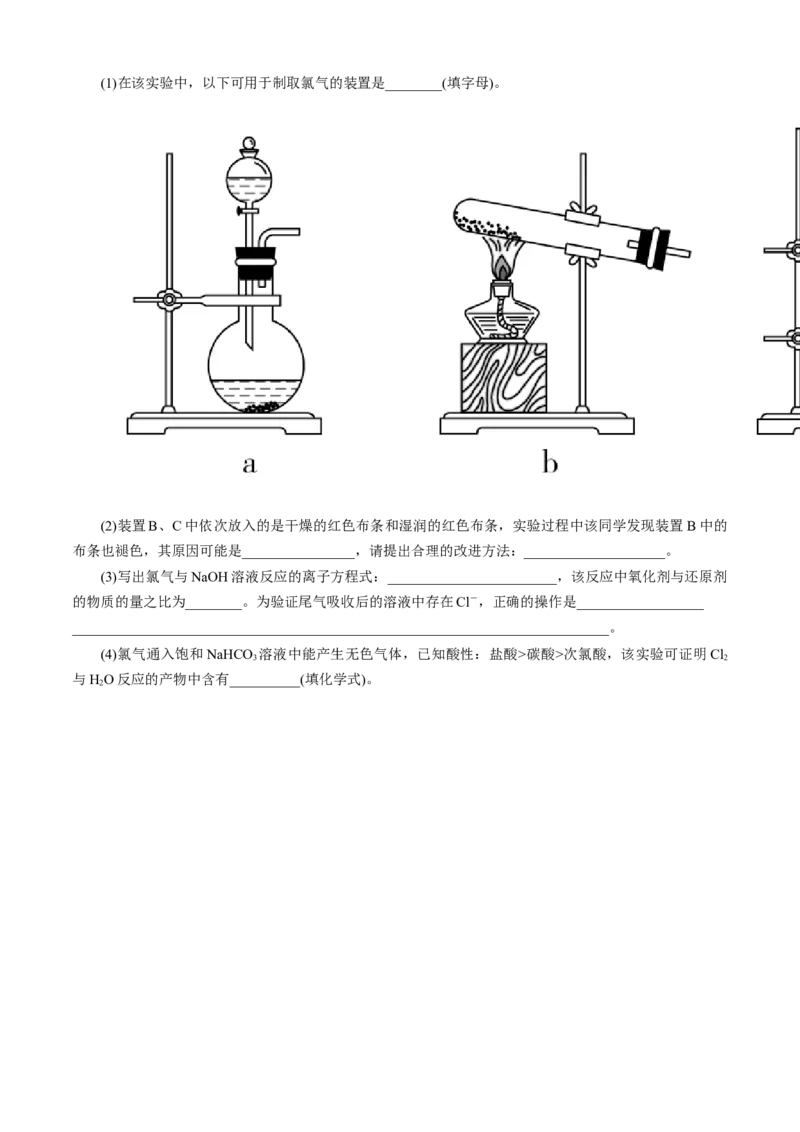
试回答下列问题:(1)在该实验中,以下可用于制取氯气的装置是________(填字母)。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的
布条也褪色,其原因可能是________________,请提出合理的改进方法:____________________。
(3)写出氯气与NaOH溶液反应的离子方程式:________________________,该反应中氧化剂与还原剂
的物质的量之比为________。为验证尾气吸收后的溶液中存在Cl-,正确的操作是__________________
____________________________________________________________________________。
(4)氯气通入饱和NaHCO 溶液中能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验可证明Cl
3 2
与HO反应的产物中含有__________(填化学式)。
2