文档内容
第二章 分子结构与性质
第一节 共价键
一、共价键
(一)共价键的形成与特征
1、共价键的形成
(1)概念:原子间通过_______________所形成的相互作用,叫做共价键。
(2)成键的粒子:一般为 _______________ 原子(相同或不相同)或金属原子与非金属原子。
(3)本质:原子间通过 _______________ (即原子轨道重叠)产生的强烈作用。
2、共价键的特征
(1)饱和性:按照共价键的_______________理论,一个原子有几个 _______________ ,便可和几个
_______________ 的 电子配对成键,这就是共价键的饱和性。
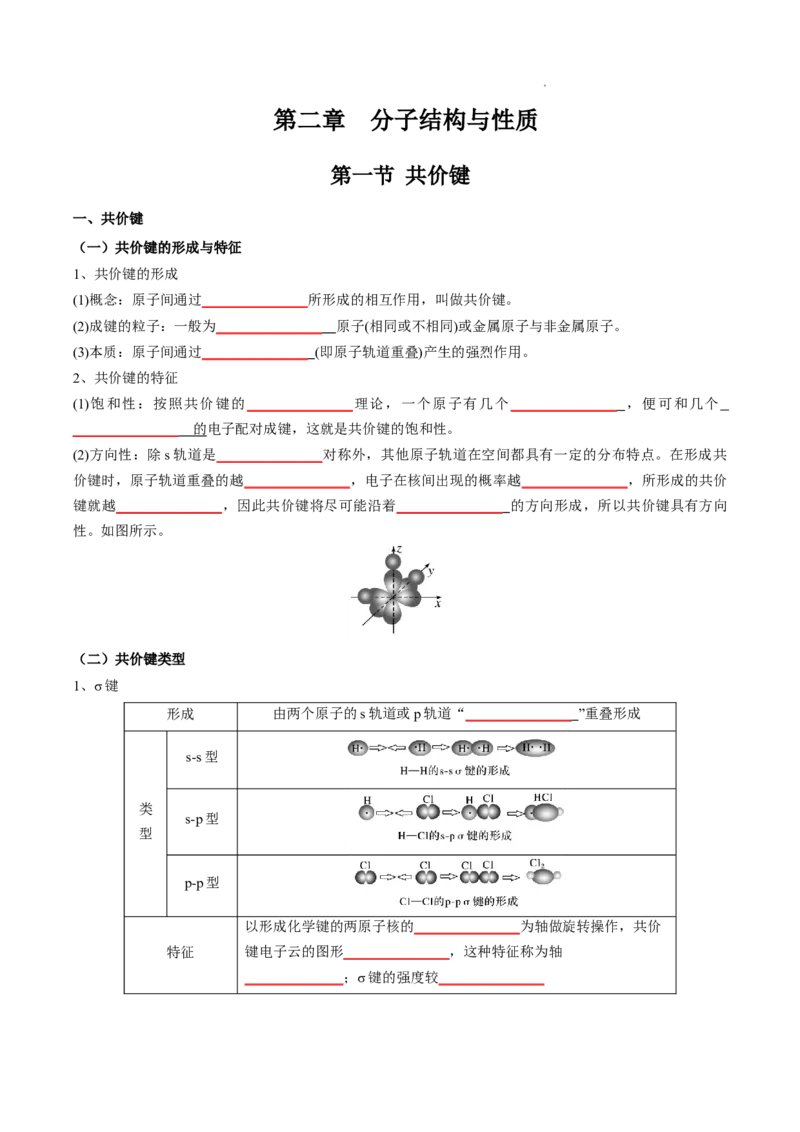
(2)方向性:除s轨道是_______________对称外,其他原子轨道在空间都具有一定的分布特点。在形成共
价键时,原子轨道重叠的越_______________,电子在核间出现的概率越_______________,所形成的共价
键就越_______________,因此共价键将尽可能沿着 _______________ 的方向形成,所以共价键具有方向
性。如图所示。
(二)共价键类型
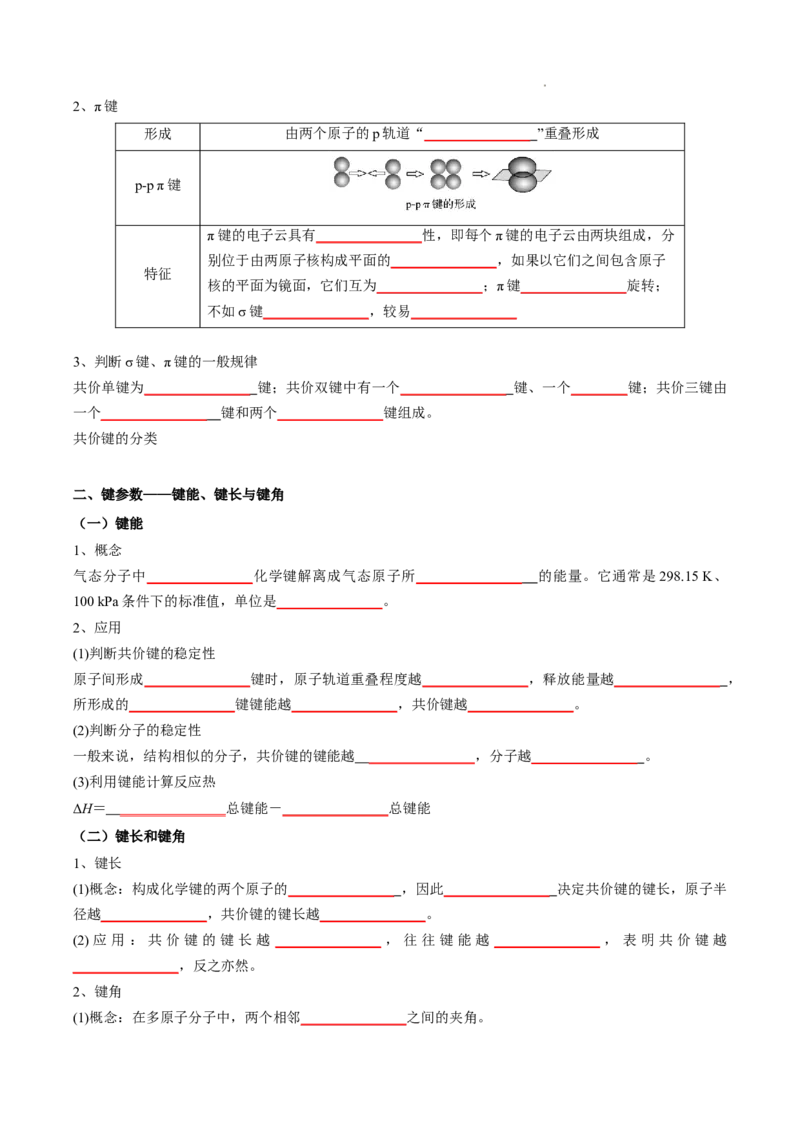
1、σ键
形成 由两个原子的s轨道或p轨道“ _______________ ”重叠形成
s-s型
类
s-p型
型
p-p型
以形成化学键的两原子核的_______________为轴做旋转操作,共价
特征 键电子云的图形_______________,这种特征称为轴
______________;σ键的强度较_______________
学科网(北京)股份有限公司2、π键
形成 由两个原子的p轨道“ _______________ ”重叠形成
p-p π键
π键的电子云具有_______________性,即每个π键的电子云由两块组成,分
别位于由两原子核构成平面的_______________,如果以它们之间包含原子
特征
核的平面为镜面,它们互为_______________;π键_______________旋转;
不如σ键_______________,较易_______________
3、判断σ键、π键的一般规律
共价单键为 _______________ 键;共价双键中有一个 _______________ 键、一个________键;共价三键由
一个 _______________ 键和两个_______________键组成。
共价键的分类
二、键参数——键能、键长与键角
(一)键能
1、概念
气态分子中_______________化学键解离成气态原子所 _______________ 的能量。它通常是298.15 K、
100 kPa条件下的标准值,单位是_______________。
2、应用
(1)判断共价键的稳定性
原子间形成_______________键时,原子轨道重叠程度越_______________,释放能量越 _______________ ,
所形成的_______________键键能越_______________,共价键越_______________。
(2)判断分子的稳定性
一般来说,结构相似的分子,共价键的键能越 ______________ _,分子越 _______________ 。
(3)利用键能计算反应热
ΔH= ______________ _总键能-_______________总键能
(二)键长和键角
1、键长
(1)概念:构成化学键的两个原子的 _______________ ,因此 _______________ 决定共价键的键长,原子半
径越_______________,共价键的键长越_______________。
(2)应用:共价键的键长越 _______________,往往键能越 _______________,表明共价键越
_______________,反之亦然。
2、键角
(1)概念:在多原子分子中,两个相邻_______________之间的夹角。
学科网(北京)股份有限公司(2)应用:在多原子分子中键角是一定的,这表明共价键具有_______________性,因此键角影响着共价分
子的 ______________ _。
(3)试根据空间结构填写下列分子的键角
分子的空间结构 键角 实例
正四面体形 _______________ CH、CCl
4 4
平面形 _______________ 苯、乙烯、BF 等
3
三角锥形 107° NH
3
V形(角形) _______________ HO
2
直线形 _______________ CO、CS、CH≡CH
2 2
(4)部分键角图解
第二节 分子的空间结构
一、分子结构的测定
1、早年科学家主要靠对物质的 _______________ 进行系统总结得出规律后进行推测,现代科学家应用了
许多测定分子结构的现代仪器和方法,如 _______________ 、晶体 ______________ _ 衍射等。
2、红外光谱在测定分子结构中的应用
分子中的原子不是_______________的,而是不断地振动着的。当一束红外线透过分子时,分子会吸收跟
它的某些_______________的振动频率相同的红外线,再记录到图谱上呈现 _______________ 。通过和已
有 _______________ 比对,或通过_______________计算,可以得知各吸收峰是由哪种 _______________ 、
哪种_______________方式引起的,综合这些信息,可分析分子中含有何种 _______________ 或
_______________ 的信息。
3、质谱法在测定分子相对分子质量中的应用
现代化学常利用质谱仪测定分子的_______________质量。它的基本原理是在质谱仪中使分子失去电子变
成带_______________的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压
电场_______________后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行
系统分析,便可得知样品分子的_______________质量。
二、多样的分子空间结构
1、三原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
________
CO O==C==O _______________
2
_______
学科网(北京)股份有限公司________
HO _______________
2
_______
2、四原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
CHO 约120° _______________
2
__________
NH _______________
3
_____
3、五原子分子
化学式 电子式 结构式 键角 空间结构 空间结构名称
__________
CH _______________
4
_____
__________
CCl _______________
4
_____
4、其他多原子分子的空间结构
三、价层电子对互斥模型
1、价层电子对互斥模型(VSEPR model):对AB 型的分子或离子,中心原子A的价层电子对(包括成键的
n
_______________和未成键的_______________)之间由于存在排斥力,将使分子的空间结构总是采取电子对
_______________最弱的那种结构,以使彼此之间_______________最小,分子或离子的体系能量最
_______________,最稳定。
2、价层电子对的计算
(1)中心原子价层电子对数=_______________。
(2) σ键电子对数的计算
学科网(北京)股份有限公司由化学式确定,即中心原子形成几个_______________键,就有几对_______________键电子对。如HO分
2
子中, O有_______________对_______________键电子对。NH 分子中, N有 _______________ 对
3
_______________键电子对。
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数=(a-xb)
①a表示中心原子的价电子数;
对主族元素:a=_______________;
对于阳离子:a=_______________;
对于阴离子:a= _______________ 。
②x表示与 _______________ 结合的原子数。
③b表示与中心原子结合的原子最多能接受的_______________,氢为1,其他原子= _______________ 。
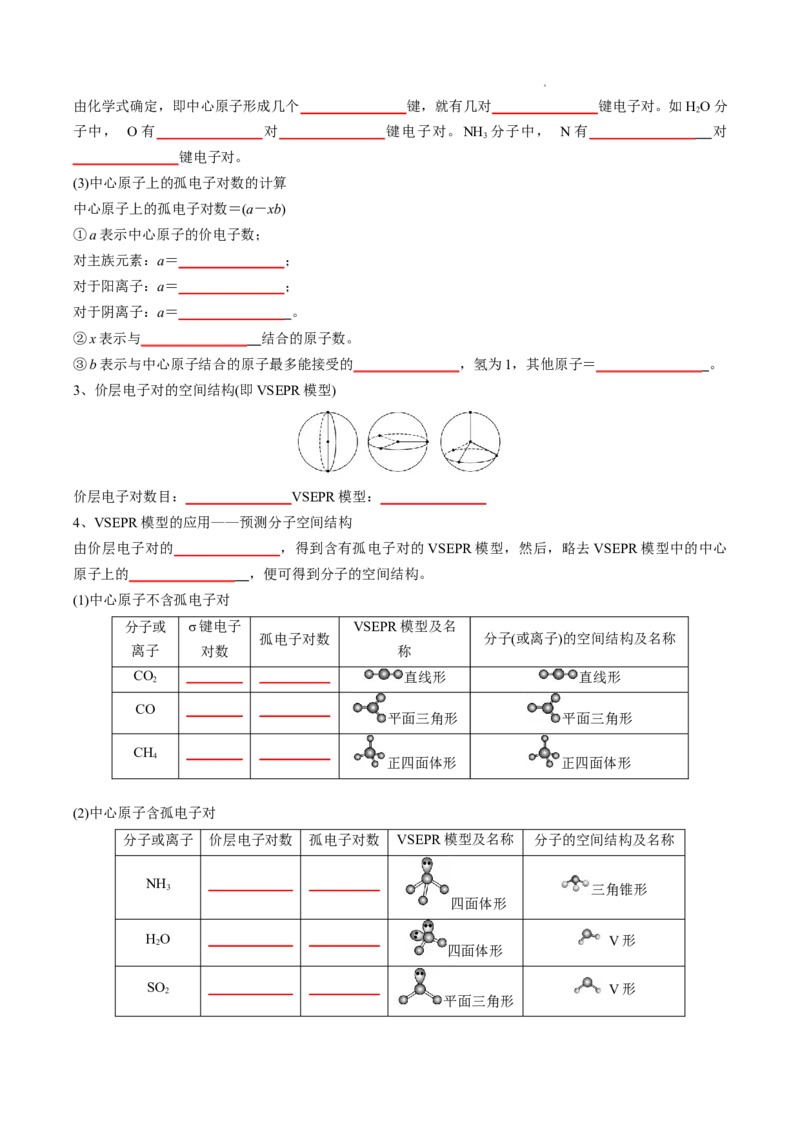
3、价层电子对的空间结构(即VSEPR模型)
价层电子对数目:_______________VSEPR模型:_______________
4、VSEPR模型的应用——预测分子空间结构
由价层电子对的_______________,得到含有孤电子对的VSEPR模型,然后,略去VSEPR模型中的中心
原子上的 _______________ ,便可得到分子的空间结构。
(1)中心原子不含孤电子对
分子或 σ键电子 VSEPR模型及名
孤电子对数 分子(或离子)的空间结构及名称
离子 对数 称
CO ________ __________ 直线形 直线形
2
CO ________ __________
平面三角形 平面三角形
CH ________ __________
4
正四面体形 正四面体形
(2)中心原子含孤电子对
分子或离子 价层电子对数 孤电子对数 VSEPR模型及名称 分子的空间结构及名称
NH ____________ __________
3 三角锥形
四面体形
H
2
O ____________ __________ V形
四面体形
SO
2
____________ __________ V形
平面三角形
学科网(北京)股份有限公司四、杂化轨道理论简介
(一)杂化轨道理论要点
1、原子在成键时,同一原子中能量_______________的原子轨道可重新组合成杂化轨道。
2、杂化前后原子轨道数目不变,且杂化轨道的_______________相同。
3、杂化改变了原子轨道的形状、方向。杂化使原子的成键能力_______________。杂化轨道在角度分布上
比单纯的s或p轨道在某一方向上更集中,例如s轨道与p轨道杂化后形成的杂化轨道一头大一头小,如图
,成键时根据_______________重叠原理,使它的大头与其他原子轨道重叠,
_______________程度更大,形成的_______________更牢固。
4、为使相互间的排斥最_______________,杂化轨道在空间取最大夹角分布。同一组杂化轨道的伸展方向
不同,但形状完全相同。
二、杂化轨道类型与分子空间结构的关系
1、杂化轨道的类型
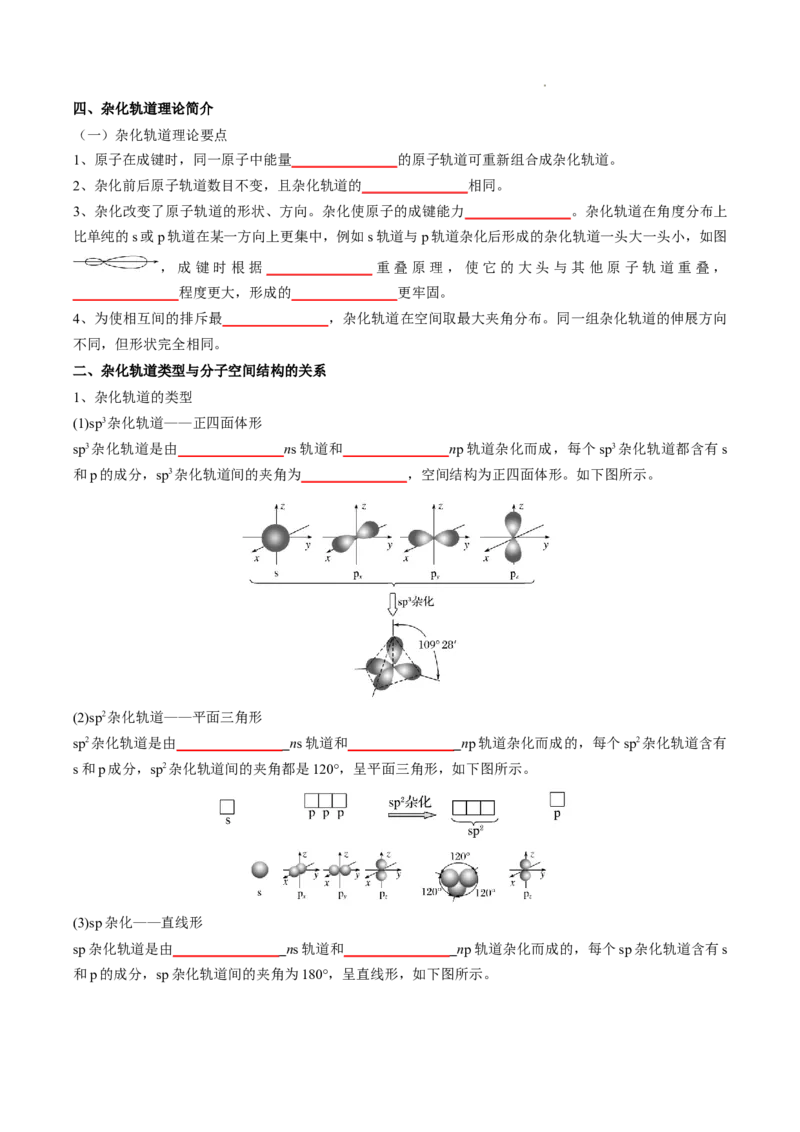
(1)sp3杂化轨道——正四面体形
sp3杂化轨道是由_______________ns轨道和_______________np轨道杂化而成,每个sp3杂化轨道都含有s
和p的成分,sp3杂化轨道间的夹角为_______________,空间结构为正四面体形。如下图所示。
(2)sp2杂化轨道——平面三角形
sp2杂化轨道是由 _______________ ns轨道和 _______________ np轨道杂化而成的,每个sp2杂化轨道含有
s和p成分,sp2杂化轨道间的夹角都是120°,呈平面三角形,如下图所示。
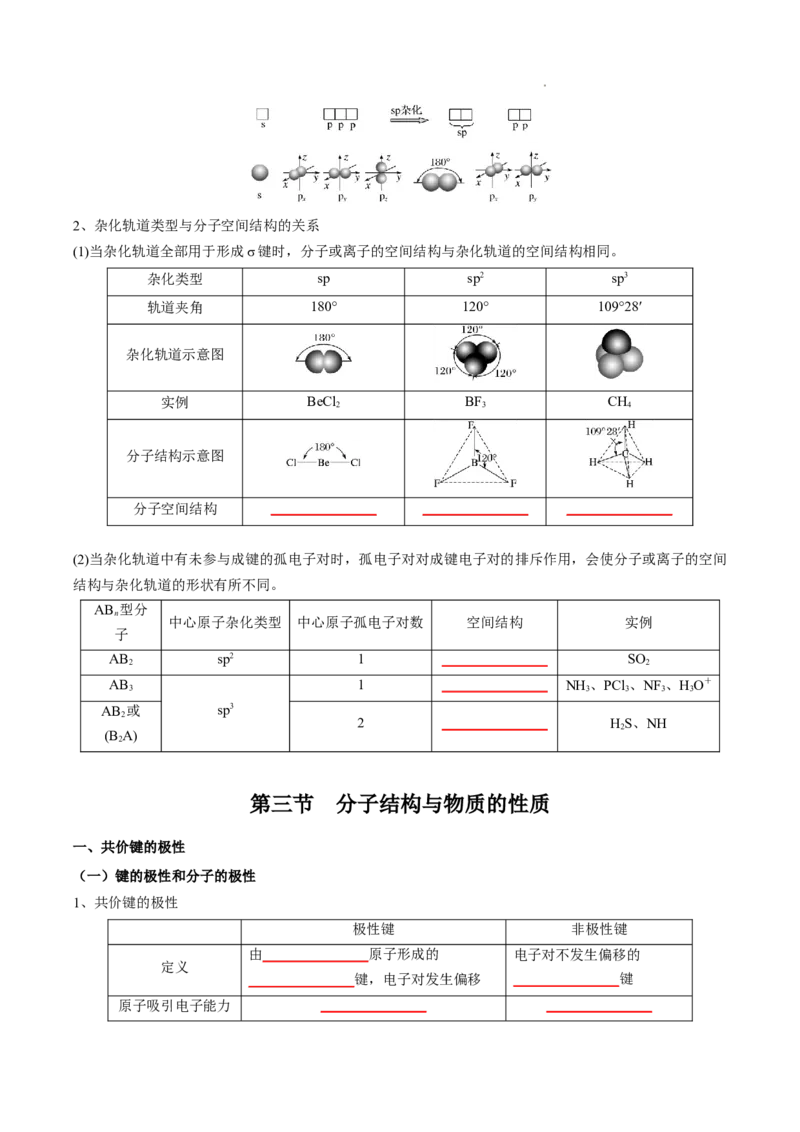
(3)sp杂化——直线形
sp杂化轨道是由 _______________ ns轨道和 _______________ np轨道杂化而成的,每个sp杂化轨道含有s
和p的成分,sp杂化轨道间的夹角为180°,呈直线形,如下图所示。
学科网(北京)股份有限公司2、杂化轨道类型与分子空间结构的关系
(1)当杂化轨道全部用于形成σ键时,分子或离子的空间结构与杂化轨道的空间结构相同。
杂化类型 sp sp2 sp3
轨道夹角 180° 120° 109°28′
杂化轨道示意图
实例 BeCl BF CH
2 3 4
分子结构示意图
分子空间结构 _______________ _______________ _______________
(2)当杂化轨道中有未参与成键的孤电子对时,孤电子对对成键电子对的排斥作用,会使分子或离子的空间
结构与杂化轨道的形状有所不同。
AB 型分
n
中心原子杂化类型 中心原子孤电子对数 空间结构 实例
子
AB sp2 1 _______________ SO
2 2
AB 1 _______________ NH 、PCl 、NF 、HO+
3 3 3 3 3
AB 或 sp3
2
2 _______________ HS、NH
2
(B A)
2
第三节 分子结构与物质的性质
一、共价键的极性
(一)键的极性和分子的极性
1、共价键的极性
极性键 非极性键
由_______________原子形成的 电子对不发生偏移的
定义
_______________键,电子对发生偏移 _______________键
原子吸引电子能力 _______________ _______________
学科网(北京)股份有限公司共用电子对 共用电子对偏向吸引电子能力强的原子 共用电子对_________偏移
成键原子电性 _______________ _______________
成键元素 一般是_______________非金属元素 ____________非金属元素
举例 Cl—Cl、H—H
2、分子的极性
(1)极性分子与非极性分子
(2)共价键的极性与分子极性的关系
(二)键的极性对化学性质的影响
例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pK 的大小
a
来衡量,pK 越_______________,酸性越_______________。羧酸的酸性大小与其分子的组成和结构有关,
a
如下表所示:
不同羧酸的pK
a
羧酸 pK
a
丙酸(C HCOOH) 4.88
2 5
乙酸(CHCOOH) 4.76
3
甲酸(HCOOH) 3.75
氯乙酸(CHClCOOH) 2.86
2
二氯乙酸(CHCl COOH) 1.29
2
三氯乙酸(CCl COOH) 0.65
3
三氟乙酸(CFCOOH) 0.23
3
二、分子间作用力
1、范德华力及其对物质性质的影响
(1)概念:是_______________间普遍存在的_______________,它使得许多物质能以一定的凝聚态(固态和
液态)存在。
(2)特征:很_______________,比化学键的键能小1~2个数量级。
学科网(北京)股份有限公司(3)影响因素:分子的极性越_______________,范德华力越 ______________ _ ;组成和结构相似的物质,
相对分子质量越_______________,范德华力越_______________。
(4)对物质性质的影响:范德华力主要影响物质的_______________性质,如熔、沸点,组成和结构相似的
物质,范德华力越_______________,物质熔、沸点越_______________。
2、范德华力的正确理解
(1)广泛存在于_______________之间。
(2)只有分子间充分接近时才有_______________间的相互作用力(范德华力),如固体和液体物质中。
(3)范德华力无_______________性和_______________性。只要分子周围空间允许,分子总是尽可能多地吸
引其他分子。
3、氢键及其对物质性质的影响
(1)概念:由已经与_______________很大的原子形成共价键的_______________与另一个_______________
很大的原子之间的作用力。
(2)表示方法:氢键通常用A—H…B表示,其中A、B为N、O、F,“—”表示 _______________ ,
“…”表示形成的 _______________ 键。
(3)氢键的本质和性质
氢键的本质是静电相互作用,它比化学键弱得多,通常把氢键看作是一种比较强的分子间作用力。氢键具
有方向性和饱和性,但本质上与_______________键的_______________性和_______________性不同。
①方向性:A—H…B三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力
最_______________,形成的氢键最_______________,体系最_______________。
②饱和性:每一个A—H只能与一个B原子形成_______________键,原因是H原子半径很小,再有一个
原子接近时,会受到A、B原子电子云的排斥。
(4)分类:氢键可分为分子间_______________键和分子内_______________键两类。
存在_______________氢键, 存在 _______________ 氢键。前者的沸点
_______________ 低 _______________ 后者。
(5)氢键对物质性质的影响:氢键主要影响物质的熔、沸点,分子间氢键使物质熔、沸点_______________,
分子内氢键使物质熔、沸点_______________。
4、溶解性
(1)“相似相溶”规律
非极性溶质一般能溶于_______________溶剂,极性溶质一般能溶于_______________溶剂,如蔗糖和氨易
溶于水,_______________溶于四氯化碳;萘和碘易溶于四氯化碳,_______________溶于水。
(2)影响物质溶解性的因素
①外界因素:主要有_______________等。
②氢键:溶剂和溶质之间的氢键作用力越_______________,溶解性越_______________。
③分子结构的相似性:溶质和溶剂的分子结构相似程度越_______________,其溶解性越_______________,
如乙醇与水_______________,而戊醇在水中的溶解度明显减_______________。
学科网(北京)股份有限公司三、分子的手性
1、概念
(1)手性异构体:具有完全相同的 _______________ 和_______________的一对分子,如同左手与右手一样
互为镜像,却在三维空间里不能叠合,互称手性异构体(或_______________异构体)。
(2)手性分子:具有_______________的分子。
2、手性分子的判断
(1)判断方法:有机物分子中是否存在_______________。
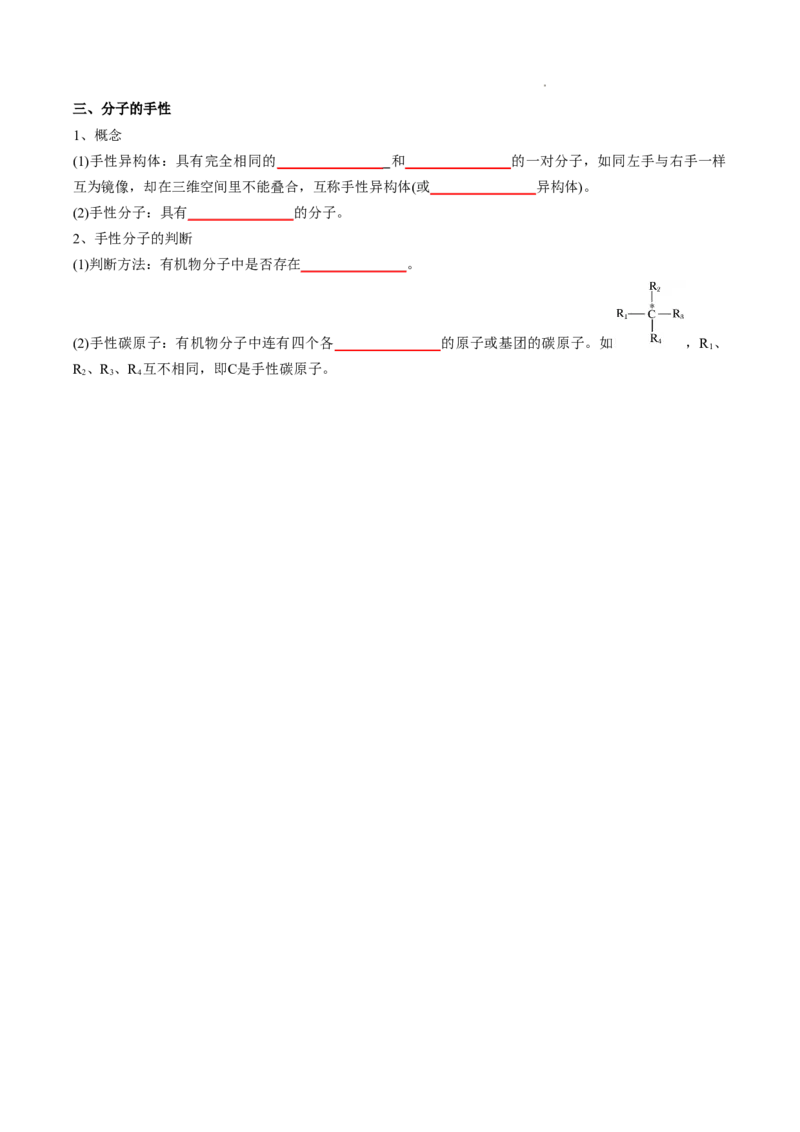
(2)手性碳原子:有机物分子中连有四个各_______________的原子或基团的碳原子。如 ,R 、
1
R 、R 、R 互不相同,即C是手性碳原子。
2 3 4
学科网(北京)股份有限公司学科网(北京)股份有限公司