文档内容
2024级高二第一学期阶段考试
化学科试卷
第Ⅰ卷(选择题 共44分)
一、单项选择题(本题包括16小题,1~10小题每题2分,11~16小题每题4分,共44分。)
化学与生产、生活和科技息息相关,下列说法错误的是
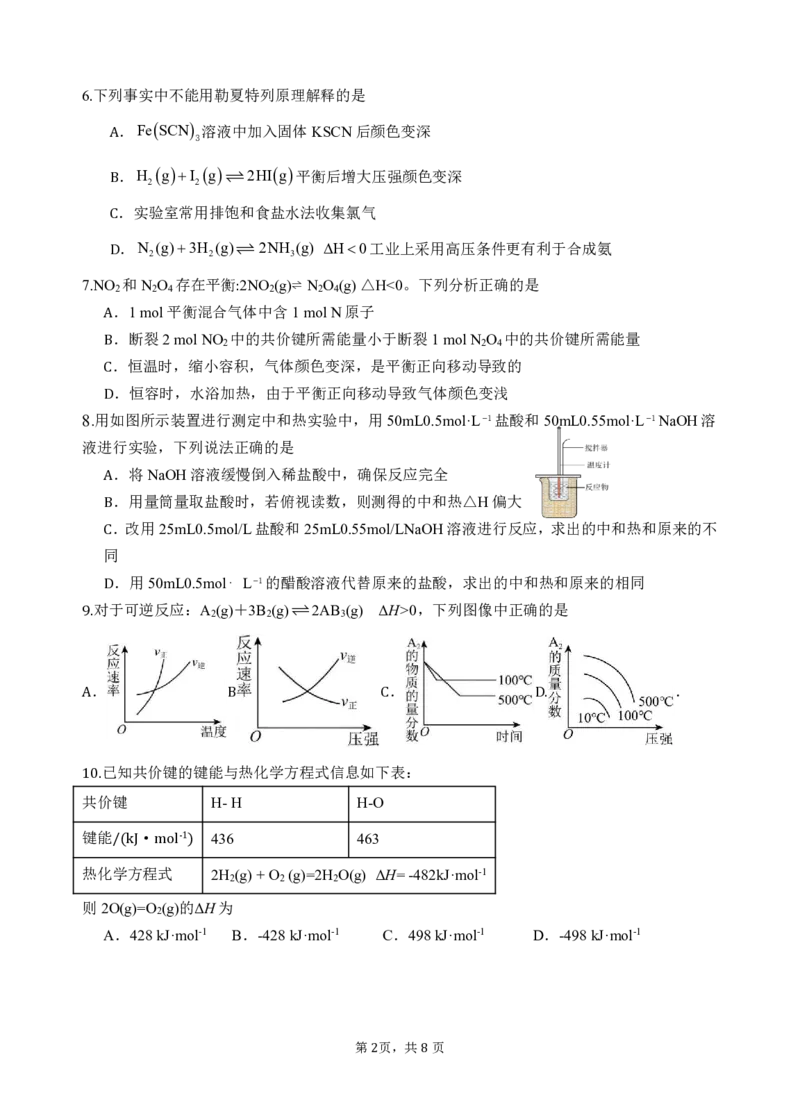
.燃油汽车上的三元催化器中的催化剂提高了反应物中活化分子百分数,加快了反应速率,
1.
进而提高了有害物质的平衡转化率,减少了污染物的排放
A
.火箭推动剂的发展历史是从古代的火药到液体、固体推进剂,再到现如今的高能推进剂和
绿色推进剂
B
.飞秒化学是采用1015 1012s的时间分辨技术跟踪监测化学反应中寿命极短的中间体或过渡
态的技术
C
.我国科学家研制出新型催化剂,将合成氨的温度和压强分别降到了350℃、1MPa,在节能减
排方面取得重大突破
D
下列措施中,不能增大化学反应速率的是
2. .加热分解KClO 时,添加少量MnO .CaCO 与盐酸反应时,适当升高温度
3 2 3
A.进行合成NH 反应时,增大气体压强 B.Zn与稀硫酸反应时,加入几滴蒸馏水
3
已知反应:CO (g)+CH (g)=2CO(g)+2H (g) ΔH=+akJ/mol(a>0),则此反应
C 2 4 2 D
.高温下可自发进行 .低温下可自发进行
3.
.任何条件下都可自发进行 .任何条件下都不可自发进行
A B
4.理论研究表明,在101kPa和298K下,HCN(g)⇌ HNC(g)异构化反应过程的能量变化如图所示。
C D
下列说法错误的是
.HCN比HNC稳定
.该异构化反应的ΔH=+59.3kJ·mol-1
A
.正反应的活化能大于逆反应的活化能
B
.使用催化剂,可以改变反应的反应热
C
D
5.一定量的氨基甲酸铵置于密闭容器中 容器体积不变,固体体积忽略 ,在恒温下使其达到分解
平衡:NH COONH s ⇌ 2NH g +CO g ,可以判断该反应已经达到平衡的是
2 4 3 2( )
.v(NH )=2v(CO ) .密闭容器中氨气的体积分数不变
3 2
.密闭容器中混合气体的密度不变 .密闭容器中气体的平均相对分子质量不变
A B
C D
第 页,共 页
1 86下列事实中不能用勒夏特列原理解释的是
. .FeSCN 溶液中加入固体KSCN后颜色变深
3
A
.H gI g 2HIg平衡后增大压强颜色变深
2 2
B.实验室常用排饱和食盐水法收集氯气
C.N (g)3H (g) 2NH (g) H0工业上采用高压条件更有利于合成氨
2 2 3
7.NOD和N O 存在平衡2NO (g)⇌ N O (g)△H<0。下列分析正确的是
2 2 4 2 2 4
.1mol平衡混合气体中含1molN原子
:
.断裂2molNO 中的共价键所需能量小于断裂1molN O 中的共价键所需能量
A 2 2 4
.恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
B
.恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
C
8.用如图所示装置进行测定中和热实验中,用50mL0.5mol·L1盐酸和50mL0.55mol·L1NaOH溶
D
液进行实验,下列说法正确的是
.将NaOH溶液缓慢倒入稀盐酸中,确保反应完全
.用量筒量取盐酸时,若俯视读数,则测得的中和热△H偏大
A
.改用25mL0.5mol/L盐酸和25mL0.55mol/LNaOH溶液进行反应,求出的中和热和原来的不
B
同
C
.用50mL0.5mol⋅ L1的醋酸溶液代替原来的盐酸,求出的中和热和原来的相同
对于可逆反应:A (g)+3B (g)2AB (g) ΔH>0,下列图像中正确的是
D 2 2 3
9.
. . .
A B C D.
已知共价键的键能与热化学方程式信息如下表:
1 共 0 价 . 键 H-H H-O
键能 · 436 463
-1
热化学/(k方J程m式ol ) 2H (g)+O (g)=2H O(g) ΔH=-482kJ·mol-1
2 2 2
则2O(g)=O (g)的ΔH为
2
A.428kJ·mol-1 B.-428kJ·mol-1 C.498kJ·mol-1 D.-498kJ·mol-1
第 页,共 页
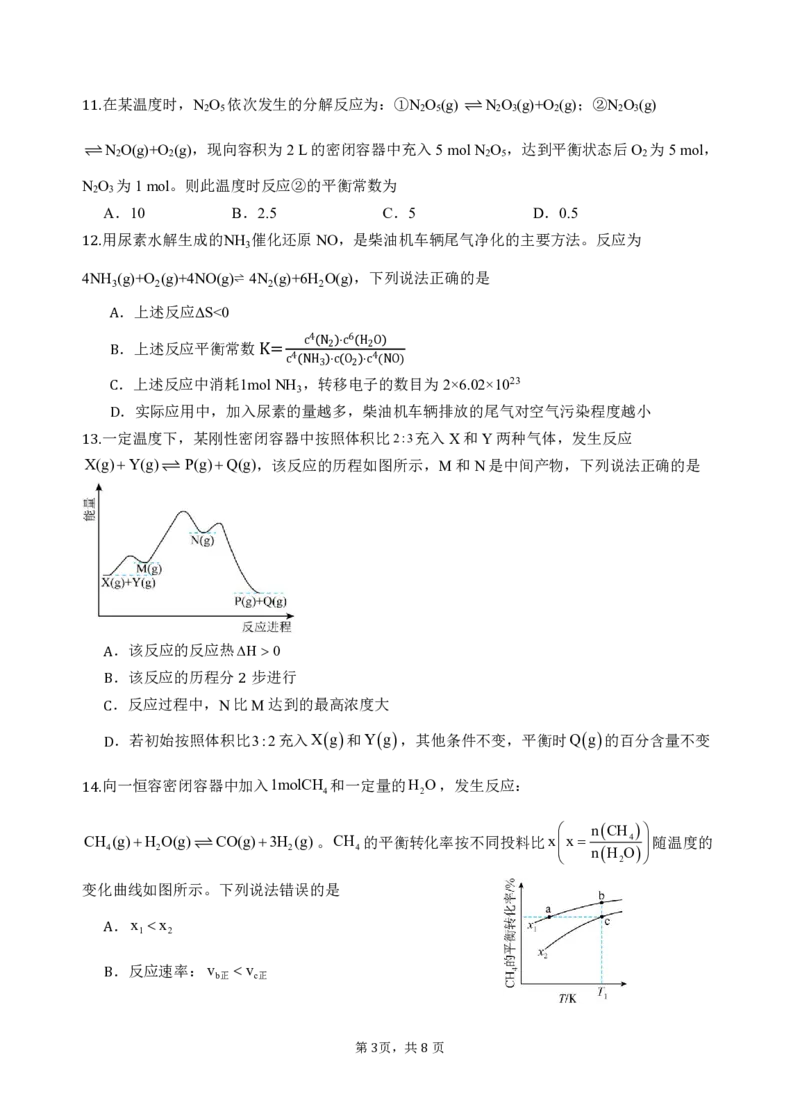
2 8在某温度时,N
2
O
5
依次发生的分解反应为:①N
2
O
5
(g) N
2
O
3
(g)+O
2
(g);②N
2
O
3
(g)
11.
N
2
O(g)+O
2
(g),现向容积为2L的密闭容器中充入5molN
2
O
5
,达到平衡状态后O
2
为5mol,
N O 为1mol。则此温度时反应②的平衡常数为
2 3
A.10 B.2.5 C.5 D.0.5
用尿素水解生成的NH 催化还原NO,是柴油机车辆尾气净化的主要方法。反应为
3
1 4N 2. H (g)+O (g)+4NO(g)⇌ 4N (g)+6H O(g),下列说法正确的是
3 2 2 2
.上述反应ΔS<0
A.上述反应平衡常数
4 6
c N2 ⋅c H2O
B.上述反应中消耗1moKl=NHc 4
3
N,H转3 ⋅移c O电2 子⋅c 4 (的NO数)目为2×6.02×1023
.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
C
一定温度下,某刚性密闭容器中按照体积比2:3充入X和Y两种气体,发生反应
D
X(g)Y(g) P(g)Q(g),该反应的历程如图所示,M和N是中间产物,下列说法正确的是
13.
.该反应的反应热H 0
.该反应的历程分 步进行
A
.反应过程中,N比M达到的最高浓度大
B 2
C.若初始按照体积比3:2充入Xg和Yg,其他条件不变,平衡时Qg的百分含量不变
D
向一恒容密闭容器中加入1molCH 和一定量的H O,发生反应:
4 2
14.
nCH
CH (g)H O(g)CO(g)3H (g)。CH 的平衡转化率按不同投料比xx 4 随温度的
4 2 2 4
nH
2
O
变化曲线如图所示。下列说法错误的是
.x x
1 2
A
.反应速率:v v
b正 c正
B
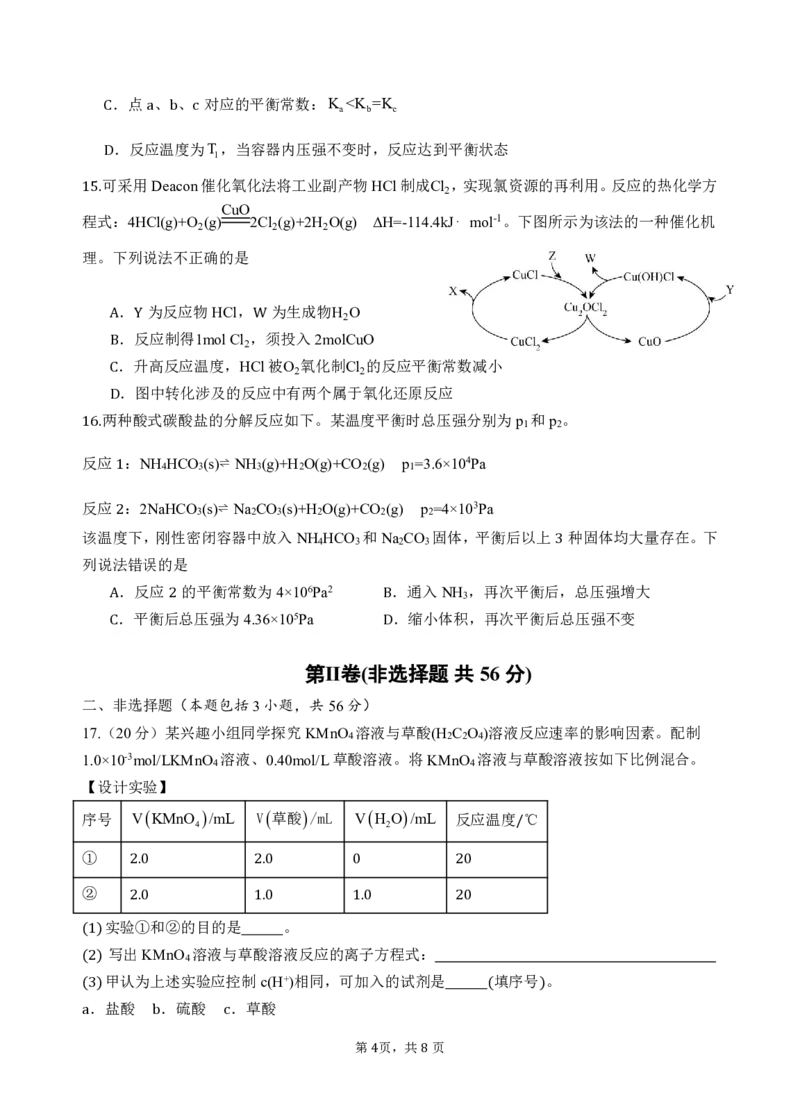
第 页,共 页
3 8.点 、 、 对应的平衡常数:K <
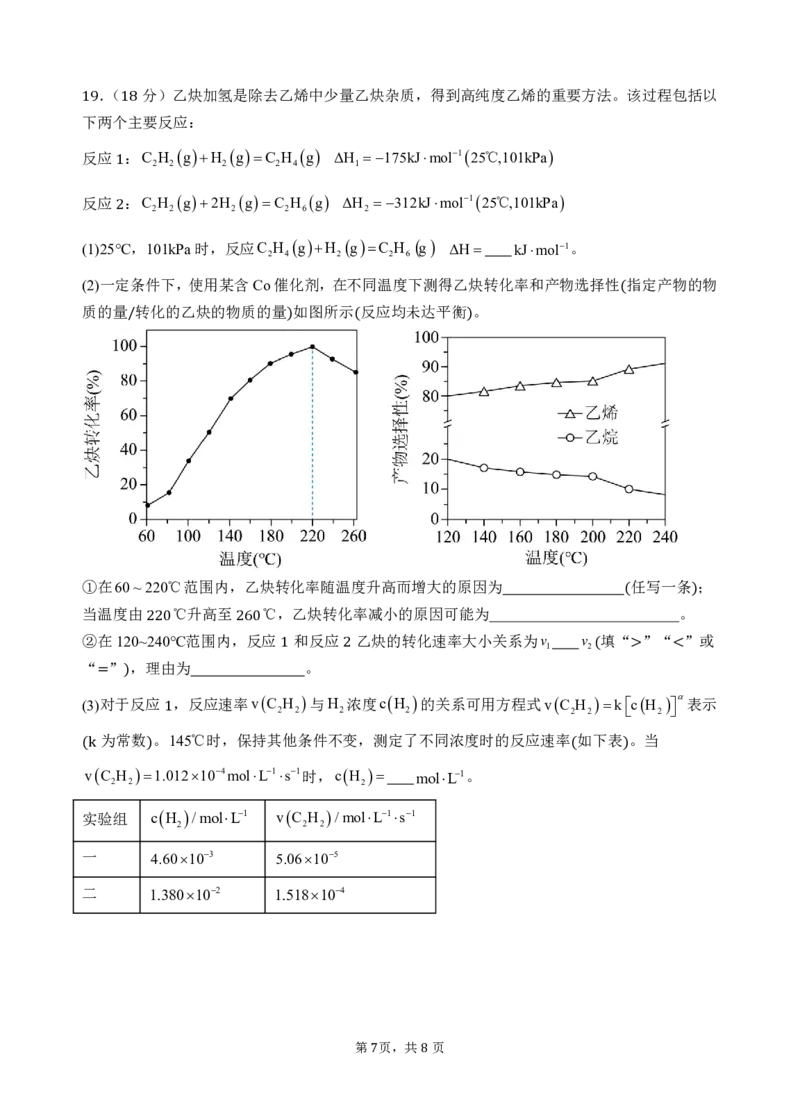
(3)=对于)反应 ,反应速率vC 2 H 2 与H 2 浓度cH 2 的关系可用方程式vC 2 H 2 k cH 2 表示
为常数 。1145℃时,保持其他条件不变,测定了不同浓度时的反应速率 如下表 。当
(vkC H )1.012104molL1s1时,cH molL1。 ( )
2 2 2
实验组 cH /molL1 vC H /molL1s1
2 2 2
一 4.60103 5.06105
二 1.380102 1.518104
第 页,共 页
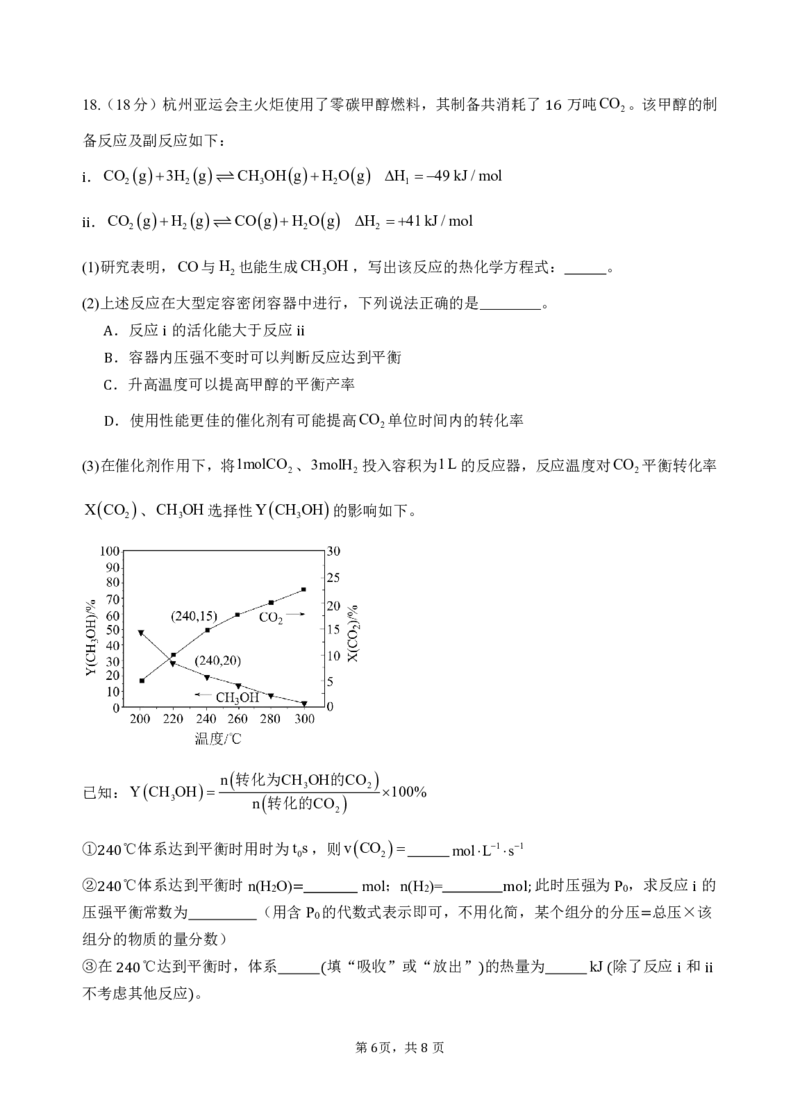
7 8以 或 为催化剂,可在常温常压25℃,101kPa下实现乙炔加氢,反应机理如下图所示
(4虚)线为Pd生/W成乙烷Pd的路径 。以 为催化剂时,乙烯的选择性更高,原因为 。 图中“ ”表示
吸附态;数值为生成相应过渡态的活化能 。
( ) ( *
)
第 页,共 页
8 8