文档内容
奉化区 2024 学年第一学期期末联考
高二化学试题
说明:1.本卷考试时间:90分钟,满分100分。
可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 Fe-56
2.请把答案做在答题卷的指定区域,在试卷或草稿纸上作答一律无效。
第Ⅰ卷 选择题部分(共48分)
一、选择题(每小题只有一个选项符合要求)
1.各种形式的能量转换为生活提供便利,下列选项主要依靠化学能转化为热能的
A.一次性速冷冰
B.自热饭速食米饭 C.新能源汽车 D.麒麟970芯片
袋
2.化学与生活密切相关。下列事实与化学反应速率无关的是
A.制作馒头时添加膨松剂 B.洗衣服时使用加酶洗衣粉
C.向炉膛内鼓风 D.在月饼包装内放置抗氧化剂
3.化学用语是化学专业语言,是学习化学的工具。下列有关化学用语的说法正确的是
A.PCl 的VSEPR模型:
3
B.HCl分子中的σ键电子云轮廓图:
C.激发态硼原子的电子排布图:
D.基态 Cu原子的电子排布式:
29
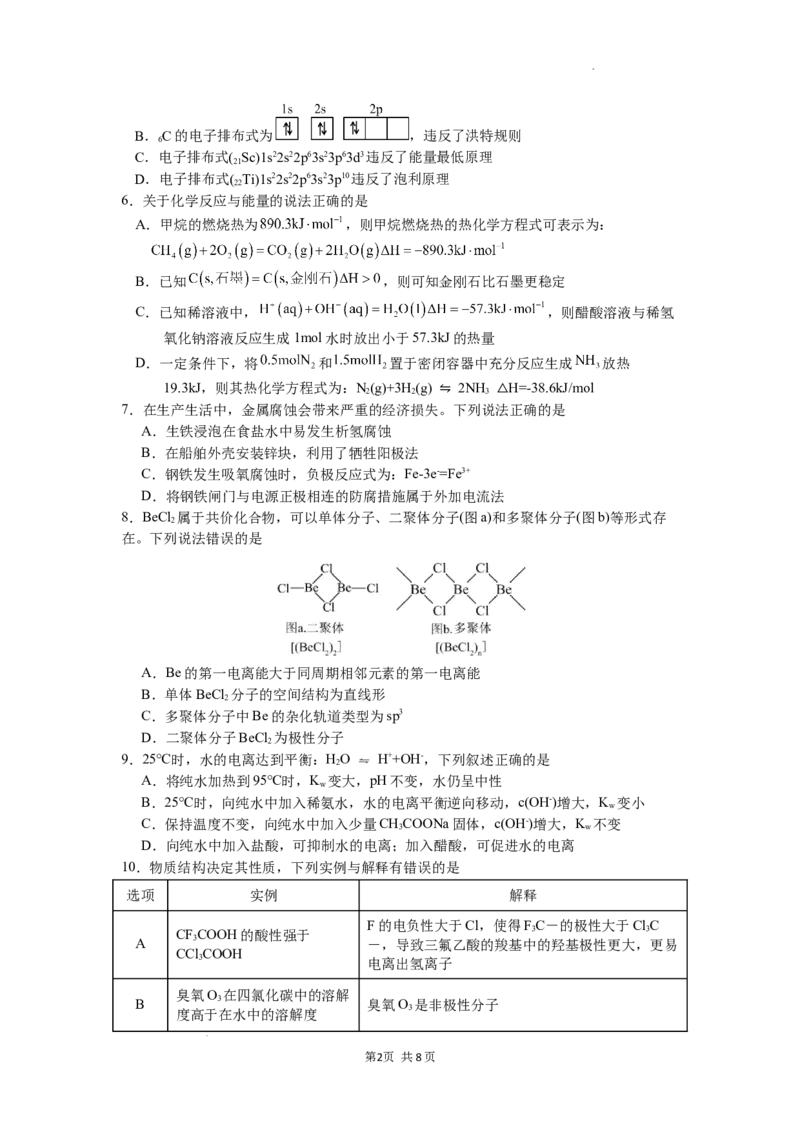
4.下列实验方案或装置能达到目的的是
① ② ③ ④
A.图①:用于定量测量化学反应速率
B.图②:用于中和热的测定
C.图③:可以探究HO 分解的热效应
2 2
D.图④:2NO (g) NO(g),若气体颜色加深,说明平衡逆向移动
2 2 4
5.下列说法错误的是( )
⇋
A.ns能级电子的能量可能低于(n-1)p能级电子的能量
第1页 共8页
学科网(北京)股份有限公司B.C的电子排布式为 ,违反了洪特规则
6
C.电子排布式( Sc)1s22s22p63s23p63d3违反了能量最低原理
21
D.电子排布式( Ti)1s22s22p63s23p10违反了泡利原理
22
6.关于化学反应与能量的说法正确的是
A.甲烷的燃烧热为 ,则甲烷燃烧热的热化学方程式可表示为:
B.已知 ,则可知金刚石比石墨更稳定
C.已知稀溶液中, ,则醋酸溶液与稀氢
氧化钠溶液反应生成1mol水时放出小于57.3kJ的热量
D.一定条件下,将 和 置于密闭容器中充分反应生成 放热
19.3kJ,则其热化学方程式为:N(g)+3H(g) 2NH H=-38.6kJ/mol
2 2 3
7.在生产生活中,金属腐蚀会带来严重的经济损失。下列说法正确的是
⇋ △
A.生铁浸泡在食盐水中易发生析氢腐蚀
B.在船舶外壳安装锌块,利用了牺牲阳极法
C.钢铁发生吸氧腐蚀时,负极反应式为:Fe-3e-=Fe3+
D.将钢铁闸门与电源正极相连的防腐措施属于外加电流法
8.BeCl 属于共价化合物,可以单体分子、二聚体分子(图a)和多聚体分子(图b)等形式存
2
在。下列说法错误的是
A.Be的第一电离能大于同周期相邻元素的第一电离能
B.单体BeCl 分子的空间结构为直线形
2
C.多聚体分子中Be的杂化轨道类型为sp3
D.二聚体分子BeCl 为极性分子
2
9.25℃时,水的电离达到平衡:HO H++OH-,下列叙述正确的是
2 ⇋
A.将纯水加热到95℃时,K 变大,pH不变,水仍呈中性
w
B.25℃时,向纯水中加入稀氨水,水的电离平衡逆向移动,c(OH-)增大,K 变小
w
C.保持温度不变,向纯水中加入少量CHCOONa固体,c(OH-)增大,K 不变
3 w
D.向纯水中加入盐酸,可抑制水的电离;加入醋酸,可促进水的电离
10.物质结构决定其性质,下列实例与解释有错误的是
选项 实例 解释
F的电负性大于Cl,使得FC-的极性大于ClC
CFCOOH的酸性强于 3 3
A 3 -,导致三氟乙酸的羧基中的羟基极性更大,更易
CCl COOH
3 电离出氢离子
臭氧O 在四氯化碳中的溶解
B 3 臭氧O 是非极性分子
度高于在水中的溶解度 3
第2页 共8页
学科网(北京)股份有限公司邻羟基苯甲醛的沸点低于对 邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛能形
C
羟基苯甲醛 成分子间氢键
Al原子失去的电子是3p能级的,而Mg原子失去
D 第一电离能:
的电子是3s能级的,3p能级的能量高于3s能级
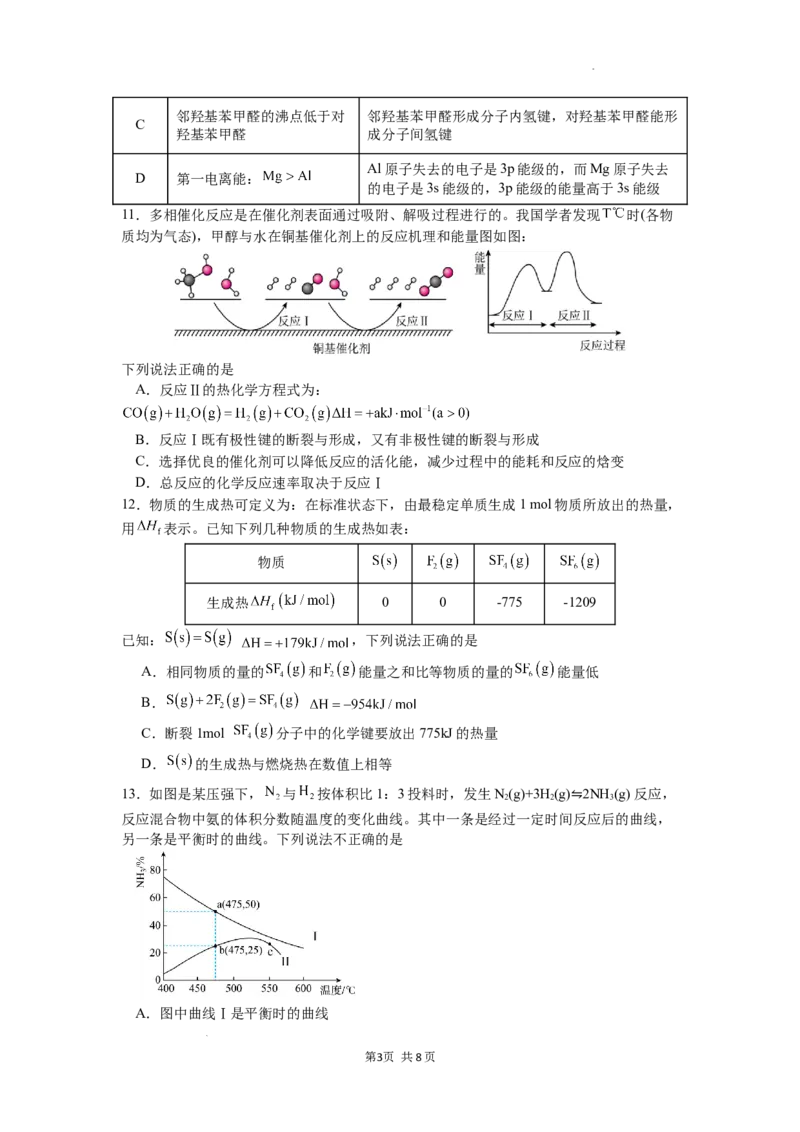
11.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现 时(各物
质均为气态),甲醇与水在铜基催化剂上的反应机理和能量图如图:
下列说法正确的是
A.反应Ⅱ的热化学方程式为:
B.反应Ⅰ既有极性键的断裂与形成,又有非极性键的断裂与形成
C.选择优良的催化剂可以降低反应的活化能,减少过程中的能耗和反应的焓变
D.总反应的化学反应速率取决于反应Ⅰ
12.物质的生成热可定义为:在标准状态下,由最稳定单质生成1 mol物质所放出的热量,
用 表示。已知下列几种物质的生成热如表:
物质
生成热 0 0 -775 -1209
已知: ,下列说法正确的是
A.相同物质的量的 和 能量之和比等物质的量的 能量低
B.
C.断裂1mol 分子中的化学键要放出775kJ的热量
D. 的生成热与燃烧热在数值上相等
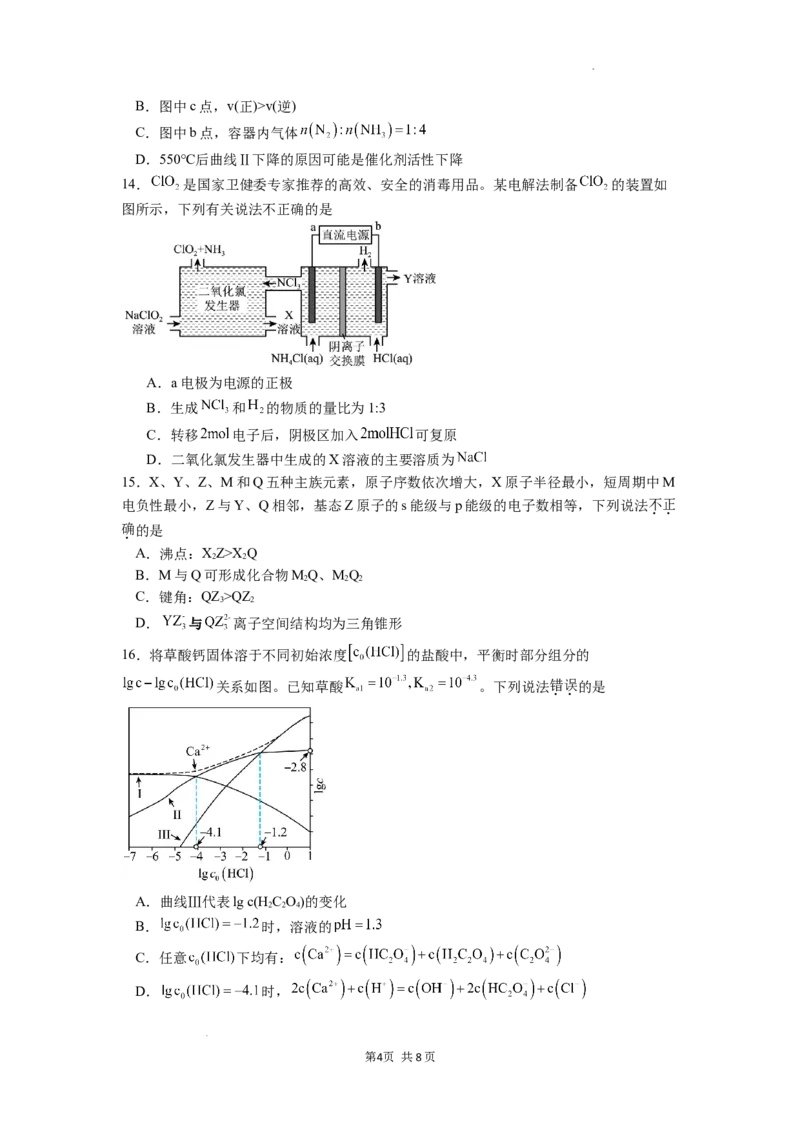
13.如图是某压强下, 与 按体积比1:3投料时,发生N(g)+3H(g) 2NH (g) 反应,
2 2 3
反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,
⇋
另一条是平衡时的曲线。下列说法不正确的是
A.图中曲线Ⅰ是平衡时的曲线
第3页 共8页
学科网(北京)股份有限公司B.图中c点,v(正)>v(逆)
C.图中b点,容器内气体
D.550℃后曲线Ⅱ下降的原因可能是催化剂活性下降
14. 是国家卫健委专家推荐的高效、安全的消毒用品。某电解法制备 的装置如
图所示,下列有关说法不正确的是
A.a电极为电源的正极
B.生成 和 的物质的量比为1:3
C.转移 电子后,阴极区加入 可复原
D.二氧化氯发生器中生成的X溶液的主要溶质为
15.X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M
电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正
确的是
A.沸点:XZ>X Q
2 2
B.M与Q可形成化合物MQ、MQ
2 2 2
C.键角:QZ>QZ
3 2
D. 与 离子空间结构均为三角锥形
16.将草酸钙固体溶于不同初始浓度 的盐酸中,平衡时部分组分的
关系如图。已知草酸 。下列说法错误的是
A.曲线Ⅲ代表lg c(H C O)的变化
2 2 4
B. 时,溶液的
C.任意 下均有:
D. 时,
第4页 共8页
学科网(北京)股份有限公司第Ⅱ卷 非选择题(共52分)
二、填空题(共52分)
17.(9分)部分中学化学常见元素原子的结构及性质如表所示:
元素 结构及性质
A A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体
B B是一种常见的金属元素,原子核外有三个电子层且最外层电子数为偶数
C C的气态氢化物易液化,常用作制冷剂
D D的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料
E E的原子最外层电子数是内层电子总数的3倍
F F在周期表中排在第ⅠA族,也有人提出可以排在第ⅦA族
(1)A 元素在周期表中的位置为 ,E 原子的价层电子排布图为
;
(2)元素C、D、E的第一电离能由大到小的排列顺序 (用元素符号表示,
下同),元素C、D、E、F的电负性由大到小的排列顺序 ;
(3)在B原子中,电子占据的最高能层符号为 ,有 种运动状态不同的电子;
(4)C与E可以形成原子个数比分别为1∶2和1∶3的两种阴离子X和Y,X离子的VSEPR
模型名称为 ,Y离子的空间结构为 ;
(5)根据对角线规则,书写Li在氧气中燃烧的化学方程式 。
18.(12分)25℃时,有关物质平衡常数的数值如表所示:
CHCOOH HSO HS HCO HClO CuS
3 2 3 2 2 3
K =1.54×10-2 K =1.1×10-7 K =4.3×10-7
K=1.69×10-5 a1 a1 a1 K=3.0×10-8 K =6.0×10-36
a K =1.02×10-7 K =1.0×10-13 K =5.6×10-11 a sp
a2 a2 a2
(1)前三种酸由强到弱的顺序是 。
(2)同浓度的CHCOO-、SO 、CO 结合H+能力由大到小的顺序为 。
3
(3)初始浓度为0.1mol/L的CHCOOH溶液pH为 。(已知lg1.3=0.11)
3
(4)物质的量浓度均为0.1mol/L的CHCOOH和CHCOONa溶液等体积混合(体积变化忽略
3 3
不计),则下列关于混合溶液的说法中不正确的是 。
A.c(CHCOOH)+2c(H+)=c(CH COO-)+2c(OH-)
3 3
B.c(Na+)-c(OH-)=c(CH COO-)-c(H+)
3
C.c(CHCOOH)+c(CH COO-)=0.2mol/L
3 3
D.c(CHCOO-)>c(Na+)>c(CHCOOH)>c(H+)>c(OH-)
3 3
(5)向次氯酸钠溶液中通入少量二氧化碳的离子方程式为 。
(6)反应HS(aq)+Cu2+(aq) CuS(s)+2H+(aq)的平衡常数为 (保留小数点后一位)。
2
⇋
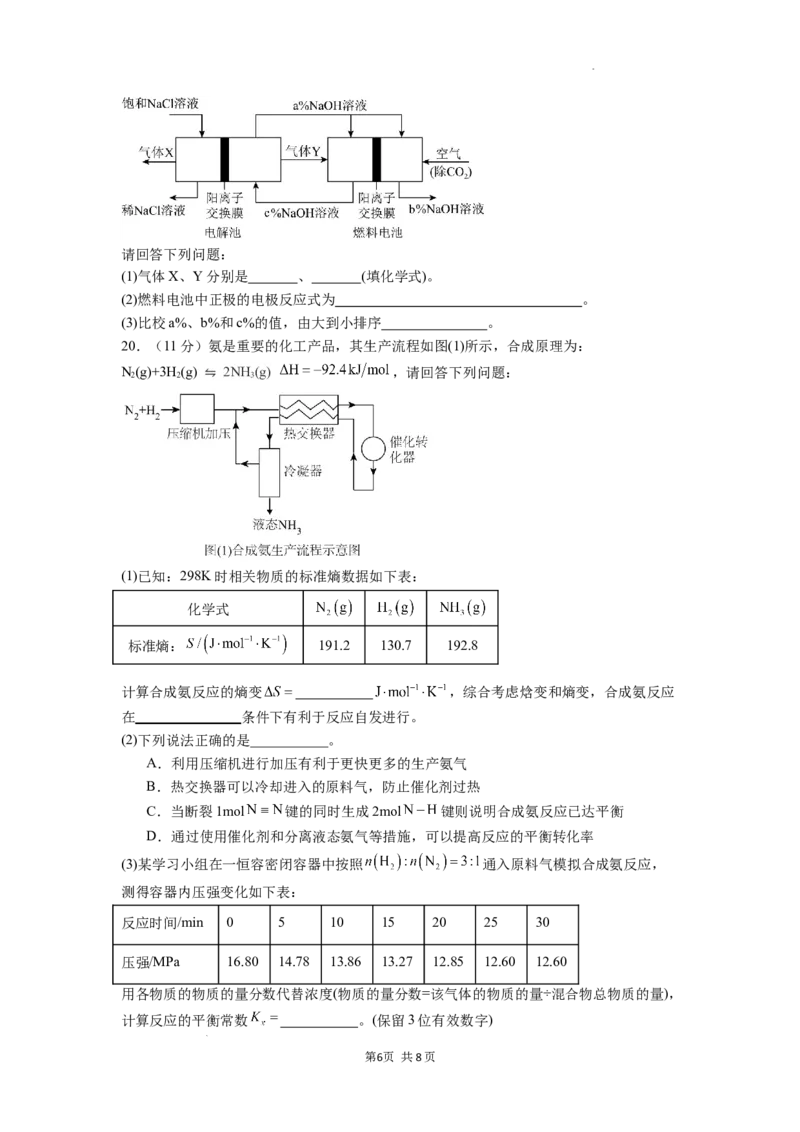
19.(6分)氯碱工业是高能耗产业,一种将电解池与燃料电池相组合的新工艺节能超过
30%。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出。
第5页 共8页
学科网(北京)股份有限公司请回答下列问题:
(1)气体X、Y分别是 、 (填化学式)。
(2)燃料电池中正极的电极反应式为 。
(3)比校a%、b%和c%的值,由大到小排序 。
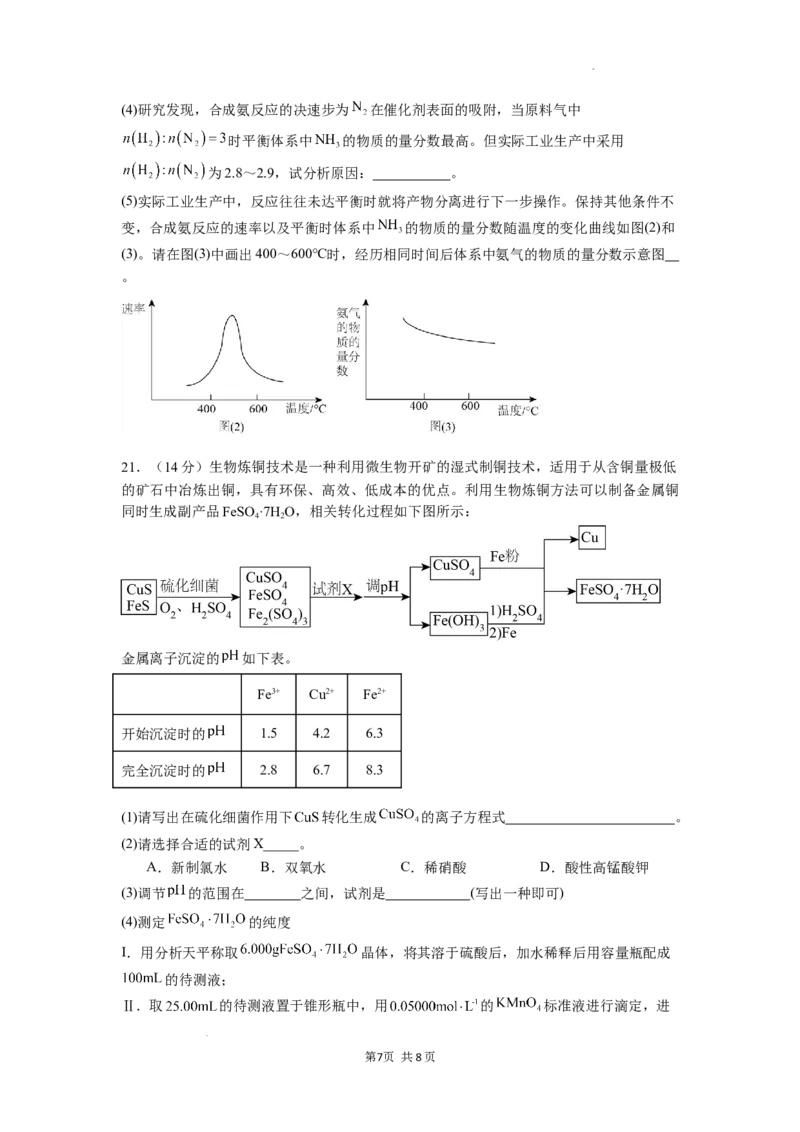
20.(11分)氨是重要的化工产品,其生产流程如图(1)所示,合成原理为:
N(g)+3H(g) 2NH (g) ,请回答下列问题:
2 2 3
⇋
(1)已知:298K时相关物质的标准熵数据如下表:
化学式
标准熵: 191.2 130.7 192.8
计算合成氨反应的熵变 ,综合考虑焓变和熵变,合成氨反应
在_______________条件下有利于反应自发进行。
(2)下列说法正确的是___________。
A.利用压缩机进行加压有利于更快更多的生产氨气
B.热交换器可以冷却进入的原料气,防止催化剂过热
C.当断裂1mol 键的同时生成2mol 键则说明合成氨反应已达平衡
D.通过使用催化剂和分离液态氨气等措施,可以提高反应的平衡转化率
(3)某学习小组在一恒容密闭容器中按照 通入原料气模拟合成氨反应,
测得容器内压强变化如下表:
反应时间/min 0 5 10 15 20 25 30
压强/MPa 16.80 14.78 13.86 13.27 12.85 12.60 12.60
用各物质的物质的量分数代替浓度(物质的量分数=该气体的物质的量÷混合物总物质的量),
计算反应的平衡常数 。(保留3位有效数字)
第6页 共8页
学科网(北京)股份有限公司(4)研究发现,合成氨反应的决速步为 在催化剂表面的吸附,当原料气中
时平衡体系中 的物质的量分数最高。但实际工业生产中采用
为2.8~2.9,试分析原因: 。
(5)实际工业生产中,反应往往未达平衡时就将产物分离进行下一步操作。保持其他条件不
变,合成氨反应的速率以及平衡时体系中 的物质的量分数随温度的变化曲线如图(2)和
(3)。请在图(3)中画出400~600℃时,经历相同时间后体系中氨气的物质的量分数示意图
。
21.(14分)生物炼铜技术是一种利用微生物开矿的湿式制铜技术,适用于从含铜量极低
的矿石中冶炼出铜,具有环保、高效、低成本的优点。利用生物炼铜方法可以制备金属铜
同时生成副产品FeSO ·7H O,相关转化过程如下图所示:
4 2
金属离子沉淀的 如下表。
Fe3+ Cu2+ Fe2+
开始沉淀时的 1.5 4.2 6.3
完全沉淀时的 2.8 6.7 8.3
(1)请写出在硫化细菌作用下 转化生成 的离子方程式 。
(2)请选择合适的试剂X_____。
A.新制氯水 B.双氧水 C.稀硝酸 D.酸性高锰酸钾
(3)调节 的范围在 之间,试剂是 (写出一种即可)
(4)测定 的纯度
I.用分析天平称取 晶体,将其溶于硫酸后,加水稀释后用容量瓶配成
的待测液;
Ⅱ.取 的待测液置于锥形瓶中,用 的 标准液进行滴定,进
第7页 共8页
学科网(北京)股份有限公司行三次平行试验,消耗的 标准液的体积如下表所示:
第一
实验组 第二次 第三次
次
滴定前 溶液的体积 0.05 0.20 1.10
滴定后 溶液的体积 19.95 20.30 22.1
① 标准液盛放在 (填“酸式”或“碱式”)滴定管中。
②对于上述滴定操作,下列描述正确的是 。
A.装入标准液时使液面位于“0”刻度线以上
B.装液后若发现有气泡,可快速向下放液排气泡
C.滴定时滴定管下端应略伸入锥形瓶口
D.滴定过程中,左手轻轻挤压滴定管中的玻璃球,右手轻轻摇动锥形瓶
E.刚开始滴定时,可使溶液流成“水线”快速流下
③滴定终点的现象是 。
④该 晶体的纯度是 (保留2位小数)。
⑤现测得该晶体纯度偏低,可能的原因是 。
A.在配制待测液定容时仰视
B.原锥形瓶中有水
C.待测液配制过程中被氧气氧化
D.滴定前盛放KMnO 标准液的滴定管中滴定前有气泡,滴定后气泡消失
4
E.滴定终点时仰视读数
第8页 共8页
学科网(北京)股份有限公司