文档内容
诸暨市 2024—2025 学年第一学期期末考试试题
高二化学
(时间 90 分钟,满分 100 分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Si 28 Cl 35.5 Cu 64 Br 80 I 127
选择题部分
一、选择题(本大题共 16 小题,每小题 3 分,共 48 分。每个小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分)
1. 下列含有共价键的盐是
A. CaCl B. H SO C. Ba(OH) D. Cu (OH) CO
2 2 4 2 2 2 3
2. 下列化学用语正确的是
A. SO 的 VSEPR 模型: B. 的系统命名为:2,2,3-三甲基丁烷
3
C. 甲酸甲酯的结构简式:C H O D. KCl 的形成过程:
2 4 2
3. 关于乙炔的说法不正确的是
A. 碳原子的价层电子的轨道表示式 ,违反了泡利原理
B. 基态碳原子核外有 3 种能量不同的电子
C. 乙炔分子中的 C 原子间采用 sp 杂化轨道形成了一个σ键和两个π键
D. 乙炔分子内含极性键、非极性键,是非极性分子
4. 下列说法正确的是
A. 可以用浓溴水来除去苯中混有的少量苯酚
B. 可以用饱和 NaOH 溶液来除去乙酸乙酯中混有乙酸
C. 溴水和酸性高锰酸钾溶液都可以用来除去乙烷中的乙烯
D. 只用新制氢氧化铜(可加热)可以区分乙醇、乙醛、乙酸
5. 下列物质的性质或相关数据与氢键无关的是
A. 氨气易液化
B. 二甲醚微溶于水,而乙醇可与水以任意比例混溶
C. HF(g)分解时吸收的热量比 HCl(g)分解时吸收的热量多
D. 邻羟基苯甲酸( )熔点为 159℃,对羟基苯甲酸( )熔点为 213℃6.下列关于基本营养物质的说法不正确的是
A. 动物脂肪在碱性条件下水解,可得到高级脂肪酸和甘油
B. 淀粉、纤维素、麦芽糖在一定条件下都可转化为葡萄糖
C. 加入少量的硫酸铵能促进蛋白质的溶解
D. 核酸是由磷酸、戊糖、碱基通过一定方式形成的生物大分子
7.下列说法不正确的是
A. 单一波长的 X 射线通过水晶时,记录仪上会产生明锐的衍射峰
B.某些金属盐灼烧呈现不同焰色是因为电子从低能级跃迁至较高能级吸收光的波长不同
C.CS 在 CCl 中的溶解度远大于 H O 是因为 H O 为极性分子,而 CS 、CCl 为非极性分
2 4 2 2 2 4
子
D.CF COOH 酸性大于 CH COOH 是因为 F 的电负性大,导致 CF COOH 羟基极性大,易电离
3 3 3
8.N 为阿伏伽德罗常数,下列说法正确的是
A
A.1 mol C H O 中含σ键数目最多为 6N
2 4 A
B.标准状况下,11.2L CCl 含有分子数目为 0.5N
4 A
C.6 g 金刚石晶体中含有碳碳键的数目为 2N
A
D.14 g 乙烯和丙烯的混合气体中总原子数目为 3N
A
9.丙烯可发生如下转化,下列说法不正确的是
A.丙烯分子中最多 7 个原子共平面 B.X 的结构简式为 CH CH=CHBr
3
C.Y 与足量 KOH 醇溶液共热可生成丙炔 D.聚合物 Z 的链节为
10.X、Y、Z、M 四种主族元素,原子序数依次增大,分别位于三个不同短周期,Y 与 M 同主族,
Y 与 Z 核电荷数相差 2,Z 的原子最外层电子数是内层电子数的 3 倍。下列说法不正确的是
A.热稳定性:X
2
Z>YX
4
B.键角:YX
3+
>YX
3−
C.分子的极性:Y X >X Z D.共价晶体熔点:Y>M
2 2 2 2
11.关于化学式为[TiCl(H O) ]Cl ·H O 的配合物,下列说法正确的是
2 5 2 2
A.配位体是 Cl-和 H O,配位数是 8
2
B.中心离子是 Ti3+,配离子是[TiCl(H O) ]2+
2 5
高二化学试题卷 第 2 页(共 8 页)
C.该配离子中含有的化学键有离子键、共价键、配位键、氢键
学科网(北京)股份有限公司D.在 1 mol 该配合物中加入足量 AgNO 溶液,可以得到 3 mol AgCl 沉淀
3
12.下列反应的离子方程式正确的是
A. 硫酸铜溶液与过量氨水反应:Cu2+ + 4NH ·H O = [Cu(NH ) ]2+ + 4H O
3 2 3 4 2
B. 向银氨溶液中加盐酸:[Ag(NH 3 ) 2 ]+ + 2H+ = Ag+ + 2NH 4+
C. 将乙醇与足量酸性 K
2
Cr
2
O
7
溶液混合:Cr
2
O
7
2- + 3CH
3
CH
2
OH + 8H+ →3CH
3
CHO + 2Cr3+ +
7H O
2
D. 苯酚钠溶液通入少量的 CO :2 +CO +H O→2 +
2 2 2
13.物质微观结构决定宏观性质,进而影响用途。下列结构或性质不能解释其用途的是
选项 结构或性质 用途
硫化剂以二硫键将顺丁橡胶的线型结构连 硫化交联程度越大,获得弹性越好
A
接为网状结构 的顺丁橡胶
聚乙炔存在共轭大π键体系为电荷传递提
B 聚乙炔可用于制备导电高分子材料
供了通路
聚丙烯酸钠可用于制备高吸水性树
C 聚丙烯酸钠( )中含有亲水基团
脂
冠醚 18-冠-6 空腔直径(260-320pm)与直径 冠醚 18-冠-6 可识别 K+ ,能增
D 大
K+(276pm)接近
KMnO 在有机溶剂中的溶解度
4
14.强酸 HBF 可由如下反应制备,HF + BF = HBF 。下列说法正确的是
4 3 4
A.相同条件下,HBF
4
酸性弱于 HF B.HBF
4
的电离方程式:HBF
4
= H+ + BF
4
-
C.BF 的空间结构是三角锥形 D.HBF 中含有离域π键
3 4
15.Mg Si 具有反萤石结构,晶胞结构如图所示,其晶胞参数为 a nm。下列叙述正确的是
2
A.基态 Mg 核外电子有 3 种不同的空间运动状态
B.每个硅原子周围有 4 个镁原子
C.Mg 与 Si 之间的最近距离为
高二化 题卷 第 3 页(共 8 页)
学科网(北京)股份有限公司D.Mg Si 的密度计算式为
2
16.下列方案设计、现象和结论正确的是
选项 目的 方案设计 现象和结论
溶液分层,观察到紫
探究用“相似 将一小粒碘晶体溶于约 5mL 蒸馏水中,
红 色 的 碘 的 乙
A 相溶”规律理 观察碘在水中的溶解性。加入约 1mL 乙 醇 溶
解 I 2 的溶解性 醇,振荡试管,观察溶液颜色变化 液,说明碘易溶于有
机溶剂
检验乙醇与浓
溴水褪色,说明乙醇
硫 酸 在 170℃将乙醇与浓硫酸在 170℃下反应的气体
B 发生消去反应生成乙
下反应的气体 通入溴水中
烯
产物
甲 苯 中 KMnO 溶 液
4
探究苯环与烷 分别向盛有 2mL 苯和 2mL 甲苯的试管 褪 色 , 苯 中
C
基的相互作用 中加入几滴酸性 KMnO 4 溶液,振荡 KMnO 4
溶液不褪色,说明甲
基活化了苯环
取 2mL 样品于试管中,加入 5mL20%
检验有机物中
NaOH 水溶液混合后加热,反应完全后, 无沉淀生成,说明有
D 是否含有卤素
待反应液冷却,加入足量稀硝酸,再滴 机物中不含卤素原子
原子
加 AgNO 溶液
3
非选择题部分
二、非选择题(本大题共 5 小题,共 52 分)
17.(10 分)以淀粉为基本原料可制备许多物质,如:
①
② 淀粉 葡萄糖
[CH OH(CHOH) CHO]
2 4
请回答下列问题:
(1)上述①-⑤反应中,属于消去反应的是 ;属于氧化反应的是 。
(填写序号)
(2)若乙醇中的 O 原子用 18O 标记(乙酸中的 O 不需标记),写出乙醇与乙酸反应生成乙
酸乙酯的化学方程式: 。
(3)下列有关说法不正确的是__________
A.可用碘水检验淀粉是否水解完全
高二化学试题卷 第 4 页(共 8 页)
学科网(北京)股份有限公司B.淀粉是生物大分子物质,反应①的反应条件是:稀硫酸,加热
C.乙烯、聚乙烯分子中均含有碳碳双键,均可被酸性 KMnO 溶液氧化
4
D.可利用红外光谱或核磁共振氢谱来区别葡萄糖和乙醛
(4)将 3.00 g 某有机物(仅含 C、H、O 元素,相对分子质量为 150)样品置于燃烧器中充分
燃烧,依次通过吸水剂、CO 吸收剂,燃烧产物被完全吸收。实验数据如下表:
2
吸水剂 CO 吸收剂
2
实验前质量/g 20.00 26.48
实验后质量/g 21.08 30.00
①燃烧产物中水的物质的量为_________mol。
②该有机物的分子式为__________________。
18.(10 分)前四周期元素 A、B、C、D、E、F 的原子序数依次增大,其相关性质如表所示:
A 原子核外有 6 种运动状态不同的电子
B 元素原子的核外 p 电子数比 s 电子数少 1 个
C 地壳中含量最多的非金属元素
D 基态原子核外有 6 个原子轨道排有电子,且只有 1 个未成对电子
E E3+第三周期中半径最小的简单离子
F 基态 F+各能级电子全充满
请回答下列问题:
(1)F 是_______区的元素;写出 D C 化合物的电子式:_____________。
2 2
(2)A、B、C 元素中,电负性最大的是________;第一电离能最大的是__________。(填
元素符号)
(3)B 单质分子中σ键和π键的个数比________,C 的简单氢化物在同族元素的简单氢化物
中沸点出现反常,其原因是________________________________________________。
(4)写出E 元素的最高价氧化物与D 的最高价氧化物对应水化物反应的离子方程式__________。
(5)实验室合成一种由 A 和 B 两种元素形成的化合物,该化合物具有三维骨架结构。其中
每个 A 原子与 4 个 B 原子形成共价键,每个 B 原子与 3 个 A 原子形成共价键,其化
学式为________。
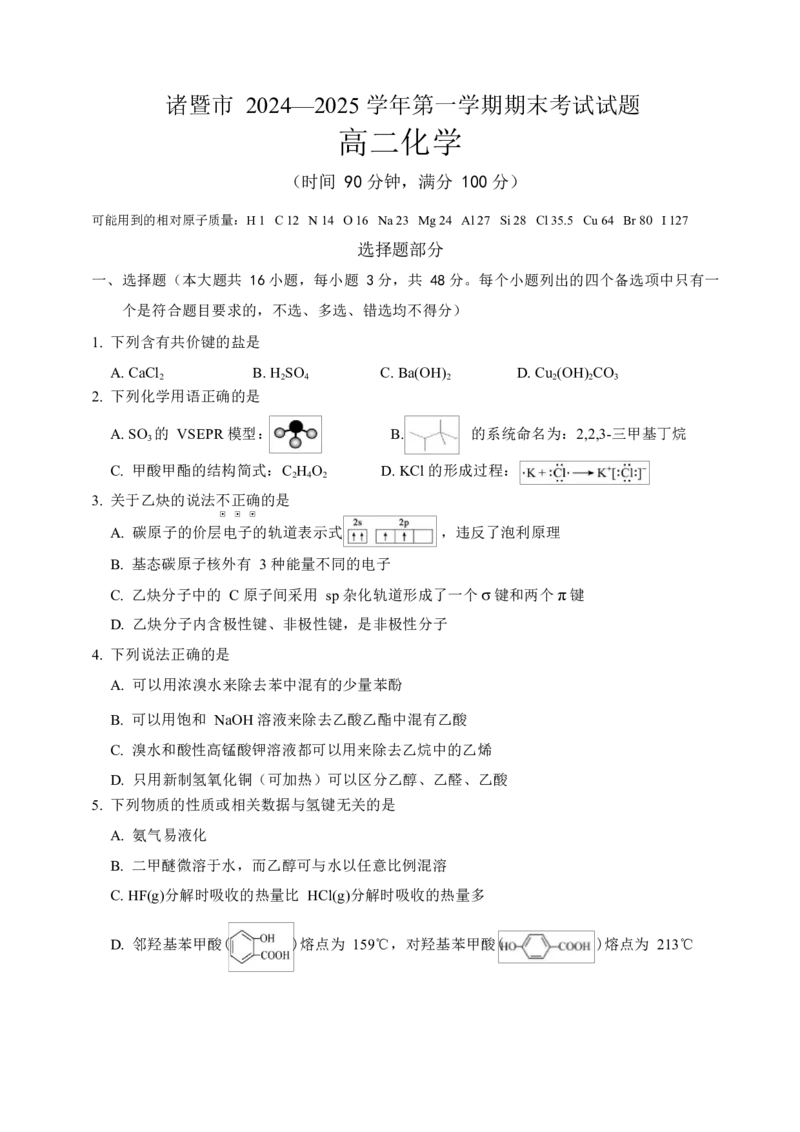
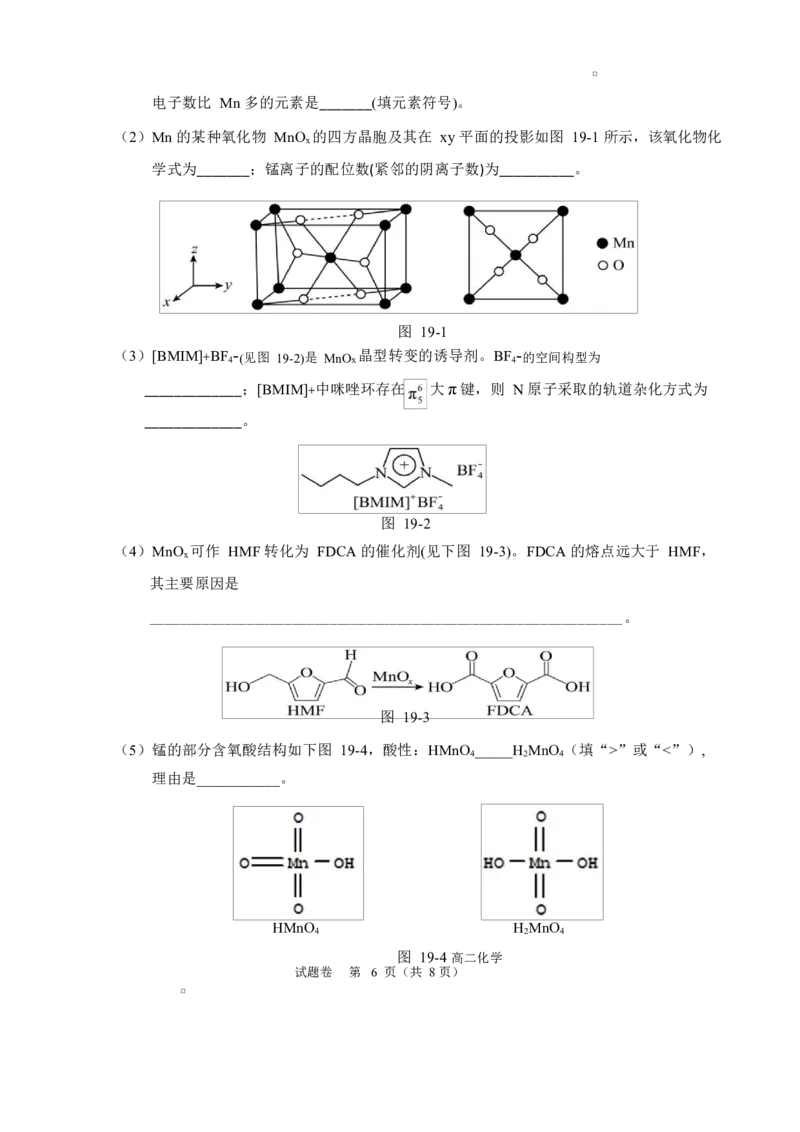
19.(10 分)锰氧化物具有较大应用价值,请回答下列问题:
(1)基态 Mn 原子的简化电子排布式:__________________;同周期中,基态原子未成对
高二化学试题卷 第 5 页(共 8 页)
学科网(北京)股份有限公司电子数比 Mn 多的元素是_______(填元素符号)。
(2)Mn 的某种氧化物 MnO 的四方晶胞及其在 xy 平面的投影如图 19-1 所示,该氧化物化
x
学式为_______;锰离子的配位数(紧邻的阴离子数)为__________。
图 19-1
(3)[BMIM]+BF 4 - (见图 19-2)是 MnOx 晶型转变的诱导剂。BF 4 - 的空间构型为
_____________;[BMIM]+中咪唑环存在 大π键,则 N 原子采取的轨道杂化方式为
_____________。
图 19-2
(4)MnO 可作 HMF 转化为 FDCA 的催化剂(见下图 19-3)。FDCA 的熔点远大于 HMF,
x
其主要原因是
_______________________________________________________________。
图 19-3
(5)锰的部分含氧酸结构如下图 19-4,酸性:HMnO _____H MnO (填“>”或“<”),
4 2 4
理由是___________。
HMnO H MnO
4 2 4
图 19-4 高二化学
试题卷 第 6 页(共 8 页)
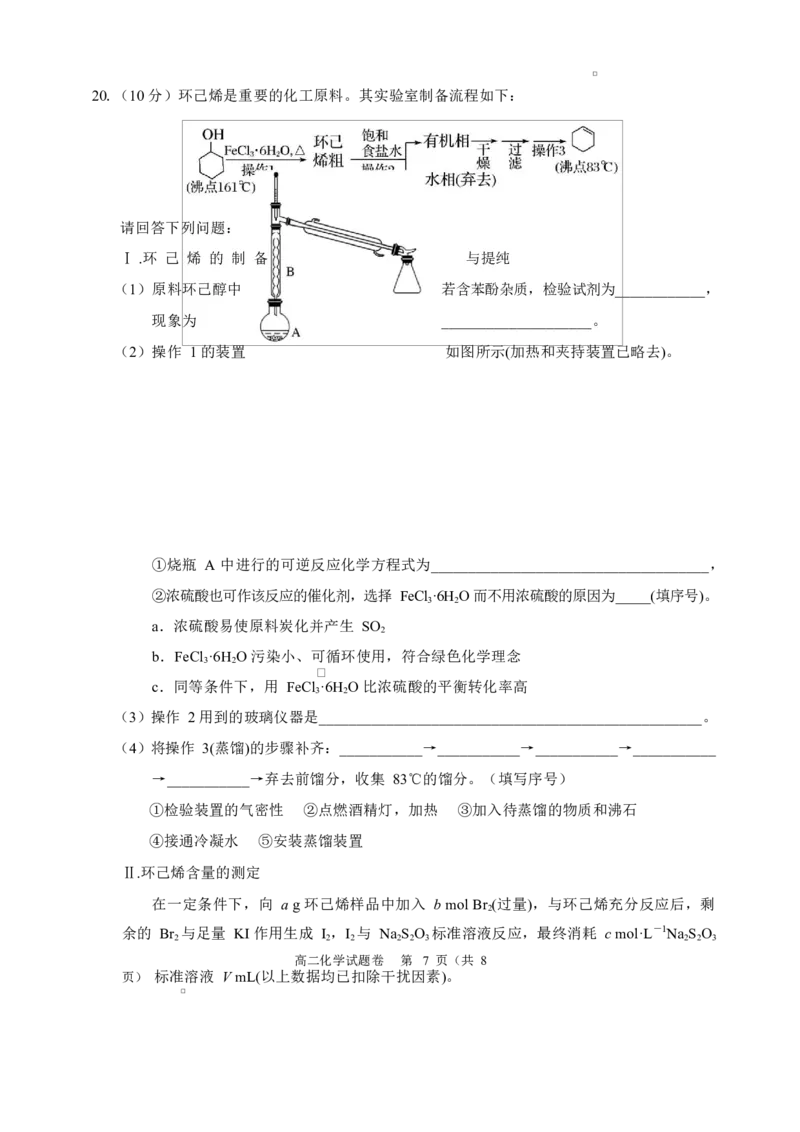
学科网(北京)股份有限公司20.(10 分)环己烯是重要的化工原料。其实验室制备流程如下:
请回答下列问题:
Ⅰ .环 己 烯 的 制 备 与提纯
(1)原料环己醇中 若含苯酚杂质,检验试剂为____________,
现象为 ____________________。
(2)操作 1 的装置 如图所示(加热和夹持装置已略去)。
①烧瓶 A 中进行的可逆反应化学方程式为_____________________________________,
②浓硫酸也可作该反应的催化剂,选择 FeCl ·6H O 而不用浓硫酸的原因为_____(填序号)。
3 2
a.浓硫酸易使原料炭化并产生 SO
2
b.FeCl ·6H O 污染小、可循环使用,符合绿色化学理念
3 2
c.同等条件下,用 FeCl ·6H O 比浓硫酸的平衡转化率高
3 2
(3)操作 2 用到的玻璃仪器是___________________________________________________。
(4)将操作 3(蒸馏)的步骤补齐:___________→___________→___________→___________
→___________→弃去前馏分,收集 83℃的馏分。(填写序号)
①检验装置的气密性 ②点燃酒精灯,加热 ③加入待蒸馏的物质和沸石
④接通冷凝水 ⑤安装蒸馏装置
Ⅱ.环己烯含量的测定
在一定条件下,向 a g 环己烯样品中加入 b mol Br (过量),与环己烯充分反应后,剩
2
余的 Br 与足量 KI 作用生成 I ,I 与 Na S O 标准溶液反应,最终消耗 c mol·L-1Na S O
2 2 2 2 2 3 2 2 3
高二化学试题卷 第 7 页(共 8
页) 标准溶液 V mL(以上数据均已扣除干扰因素)。
学科网(北京)股份有限公司测定过程中,发生的反应如下:
①Br +
2
②Br +2KI==I +2KBr
2 2
③I +2Na S O ==2NaI+Na S O
2 2 2 3 2 4 6
(5)样品中环己烯的质量分数为________(用字母表示)。
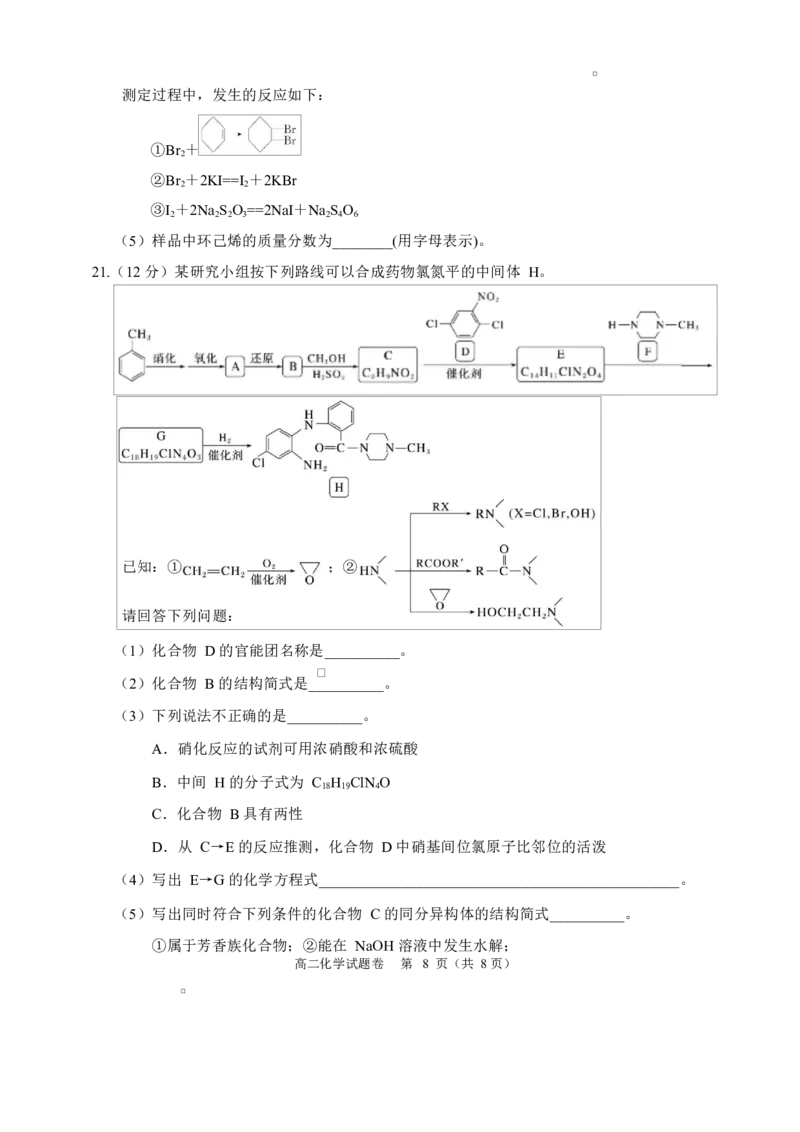
21.(12 分)某研究小组按下列路线可以合成药物氯氮平的中间体 H。
已知:① ;②
请回答下列问题:
(1)化合物 D 的官能团名称是__________。
(2)化合物 B 的结构简式是__________。
(3)下列说法不正确的是__________。
A.硝化反应的试剂可用浓硝酸和浓硫酸
B.中间 H 的分子式为 C H ClN O
18 19 4
C.化合物 B 具有两性
D.从 C→E 的反应推测,化合物 D 中硝基间位氯原子比邻位的活泼
(4)写出 E→G 的化学方程式________________________________________________。
(5)写出同时符合下列条件的化合物 C 的同分异构体的结构简式__________。
①属于芳香族化合物;②能在 NaOH 溶液中发生水解;
高二化学试题卷 第 8 页(共 8 页)
学科网(北京)股份有限公司③1H-NMR 谱和 IR 谱检测表明:分子中共有 4 种不同化学环境的氢原子。
(6)设计以 CH ==CH 和 CH NH 为原料合成 F( )的路线(用流程图表示,无
2 2 3 2
机试剂任选)______________________________________________________________。
高二化学试题卷 第 9 页(共 8 页)
学科网(北京)股份有限公司