文档内容
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第2课时 元素周期表
一、单选题
1.下列说法中,正确的是
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
【答案】B
【解析】
A.在周期表里,主族元素所在的族序数等于原子核外最外层电子数,而不是电子数,故A错误;
B.原子的结构决定元素在周期表中的位置,原子核电电子层数等于周期数,最外层电子数决定主族元素
在周期表中的族序数,故B正确;
C.最外层电子数为8的粒子可能为原子或离子,如为原子,则为稀有气体元素,故C错误;
D.同周期元素的原子半径从左到右逐渐减小,如为同主族,则原子序数越大,半径越大,故D错误;
答案选B。
2.已知某离子的结构示意图为 ,下列说法正确的是( )
A.该元素位于第二周期ⅡA族
B.该元素位于第二周期Ⅶ族
C.该元素位于第三周期ⅡA族
D.该元素位于第二周期0族
【答案】C
【解析】
据离子结构示意图得元素是12号,位于该元素位于第三周期ⅡA族,C项正确;答案选C。
3.“玉兔”号月球车用 作为热源材料。下列关于 的说法正确的是( )
A. 与 互为同位素 B. 与 互为同素异形体C. 与 具有相同的最外层电子数 D. 与 具有完全相同的物理性质
【答案】C
【解析】
A.有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素, 与 质子数不同,不
是同位素,A错误;
B. 与 质子数不同,不是同一种元素,不互为同素异形体,B错误;
C. 与 具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,C正确;
D. 与 为同位素,具有物理性质不是完全相同,D错误。
答案为C。
4.长式周期表共有18个纵行,碱金属为第1列,稀有气体元素为第18列。按这种规定下列说法正确的是
( )
A.第四周期第9列元素是铁元素
B.只有第二列的元素原子最外层电子排布为ns2
C.第9列中元素中没有非金属元素
D.第10、11列为ds区
【答案】C
【解析】
A. 第四周期第9列元素是钴元素,铁元素处于第四周期第8列,A项错误;
B.氦原子及一些过渡元素原子最外层电子排布也为ns2,B项错误;
C.第9列属于Ⅷ族,都是金属元素,没有非金属元素,C项正确;
D.第10列属于Ⅷ族,为d区;第11列属于ⅠB族,为ds区,D项错误;
答案选C。
5.下列事件是近代化学发展的里程碑的是
①门捷列夫发现元素周期律 ②亚里士多德提出的“四元素”论 ③波义耳提出化学元素的概念 ④拉瓦
锡提出氧化学说 ⑤道尔顿提出原子论 ⑥中国道教的炼丹术
A.①③④⑤ B.①②③⑤ C.①②③④ D.①②④⑤
【答案】A
【解析】1661年英国科学家波义耳提出化学元素的概念,标志着近代化学的诞生;1771年法国科学家拉瓦锡建立燃
烧现象的氧化学说,使近代化学取得了革命性的进展;1803年英国科学家道尔顿提出原子学说,为近代化
学的发展奠定了坚实的基础;1869年俄国科学家门捷列夫发现元素周期律,把化学元素及其化合物纳入一
个统一的理论体系。所以属于近代化学发展的里程碑的是①③④⑤,答案选A。
6. Sr常用于放射性同位素电池。下列关于 Sr的说法正确的是( )
A.电子数为52 B.质子数为52 C.中子数为38 D.质量数为90
【答案】D
【解析】
A. Sr的电子数为38,故A错误;
B. Sr的质子数为38,故B错误;
C. Sr的中子数为90-38=52,故C错误;
D. Sr的质量数为90,故D正确;
故答案为D。
7.我国科学院院士张青莲教授主持测定了铟、铱铕等几种元素的相对原子质量新值,其中铟元素在元素
周期表中的信息如图所示,则下列说法正确的是
A.铟元素原子的质子数为49 B.铟元素原子的中子数为49
C.铟元素属于非金属元素 D.钢元素原子的相对原子质量为 114.8g
【答案】A
【解析】
A.根据元素周期表中的一格可知,左上角的数字为49,表示原子序数为49,根据原子中原子序数=核电
荷数=质子数=核外电子数,则铟元素原子的质子数为49,故A正确;
B.根据元素周期表中的一格可知,左上角的数字为49,表示原子序数为49,根据原子中原子序数=核电
荷数=质子数=核外电子数,则铟元素原子的质子数和电子数为49,而不是铟元素原子的中子数为49,故B错误;
C.根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是铟,带“钅”字旁,属于
金属元素,故C错误;
D.根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为114.8,
相对原子质量单位是“1”,不是“克”,故D错误;
答案为A。
8.下列说法正确的是( )
A.元素周期表中元素排序的依据是原子的核电荷数
B.元素周期表有十六个纵列,也就是十六个族
C.原子的最外层电子数相同的元素,一定属于同一族
D.电子层数相同的粒子,对应元素一定属于同一周期
【答案】A
【解析】
A、元素周期表中元素排序的依据是原子的核电荷数,A项正确;
B、元素周期表有十八个纵列,也就是十六个族,B项错误;
C、原子的最外层电子数相同的元素,不一定属于同一族,C项错误;
D、电子层数相同的粒子,可能是原子也可能是离子,对应元素不一定属于同一周期,D项错误;
答案选A。
9.近年来我国政府强化了对稀土元素原料的出口管制,引起了美、日等国家的高度关注与不满。所谓
“稀土元素”是指镧系元素及第五周期ⅢB族的钇( Y),它们被称为“工业味精”。它们在军工生产、高
39
科技领域中有极为重要的作用,下列有关“稀土元素”的说法正确的是 ( )。
A.它们的原子核外均有5个电子层
B.它们的原子最外层均含有3个电子
C.它们均是金属元素
D.76Y、80Y中子数不同,化学性质不同
【答案】C
【解析】
A.镧系元素属于第六周期,而周期序数等于电子层数,则原子核外有6个电子层,选项A错误;
B.过渡元素最外层电子均只有1-2个,选项B错误;
C.过渡元素均为金属元素,选项C正确;
D.76Y、80Y互为同位素,化学性质几乎相同,选项D正确;答案选C。
10.前20号主族元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍,
X、Y、Z分属不同的周期,它们的原子序数之和是W原子序数的5倍,含有元素Z的盐的焰色反应为紫
色。下列说法正确的是
A.简单离子半径的大小Z > Y > W > X
B.简单氢化物的沸点W> X
C.Y是地壳中含量最多的金属元素
D.工业上通过电解W、Y组成的化合物制备单质Y
【答案】B
【解析】
W的原子最外层电子数是次外层电子数的3 倍,应为O元素,含有元素Z的盐的焰色反应为紫色,则Z为
K元素,X、Y、Z分属不同的周期,它们的原子序数之和是W原子序数的5倍,则X、Y的原子序数为
40-19=21,X为第二周期,Y为第三周期,且X的原子序数比W大,且为主族元素,应为F元素,则Y为
Mg元素。由以上分析可知W为O元素、X为F元素、Y为Mg元素、Z为K元素;
A. 钾离子有三个电子层,其余离子均两层,相同电子层数,核电荷数越大,半径越小,简单离子半径的大
小Z > W > X> Y,故A错误;
B. W为O,简单氢化物为水,X为F,简单氢化物为氟化氢,水的沸点高于氟化氢,故B正确;
C. Y为镁,地壳中含量最多的金属元素为铝,故C错误;
D. 工业电解熔融的氯化镁冶炼镁,故D错误;
答案选B。
二、填空题
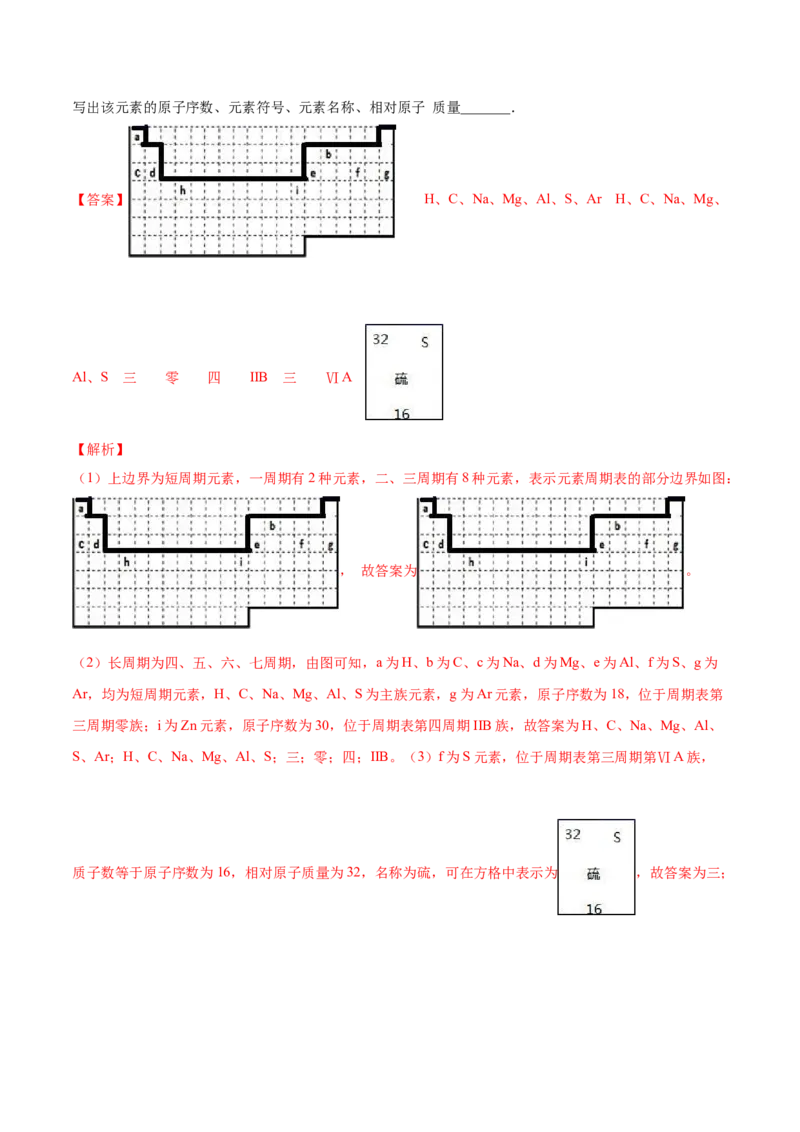
11.结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第
____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
【答案】 H、C、Na、Mg、Al、S、Ar H、C、Na、Mg、
Al、S 三 零 四 IIB 三 ⅥA
【解析】
(1)上边界为短周期元素,一周期有2种元素,二、三周期有8种元素,表示元素周期表的部分边界如图:
, 故答案为 。
(2)长周期为四、五、六、七周期,由图可知,a为H、b为C、c为Na、d为Mg、e为Al、f为S、g为
Ar,均为短周期元素,H、C、Na、Mg、Al、S为主族元素,g为Ar元素,原子序数为18,位于周期表第
三周期零族;i为Zn元素,原子序数为30,位于周期表第四周期IIB族,故答案为H、C、Na、Mg、Al、
S、Ar;H、C、Na、Mg、Al、S;三;零;四;IIB。(3)f为S元素,位于周期表第三周期第ⅥA族,
质子数等于原子序数为16,相对原子质量为32,名称为硫,可在方格中表示为 ,故答案为三;ⅥA; 。
12.短周期元素 、 、 、 在元素周期表中的位置如图所示,其中 所处的周期序数与主族序数相
等,请回答下列问题:
(1) 元素的原子结构示意图为__________________; 元素在元素周期表中的位置为____________。
(2)原子序数比 小2的元素是_________(填元素符号),它的单质在氧气中燃烧的化学方程式为
______________________________。
(3)原子序数比 大4的元素是______(填元素符号),该元素最高价氧化物的水化物溶液与 元素
最高价氧化物的水化物溶液反应的离子方程式为______________________________。
【答案】 第二周期ⅣA族
【解析】
短周期元素Q、R、T、W,根据元素所处的位置,可确定T、W为第三周期的元素,Q、R为第二周期元
素,T所处的周期序数与族序数相等,则T为Al元素,故Q为C元素,R为N元素,W为S元素。
(1)T为Al,原子核外有13个电子,原子结构示意图为 ;Q为C,原子核外有2个电子层,最外
层电子数为4,在周期表中的位置是第二周期ⅣA族;
(2)原子序数比Al小2的元素是Na,在氧气中燃烧生成过氧化钠,反应方程式为 ;
(3)原子序数比S大4的元素是Ca,该元素最高价氧化物的水化物是氢氧化钙,S元素最高价氧化物的水化物是硫酸,氢氧化钙溶液与硫酸溶液发生中和反应生成硫酸钙和水,离子方程式为
。