文档内容
2024-2025 学年第二学期 3 月单元过关考试
高二化学
考试时间90分钟,满分100分。
可能用到的相对原子质量:H-1 B 11 C-12 N-14 O-16 Mg−24 Al−27 Si−28 S-32
Cl 35.5 K 39 Ca-40 Ti-48 Mn 55 Fe 56 Ni−59 Cu 64 Se 79 La−139
一、选择题(本题共 10小题,每小题 2分,共 20 分。每小题只有一项是符合题目要求的)
1. 下列化学用语或图示表述正确的是
A. 激发态H原子的轨道表示式:
B. 空间填充模型 既可以表示甲烷分子,也可以表示四氯化碳分子
C. 基态As原子的简化电子排布式为 [Ar]4s24p5
D. CN−的电子式为
2. NCl 可发生水解反应NCl +3H O=NH +3HClO。下列说法错误的是
3 3 2 3
A. NCl 、NH 分子中键角较大的是NCl B. H O是由极性键构成的极性分子
3 3 3 2
C. 质量数为35的Cl原子可表示为35Cl D. HClO 的电子式为
17
3. 某分子结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,且
仅X、Y位于同一周期;Z原子的核外电子总数是其次外层电子数的 2倍。下列说法正确的
是
A. 原子半径:YXW
B. 该分子中X、Y、Z最外层均满足8e−
C. 元素Z的含氧酸均是强酸
D. W、Y、Z形成的化合物不可能含有离子键
点燃
4. 二氧化碳经常用来灭火,但金属镁能够在二氧化碳中燃烧:2Mg+CO 2MgO+C,
2
下列关于该反应中涉及物质的说法正确的是
A. Mg晶体采用了面心立方最密堆积的方式
B. 干冰中一个CO 分子周围有 4个紧邻的分子
2C. MgO熔点高,可以用作耐高温材料
D. 金刚石和石墨互为同素异形体,晶体结构中都有六元环,二者 C的杂化方式相同
5. 如图为某晶体的一个晶胞,若晶体中 Y的化合价部分为 0,部分为-2,则下列说法中正确
的是
A. 晶体中阴、阳离子配位数均为 8
B. 晶体中与每个X+距离相等且最近的X+有8个
C. 该晶体的化学式为XY ,每个晶胞含有 4个X+和 4个Y−
2 2
D. 晶体中,0价Y的原子与-2价Y的原子的数目之比为 1∶1
6. 下列关于化学键与晶体类型的说法正确的是
A. 在晶体中只要有阳离子就一定有阴离子
B 离子晶体中一定含有离子键,分子晶体中一定含有共价键
.
C. 只由非极性键构成的分子一定是非极性分子
D. 二氧化硅和干冰晶体熔化时所克服的作用力类型相同
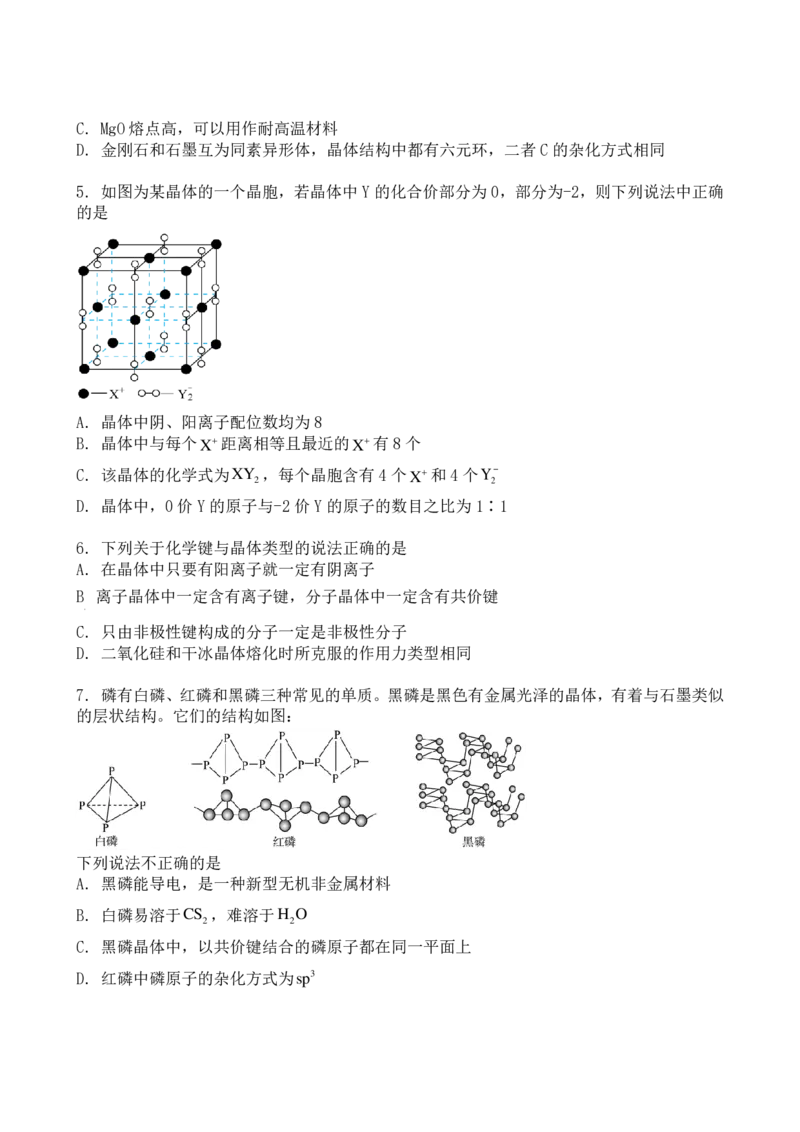
7. 磷有白磷、红磷和黑磷三种常见的单质。黑磷是黑色有金属光泽的晶体,有着与石墨类似
的层状结构。它们的结构如图:
下列说法不正确的是
A. 黑磷能导电,是一种新型无机非金属材料
B. 白磷易溶于CS ,难溶于H O
2 2
C. 黑磷晶体中,以共价键结合的磷原子都在同一平面上
D. 红磷中磷原子的杂化方式为sp38. 物质结构决定物质性质.下列性质差异与结构因素匹配错误的是
选
性质差异 结构因素
项
核外电子排
A 还原性:Na>Mg>Al
布
B 沸点: (131℃)> (31.36℃) 分子间氢键
分子间作用
C 稳定性:H SH SeH Te
2 2 2 力
D 熔点:金刚石>碳化硅>晶体硅 共价键键能
A. A B. B C. C D. D
H
N
N
9.噻唑( )中所有原子在同一平面上,能与 H 反应生成四氢噻唑( )。下列说法
2
S
S
错误的是
A.在水中的溶解度:噻唑>噻吩( )
S
B.噻唑中S原子提供2 个电子参与形成大π键
C.四氢噻唑的熔点主要取决于范德华力
D.C-S-C键角:噻唑>四氢噻唑
10.石墨烯(单层石墨)与 H 在一定条件下反应可合成新材料石墨烷[(CH)],其局部结构如
2 x
图。下列说法正确的是
A.石墨烯和石墨烷都属于有机物
B.13g石墨烷中含有2.5mol 共价单键
C.石墨烯和石墨烷均具有导电性
D.石墨烯转化为石墨烷的过程中,相邻碳原子间的距离不变
二、选择题:(本题共 5 小题,每小题 4 分,共 20 分。在每小题给出的四个选项中,有一个
或两个选项符合题目要求。全部选对的得 4分,选对但不全的得 2分,有选错的得 0分)
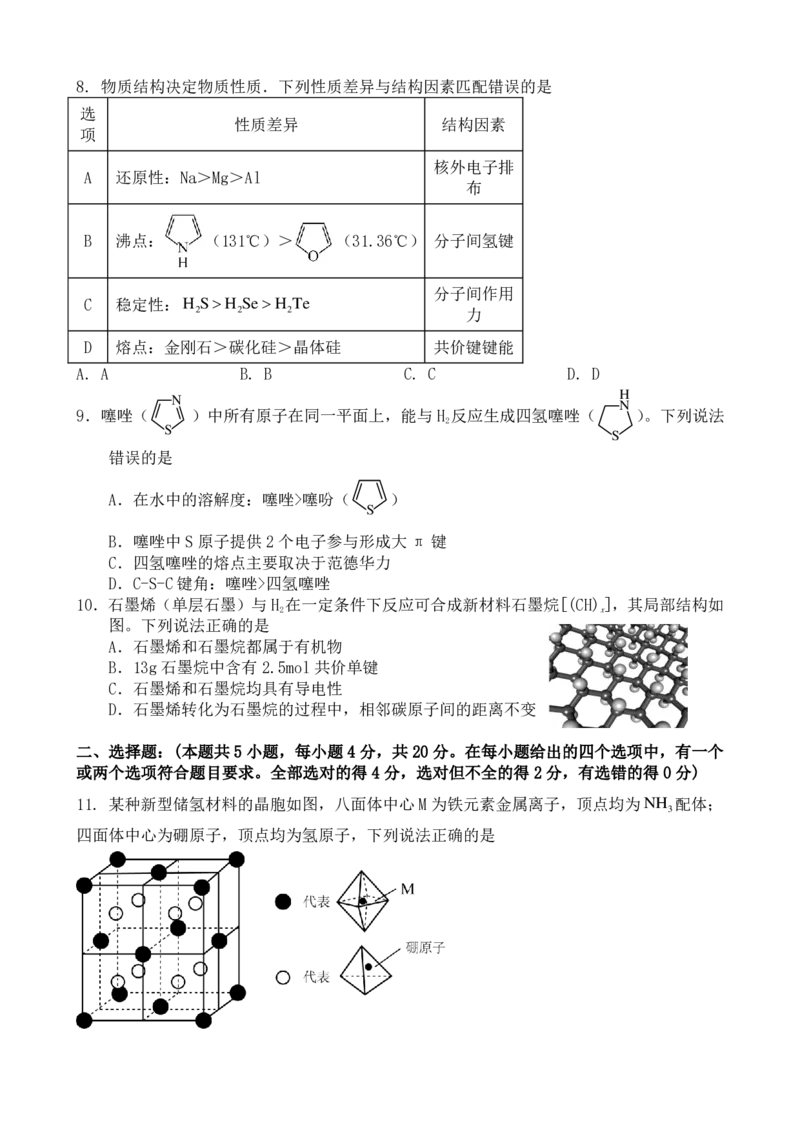
11. 某种新型储氢材料的晶胞如图,八面体中心 M为铁元素金属离子,顶点均为NH 配体;
3
四面体中心为硼原子,顶点均为氢原子,下列说法正确的是A. 黑球微粒的化学式为Fe(NH ) 3+ B. 白球微粒中存在配位键,硼原子提供空轨道
3 6
C. 晶体中NH 分子间可能存在氢键作用 D. 晶体中所含元素电负性大小顺序 N>B>H>Fe
3
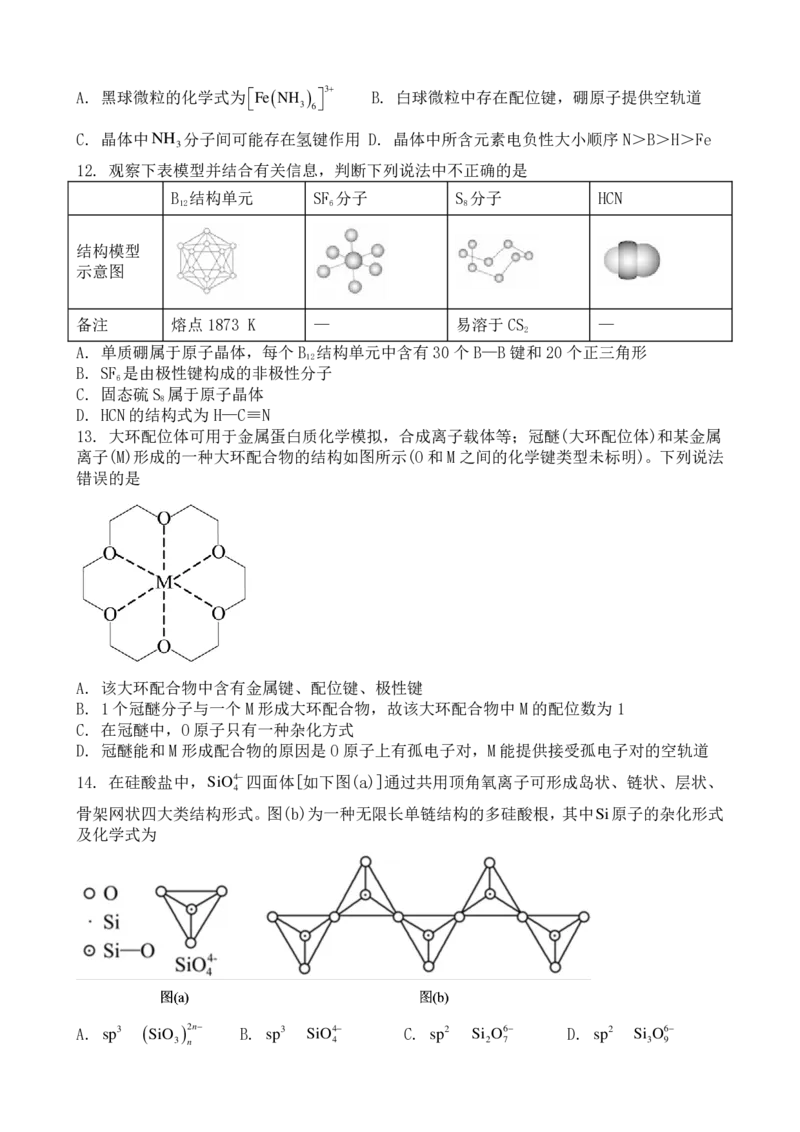
12. 观察下表模型并结合有关信息,判断下列说法中不正确的是
B 结构单元 SF 分子 S 分子 HCN
12 6 8
结构模型
示意图
备注 熔点1873 K — 易溶于CS —
2
A. 单质硼属于原子晶体,每个 B 结构单元中含有30 个B—B键和20个正三角形
12
B. SF 是由极性键构成的非极性分子
6
C. 固态硫S 属于原子晶体
8
D. HCN的结构式为H—C≡N
13. 大环配位体可用于金属蛋白质化学模拟,合成离子载体等;冠醚(大环配位体)和某金属
离子(M)形成的一种大环配合物的结构如图所示(O和 M之间的化学键类型未标明)。下列说法
错误的是
A. 该大环配合物中含有金属键、配位键、极性键
B. 1个冠醚分子与一个M形成大环配合物,故该大环配合物中 M的配位数为1
C. 在冠醚中,O原子只有一种杂化方式
D. 冠醚能和M形成配合物的原因是 O原子上有孤电子对,M能提供接受孤电子对的空轨道
14. 在硅酸盐中,SiO4−四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、
4
骨架网状四大类结构形式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式
及化学式为
A. sp3 (SiO )2n− B. sp3 SiO4− C. sp2 Si O6− D. sp2 Si O6−
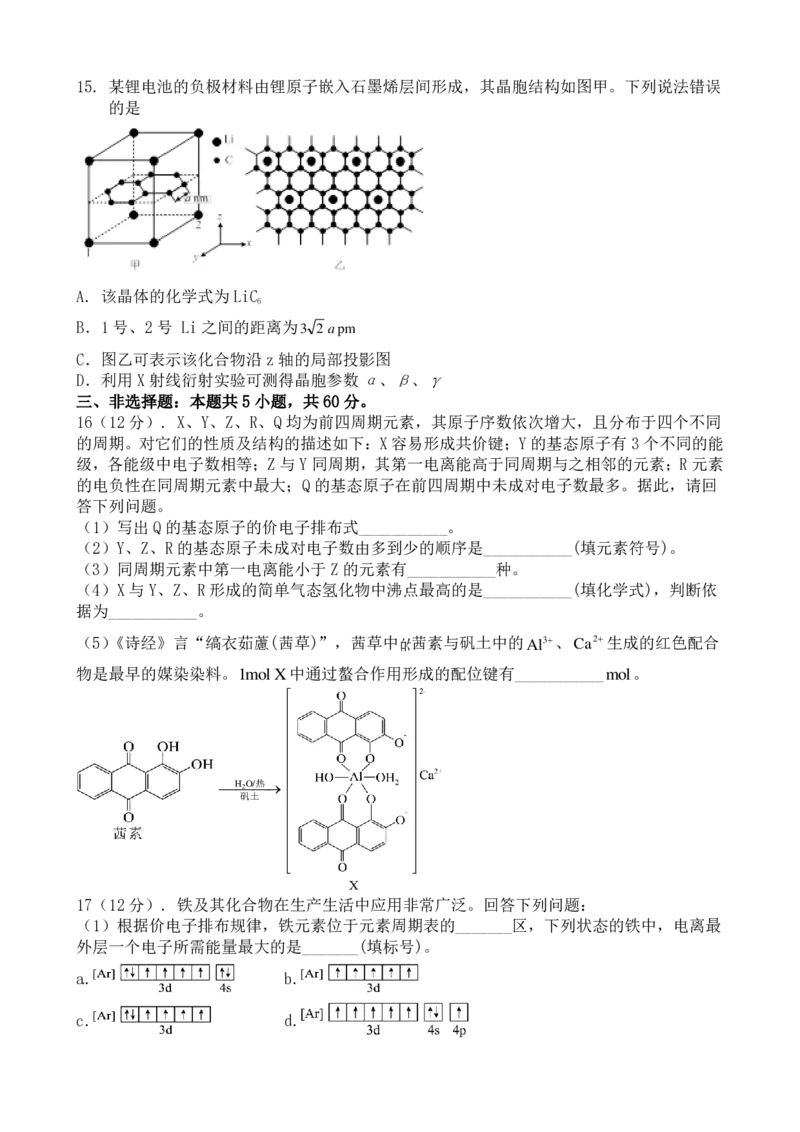
3 n 4 2 7 3 915. 某锂电池的负极材料由锂原子嵌入石墨烯层间形成,其晶胞结构如图甲。下列说法错误
的是
A. 该晶体的化学式为LiC
6
B.1号、2号 Li之间的距离为3 2 a pm
C.图乙可表示该化合物沿z 轴的局部投影图
D.利用 X射线衍射实验可测得晶胞参数α、β、γ
三、非选择题:本题共 5小题,共 60分。
16(12分). X、Y、Z、R、Q均为前四周期元素,其原子序数依次增大,且分布于四个不同
的周期。对它们的性质及结构的描述如下:X容易形成共价键;Y的基态原子有 3个不同的能
级,各能级中电子数相等;Z 与Y同周期,其第一电离能高于同周期与之相邻的元素;R元素
的电负性在同周期元素中最大;Q的基态原子在前四周期中未成对电子数最多。据此,请回
答下列问题。
(1)写出Q的基态原子的价电子排布式___________。
(2)Y、Z、R的基态原子未成对电子数由多到少的顺序是___________(填元素符号)。
(3)同周期元素中第一电离能小于 Z的元素有___________种。
(4)X与Y、Z、R形成的简单气态氢化物中沸点最高的是___________(填化学式),判断依
据为___________。
(5)《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的Al3+、Ca2+生成的红色配合
物是最早的媒染染料。1mol X中通过螯合作用形成的配位键有___________mol。
⎯H⎯2 O/⎯热→
矾土
17(12分). 铁及其化合物在生产生活中应用非常广泛。回答下列问题:
(1)根据价电子排布规律,铁元素位于元素周期表的_______区,下列状态的铁中,电离最
外层一个电子所需能量最大的是_______(填标号)。
a. b.
c. d.(2)有历史记载的第一个配合物是 Fe[Fe(CN)](普鲁士蓝),[Fe(CN)]4-中σ 键数目为
4 6 3 6
_______,Fe2+的杂化方式为_______(填标号)。
a.sp2 b.sp3 c.d2sp3 d.dsp3
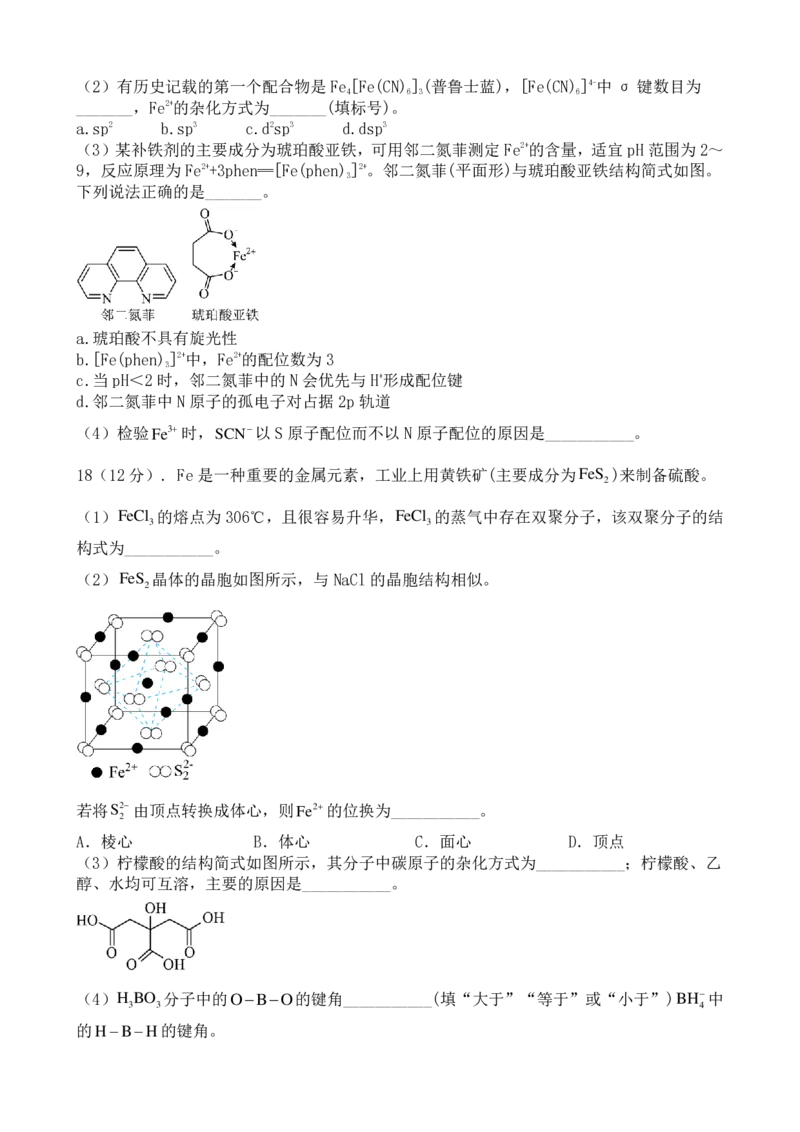
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定 Fe2+的含量,适宜 pH范围为2~
9,反应原理为 Fe2++3phen═[Fe(phen) ]2+。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。
3
下列说法正确的是_______。
a.琥珀酸不具有旋光性
b.[Fe(phen) ]2+中,Fe2+的配位数为 3
3
c.当pH<2时,邻二氮菲中的 N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据 2p轨道
(4)检验Fe3+时,SCN−以 S原子配位而不以N原子配位的原因是___________。
18(12分). Fe是一种重要的金属元素,工业上用黄铁矿(主要成分为FeS )来制备硫酸。
2
(1)FeCl 的熔点为306℃,且很容易升华,FeCl 的蒸气中存在双聚分子,该双聚分子的结
3 3
构式为___________。
(2)FeS 晶体的晶胞如图所示,与 NaCl的晶胞结构相似。
2
若将S2−由顶点转换成体心,则Fe2+的位换为___________。
2
A.棱心 B.体心 C.面心 D.顶点
(3)柠檬酸的结构简式如图所示,其分子中碳原子的杂化方式为___________;柠檬酸、乙
醇、水均可互溶,主要的原因是___________。
(4)H BO 分子中的O−B−O的键角___________(填“大于”“等于”或“小于”)BH−中
3 3 4
的H−B−H的键角。
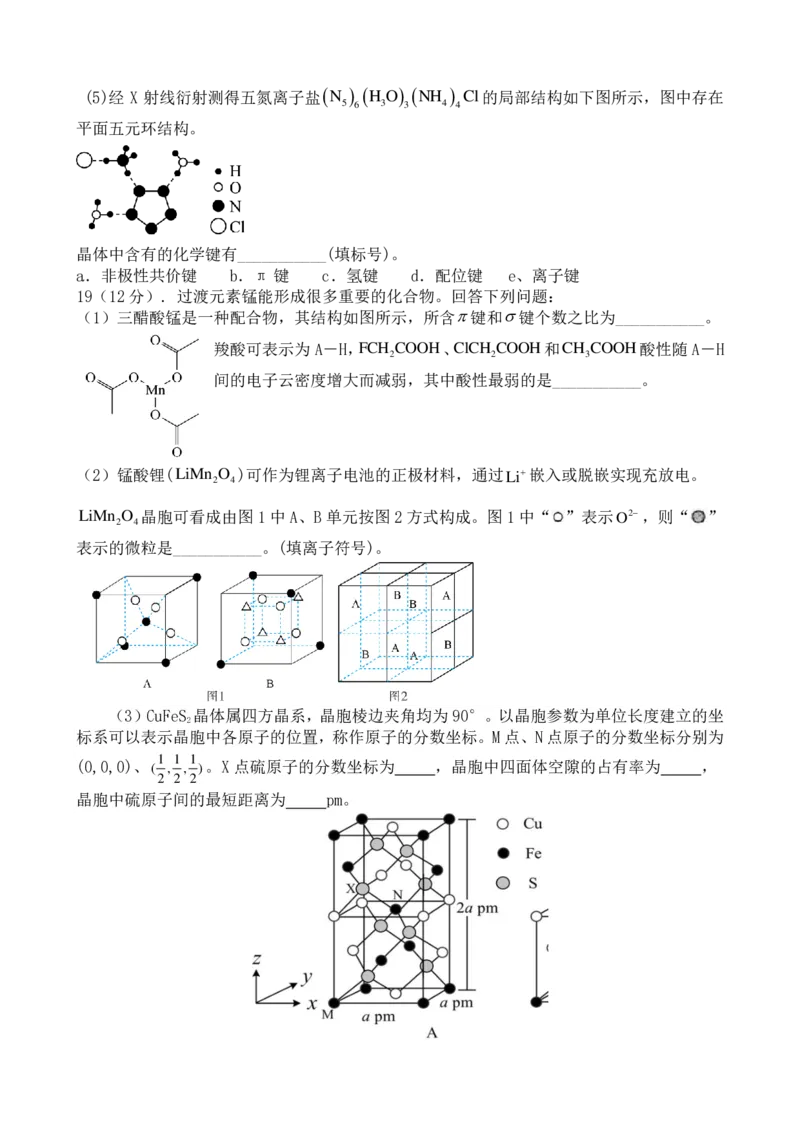
{#{QQABbY4QggCAABBAAAhCEwHACAGQkACACQoOhFAcoAAAwRFABAA=}#}(5)经 X 射线衍射测得五氮离子盐(N ) (H O) (NH ) Cl的局部结构如下图所示,图中存在
5 6 3 3 4 4
平面五元环结构。
晶体中含有的化学键有___________(填标号)。
a.非极性共价键 b.π 键 c.氢键 d.配位键 e、离子键
19(12分). 过渡元素锰能形成很多重要的化合物。回答下列问题:
(1)三醋酸锰是一种配合物,其结构如图所示,所含键和键个数之比为___________。
羧酸可表示为 A―H,FCH COOH、ClCH COOH和CH COOH酸性随A―H
2 2 3
间的电子云密度增大而减弱,其中酸性最弱的是___________。
(2)锰酸锂(LiMn O )可作为锂离子电池的正极材料,通过Li+嵌入或脱嵌实现充放电。
2 4
LiMn O 晶胞可看成由图1 中A、B单元按图2方式构成。图 1中“ ”表示O2−,则“ ”
2 4
表示的微粒是___________。(填离子符号)。
(3)CuFeS 晶体属四方晶系,晶胞棱边夹角均为 90°。以晶胞参数为单位长度建立的坐
2
标系可以表示晶胞中各原子的位置,称作原子的分数坐标。M点、N点原子的分数坐标分别为
1 1 1
(0,0,0)、( , , )。X点硫原子的分数坐标为 ,晶胞中四面体空隙的占有率为 ,
2 2 2
晶胞中硫原子间的最短距离为 pm。20(12分). 中国科学报报道钙钛矿太阳能电池在柔性可穿戴电子设备等方面具有独特的优
势和巨大的用潜力。钛酸钙晶胞如图所示:
已知:钙原子与钛原子之间的最近距离为 xnm。
回答下列问题::
(1)基态Ti2+的核外价电子排布图为___________,Al原子核外电子的空间运动状态有
___________种
(2)Ti的四卤化物熔点如下表所示,TiF 熔点高于其他三种卤化物,自TiCl 至TiI 熔点依
4 4 4
高,原因是___________。
化
合 TiF TiCl TiBr TiI
4 4 4 4
物
熔
点 377 -24.12 38.3 155
/℃
(3)钛酸钙的组成元素的电负性大小顺序是___________。
(4)如图晶胞结构的化学式为___________;Ti4+的配位数为___________。
(5)晶体密度为___________gcm−3(列出计算式)。2024-2025 学年第二学期 3 月单元过关考试
高二化学
一、选择题(本题共 10小题,每小题 2分,共 20 分。每小题只有一项是符合题目要求的)
1.D 2. A 3. B 4. C 5. C 6. C 7. C 8. C 9.C 10.B
二、选择题:(本题共 5 小题,每小题 4 分,共 20 分。在每小题给出的四个选项中,有一个
或两个选项符合题目要求。全部选对的得 4分,选对但不全的得 2分,有选错的得 0分)
11. BC 12. C 13. AB 14. A 15. BC
三、非选择题:共 5小题,共 60 分。除标注外,每空 2 分。
16(12分). (1) 3d54s1 (2)N、C、Cl (3)5
(4) ①. NH ②. NH 分子间能形成氢键 (5)4
3 3
17(12分). (1) ①. d ②. b (2) ①. 12 ②. c
(3)ac (4)S元素的电负性小,SCN−中S原子易提供孤电子对
18(12分).
(1) . (2). CD
(3) ①. sp2、sp3 ②. 柠檬酸、乙醇、水分子间可以形成氢键
(4) . 大于 (5) . abde
19(12分).(1) ①. 1:7 ②. CH COOH (2) Li+
3
1 1 5 2
(3)( , , ) 50% a
4 4 8 2
20(12分).(1) ①. (1分) ②. 7 (1分)
(2)TiF 为离子晶体熔点高,TiCl 、TiBr 、TiI 为分子晶体,相对分子质量依次增大,范
4 4 4 4
德华力依次增强,熔点依次升高
(3)O>Ti>Ca (4) ①. CaTiO ②. 6
3
51 3
(5)
N
( x10−7)3
A