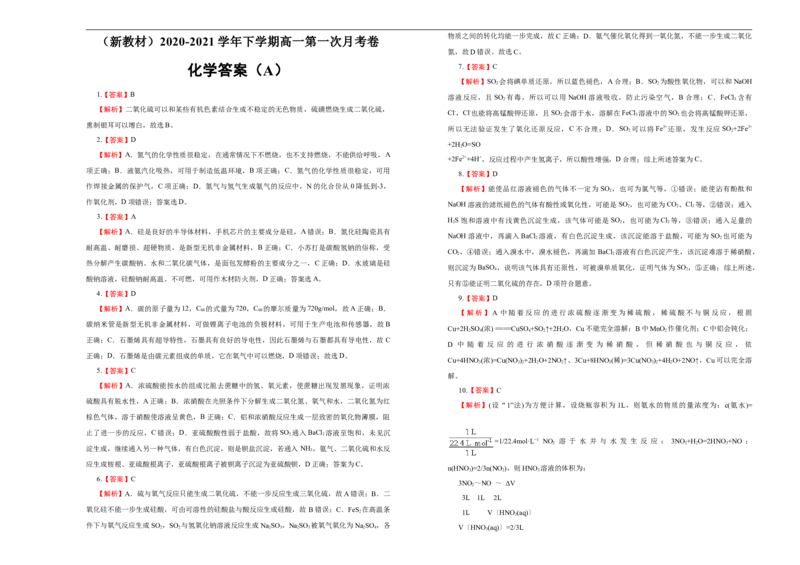文档内容
5.对下列事实的解释错误的是
(新教材)下学期高一第一次月考卷
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
化 学(A) B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.常温下,浓硝酸可以用铝制器皿贮存,说明铝与浓硝酸不反应
注意事项: D.将SO 通入BaCl 溶液至饱和,未见沉淀生成,继续通入另一种气体,有白色沉淀,则通入
2 2
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码
的气体可能是NH
3
粘贴在答题卡上的指定位置。 6.下列物质之间的转化都能一步实现的是
2.选择题的作答:每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑, A.HS→S→SO →HSO B.Si→SiO→HSiO→NaSiO
2 3 2 4 2 2 3 2 3
写在试题卷、草稿纸和答题卡上的非答题区域均无效。 C.FeS→SO →NaSO →NaSO D.N→NH →NO →HNO→NO
2 2 2 3 2 4 2 3 2 3 2
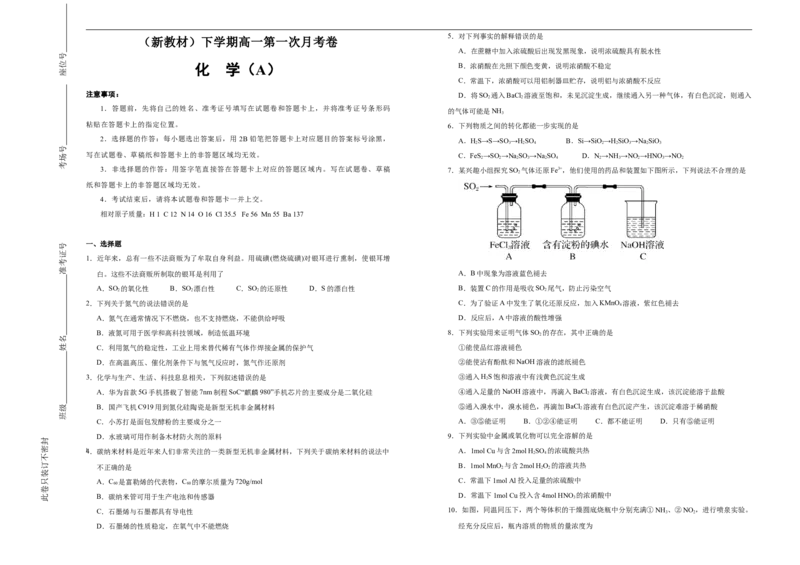
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿 7.某兴趣小组探究SO 气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
2
纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
一、选择题
1.近年来,总有一些不法商贩为了牟取自身利益。用硫磺(燃烧硫磺)对银耳进行熏制,使银耳增
白。这些不法商贩所制取的银耳是利用了 A.B中现象为溶液蓝色褪去
A.SO 的氧化性 B.SO 漂白性 C.SO 的还原性 D.S的漂白性 B.装置C的作用是吸收SO 尾气,防止污染空气
2 2 2 2
2.下列关于氮气的说法错误的是 C.为了验证A中发生了氧化还原反应,加入KMnO 溶液,紫红色褪去
4
A.氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸 D.反应后,A中溶液的酸性增强
B.液氮可用于医学和高科技领域,制造低温环境 8.下列实验用来证明气体SO 的存在,其中正确的是
2
C.利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气 ①能使品红溶液褪色
D.在高温高压、催化剂条件下与氢气反应时,氮气作还原剂 ②能使沾有酚酞和NaOH溶液的滤纸褪色
3.化学与生产、生活、科技息息相关,下列叙述错误的是 ③通入HS饱和溶液中有浅黄色沉淀生成
2
A.华为首款5G手机搭载了智能7nm制程SoC“麒麟980”手机芯片的主要成分是二氧化硅 ④通入足量的NaOH溶液中,再滴入BaCl 溶液,有白色沉淀生成,该沉淀能溶于盐酸
2
B.国产飞机C919用到氮化硅陶瓷是新型无机非金属材料 ⑤通入溴水中,溴水褪色,再滴加BaCl 溶液有白色沉淀产生,该沉淀难溶于稀硝酸
2
C.小苏打是面包发酵粉的主要成分之一 A.③⑤能证明 B.①②④能证明 C.都不能证明 D.只有⑤能证明
D.水玻璃可用作制备木材防火剂的原料 9.下列实验中金属或氧化物可以完全溶解的是
4.碳纳米材料是近年来人们非常关注的一类新型无机非金属材料,下列关于碳纳米材料的说法中 A.1mol Cu与含2mol HSO 的浓硫酸共热
2 4
不正确的是 B.1mol MnO 2 与含2mol H 2 O 2 的溶液共热
A.C 是富勒烯的代表物,C 的摩尔质量为720g/mol C.常温下1mol Al投入足量的浓硫酸中
60 60
B.碳纳米管可用于生产电池和传感器 D.常温下1mol Cu投入含4mol HNO 3 的浓硝酸中
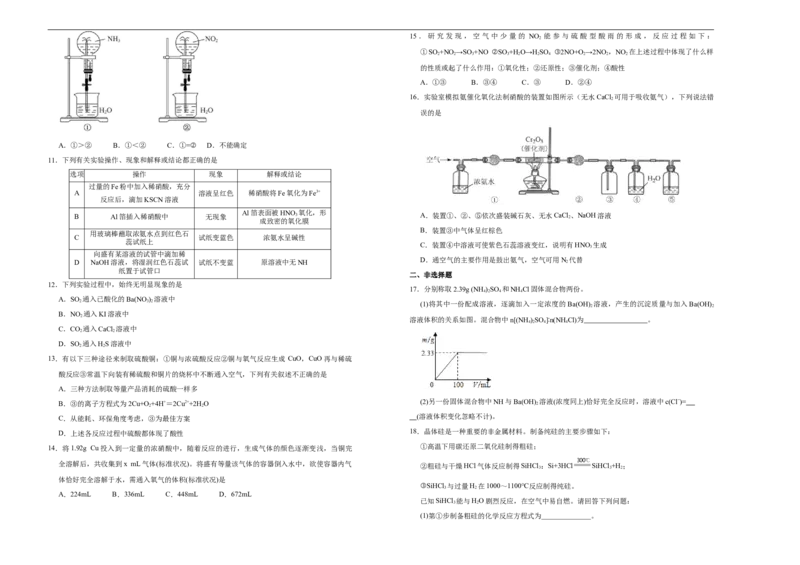
C.石墨烯与石墨都具有导电性 10.如图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH 3 、②NO 2 ,进行喷泉实验。
D.石墨烯的性质稳定,在氧气中不能燃烧 经充分反应后,瓶内溶质的物质的量浓度为
封密不订装只卷此
号位座
号场考
号证考准
名姓
级班15.研究发现,空气中少量的 NO 能参与硫酸型酸雨的形成,反应 过程如下:
2
①SO +NO→SO +NO ②SO +H O→H SO ③2NO+O →2NO ,NO 在上述过程中体现了什么样
2 2 3 3 2 2 4 2 2 2
的性质或起了什么作用:①氧化性;②还原性;③催化剂;④酸性
A.①③ B.③④ C.③ D.②④
16.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl 可用于吸收氨气),下列说法错
2
误的是
A.①>② B.①<② C.①=② D.不能确定
11.下列有关实验操作、现象和解释或结论都正确的是
选项 操作 现象 解释或结论
过量的Fe粉中加入稀硝酸,充分
A 溶液呈红色 稀硝酸将Fe氧化为Fe3+
反应后,滴加KSCN溶液
Al箔表面被HNO 氧化,形
B Al箔插入稀硝酸中 无现象 3 A.装置①、②、⑤依次盛装碱石灰、无水CaCl 2 、NaOH溶液
成致密的氧化膜
B.装置③中气体呈红棕色
用玻璃棒蘸取浓氨水点到红色石
C 试纸变蓝色 浓氨水呈碱性
蕊试纸上
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO 生成
3
向盛有某溶液的试管中滴加稀
D.通空气的主要作用是鼓出氨气,空气可用N 代替
D NaOH溶液,将湿润红色石蕊试 试纸不变蓝 原溶液中无NH 2
纸置于试管口
二、非选择题
12.下列实验过程中,始终无明显现象的是
17.分别称取2.39g (NH )SO 和NH Cl固体混合物两份。
4 2 4 4
A.SO 通入已酸化的Ba(NO ) 溶液中
2 3 2 (1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH) 溶液,产生的沉淀质量与加入Ba(OH)
2 2
B.NO 通入KI溶液中
2
溶液体积的关系如图。混合物中n[(NH )SO ]∶n(NHCl)为 。
4 2 4 4
C.CO 通入CaCl 溶液中
2 2
D.SO 通入HS溶液中
2 2
13.有以下三种途径来制取硫酸铜:①铜与浓硫酸反应②铜与氧气反应生成 CuO,CuO再与稀硫
酸反应③常温下向装有稀硫酸和铜片的烧杯中不断通入空气,下列有关叙述不正确的是
A.三种方法制取等量产品消耗的硫酸一样多
B.③的离子方程式为2Cu+O 2 +4H+=2Cu2++2H 2 O (2)另一份固体混合物中NH与Ba(OH) 2 溶液(浓度同上)恰好完全反应时,溶液中c(Cl−)=
C.从能耗、环保角度考虑,③为最佳方案
(溶液体积变化忽略不计)。
D.上述各反应过程中硫酸都体现了酸性 18.晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
14.将1.92g Cu投入到一定量的浓硝酸中,随着反应的进行,生成气体的颜色逐渐变浅,当铜完 ①高温下用碳还原二氧化硅制得粗硅;
全溶解后,共收集到x mL气体(标准状况)。将盛有等量该气体的容器倒入水中,欲使容器内气
②粗硅与干燥HCl气体反应制得SiHCl :Si+3HCl SiHCl +H ;
3 3 2
体恰好完全溶解于水,需通入氧气的体积(标准状况)是
③SiHCl 与过量H 在1000~1100℃反应制得纯硅。
3 2
A.224mL B.336mL C.448mL D.672mL
已知SiHCl 能与HO剧烈反应,在空气中易自燃。请回答下列问题:
3 2
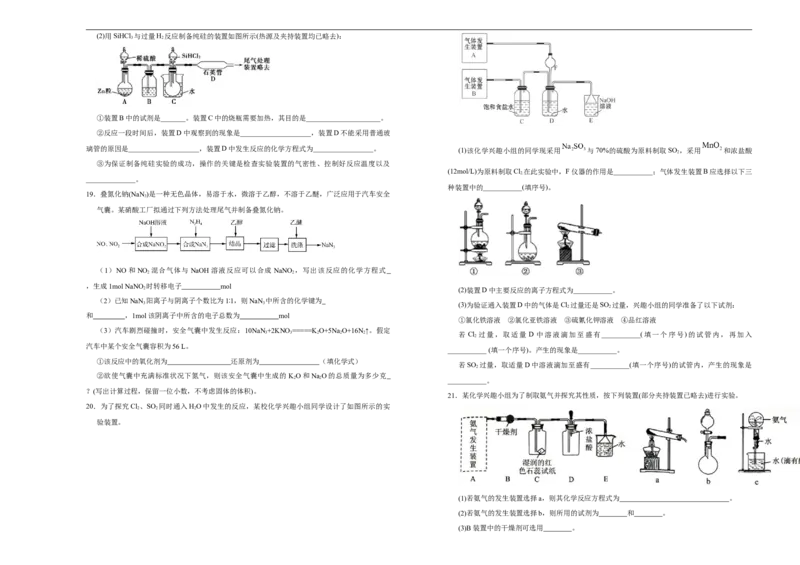
(1)第①步制备粗硅的化学反应方程式为______________。(2)用SiHCl 与过量H 反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
3 2
①装置B中的试剂是_______。装置C中的烧瓶需要加热,其目的是_____________________。
②反应一段时间后,装置D中观察到的现象是____________________,装置D不能采用普通玻
璃管的原因是____________________,装置D中发生反应的化学方程式为_________________。 (1)该化学兴趣小组的同学现采用 与70%的硫酸为原料制取SO ,采用 和浓盐酸
2
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及
(12mol/L)为原料制取Cl 在此实验中,F仪器的作用是___________;气体发生装置B应选择以下三
2.
______________。
种装置中的___________(填序号)。
19.叠氮化钠(NaN )是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全
3
气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。
(1)NO和NO 混合气体与 NaOH溶液反应可以合成 NaNO ,写出该反应的化学方程式
2 2
,生成1mol NaNO 时转移电子 mol
2 (2)装置D中主要反应的离子方程式为___________。
(2)已知NaN 阳离子与阴离子个数比为1∶1,则NaN 中所含的化学键为
3 3 (3)为验证通入装置D中的气体是Cl 过量还是SO 过量,兴趣小组的同学准备了以下试剂:
2 2
和 ,1mol该阴离子中所含的电子总数为 mol
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN +2KNO =====KO+5Na O+16N↑。假定
3 3 2 2 2 若 Cl 过量,取适量 D 中溶液滴加至盛有___________(填一个序号)的试管内,再加入
2
汽车中某个安全气囊容积为56 L。
___________ (填一个序号)。产生的现象是___________。
①该反应中的氧化剂为 还原剂为 (填化学式)
若SO 过量,取适量D中溶液滴加至盛有___________(填一个序号)的试管内,产生的现象是
2
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的 KO和NaO的总质量为多少克
2 2 ___________。
?(写出计算过程,保留一位小数,不考虑固体的体积)。
21.某化学兴趣小组为了制取氨气并探究其性质,按下列装置(部分夹持装置已略去)进行实验。
20.为了探究Cl 、SO 同时通入HO中发生的反应,某校化学兴趣小组同学设计了如图所示的实
2 2 2
验装置。
(1)若氨气的发生装置选择a,则其化学反应方程式为 。
(2)若氨气的发生装置选择b,则所用的试剂为 和 。
(3)B装置中的干燥剂可选用 。(4)实验中观察到C装置中的现象是 。
(5)当实验进行一段时间后,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象
是 。
(6)E中倒扣漏斗的作用是 。
(7)写出证明b装置的气密性良好的操作与现象 。
(8)用 c 装置做氨气喷泉实验时,如果没有胶头滴管,请写出引发喷泉的简单操作是
。物质之间的转化均能一步完成,故C正确;D.氨气催化氧化得到一氧化氮,不能一步生成二氧化
(新教材)2020-2021 学年下学期高一第一次月考卷
氮,故D错误。故选C。
化学答案(A) 7.【答案】C
【解析】SO 会将碘单质还原,所以蓝色褪色,A合理;B.SO 为酸性氧化物,可以和NaOH
2 2
1.【答案】B
溶液反应,且SO 有毒,所以可以用NaOH溶液吸收,防止污染空气,B合理;C.FeCl 含有
2 3
【解析】二氧化硫可以和某些有机色素结合生成不稳定的无色物质,硫磺燃烧生成二氧化硫,
Cl-,Cl-也能将高锰酸钾还原,且SO 会溶于水,溶解在FeCl 溶液中的SO 也会将高锰酸钾还原,
2 3 2
熏制银耳可以增白,故选B。
所以无法验证发生了氧化还原反应,C不合理;D.SO 可以将Fe3+还原,发生反应 SO +2Fe3+
2 2
2.【答案】D
+2H O=SO
2
【解析】A.氮气的化学性质很稳定,在通常情况下不燃烧,也不支持燃烧,不能供给呼吸,A
+2Fe2++4H+,反应过程中产生氢离子,所以酸性增强,D合理;综上所述答案为C。
项正确;B.液氨汽化吸热,可用于制造低温环境,B项正确;C.氮气的化学性质很稳定,可用
8.【答案】D
作焊接金属的保护气,C项正确;D.氮气与氢气生成氨气的反应中,N的化合价从0降低到-3,
【解析】能使品红溶液褪色的气体不一定为SO ,也可为氯气等,①错误;能使沾有酚酞和
2
作氧化剂,D项错误;答案选D。
NaOH溶液的滤纸褪色的气体有酸性或氧化性,可能是SO ,也可能为CO 、Cl 等,②错误;通入
2 2 2
3.【答案】A
HS饱和溶液中有浅黄色沉淀生成,该气体可能是SO ,也可能为Cl 等,③错误;通入足量的
2 2 2
【解析】A.硅是良好的半导体材料,手机芯片的主要成分是硅,A错误;B.氮化硅陶瓷具有
NaOH溶液中,再滴入BaCl 溶液,有白色沉淀生成,该沉淀能溶于盐酸,可能为SO 也可能为
2 2
耐高温、耐磨损、超硬物质,是新型无机非金属材料,B正确;C.小苏打是碳酸氢钠的俗称,受
CO ,④错误;通入溴水中,溴水褪色,再滴加 BaCl 溶液有白色沉淀产生,该沉淀难溶于稀硝酸,
2 2
热分解产生碳酸钠、水和二氧化碳气体,是面包发酵粉的主要成分之一,C正确;D.水玻璃是硅
则沉淀为BaSO ,说明该气体具有还原性,可被溴单质氧化,证明气体为SO ,⑤正确;综上所述,
4 2
酸钠溶液,硅酸钠耐高温、不可燃,可用作木材防火剂,D正确;答案选A。
只有⑤能证明二氧化硫的存在,D项符合题意。
4.【答案】D
9.【答案】D
【解析】A.碳的原子量为12,C 的式量为720,C 的摩尔质量为720g/mol,故A正确;B.
60 60 【解析】A 中随着反应的进行浓硫酸逐渐变为稀硫酸,稀硫酸不与铜反应,根据
碳纳米管是新型无机非金属材料,可做锂离子电池的负极材料,可用于生产电池和传感器,故B
Cu+2H SO (浓) ====CuSO +SO↑+2H O,Cu不能完全溶解;B中MnO 作催化剂;C中铝会钝化;
2 4 4 2 2 2
正确;C.石墨烯具有超导特性,石墨具有良好的导电性,因此石墨烯与石墨都具有导电性,故 C
D 中 随 着 反 应 的 进 行 浓 硝 酸 逐 渐 变 为 稀 硝 酸 , 但 稀 硝 酸 也 与 铜 反 应 , 依
正确;D.石墨烯是由碳元素组成的单质,它在氧气中可以燃烧,D项错误;故选D。
Cu+4HNO (浓)=Cu(NO)+2H O+2NO ↑、3Cu+8HNO (稀)=3Cu(NO)+4H O+2NO↑,Cu可以完全溶
3 3 2 2 2 3 3 2 2
5.【答案】C
解。
【解析】A.浓硫酸能按水的组成比脱去蔗糖中的氢、氧元素,使蔗糖出现发黑现象,证明浓
10.【答案】C
硫酸具有脱水性,A正确;B.浓硝酸在光照条件下分解生成二氧化氮、氧气和水,二氧化氮为红
【解析】(设“1”法)为方便计算,设烧瓶容积为1L,则氨水的物质的量浓度为:c(氨水)=
棕色气体,溶于硝酸使溶液呈黄色,B正确;C.铝和浓硝酸反应生成一层致密的氧化物薄膜,阻
止了进一步的反应,C错误;D.亚硫酸酸性弱于盐酸,故将SO 通入BaCl 溶液至饱和,未见沉
2 2
=1/22.4mol·L−1 NO 溶 于 水 并 与 水 发 生 反 应 : 3NO +H O=2HNO +NO ;
2 2 2 3
淀生成,继续通入另一种气体,有白色沉淀,则是钡盐沉淀,若通入 NH ,氨气、二氧化硫和水反
3
应生成铵根、亚硫酸根离子,亚硫酸根离子被钡离子沉淀为亚硫酸钡,D正确;答案为C。
n(HNO)=2/3n(NO),则HNO 溶液的体积为:
3 2 3
6.【答案】C
3NO ~NO ~ ΔV
2
【解析】A.硫与氧气反应只能生成二氧化硫,不能一步反应生成三氧化硫,故A错误;B.二
3L 1L 2L
氧化硅不能一步生成硅酸,可由可溶性的硅酸盐与酸反应生成硅酸,故 B错误;C.FeS 在高温条
2 1L V〔HNO(aq)〕
3
件下与氧气反应生成SO 2 ,SO 2 与氢氧化钠溶液反应生成Na 2 SO 3 ,Na 2 SO 3 被氧气氧化为Na 2 SO 4 ,各 V〔HNO 3 (aq)〕=2/3LNO 、NO;NO、NO HNO ,反应前后HNO 的物质的量不变,而化合价变化的只
2 2 3 3
HNO 溶液浓度为:c(HNO )= =1/22.4mol·L−1,则c(氨水)=c(HNO ),答案选
3 3 3
有铜和氧气,则 Cu 失去电子数目等于 O 得到电子的数目,所以消耗氧气的物质的量为
2
C。
11.【答案】C ,V(O )=0.015mol/22.4L·mol−1=0.336L=336mL,故B正确。
2
【解析】稀硝酸与Fe粉反应,首先生成Fe3+,过量的铁将Fe3+还原得到Fe2+,滴入KSCN溶液
15.【答案】A
不显红色,A项错;Al箔能与稀硝酸反应放出NO,B项错;检验溶液中的NH,应加入浓NaOH
【解析】在①SO +NO=SO+NO中,二氧化氮中氮元素的化合价降低,所以二氧化氮作氧化剂;
溶液,且需要加热,故无法确定是否含有NH,D项错。 2 2 3
将方程式①×2+②+③得方程式为:2SO +H O+O=SO+H SO ,可发现反应前后二氧化氮的量并未
12.【答案】C 2 2 2 3 2 4
发生变化,所以二氧化氮在整个反应过程中起催化剂的作用,据此答题。从反应①中,可看出二氧
【解析】A.SO 通入已酸化的Ba(NO ) 溶液中,当通入SO 较少量时,化学反应方程式为:
2 3 2 2
化氮中氮元素的化合价降低,所以二氧化氮作氧化剂;当将三个方程式按照①×2+②+③得方程式
3SO +3Ba(NO)+2H O=3BaSO↓+2NO↑+4HNO ,而当通入 SO 过量时,化学反应方程式为
2 3 2 2 4 3 2
为:2SO +H O+O=SO+H SO ,可发现反应前后二氧化氮的量并未发生变化,所以二氧化氮在整
3SO +Ba(NO)+2H O=BaSO↓+2NO↑+2HSO 。因此该实验的现象为产生无色气体,接触空气后立 2 2 2 3 2 4
2 3 2 2 4 2 4
个反应过程中起催化剂的作用。答案选A。
即变为红棕色且有白色沉淀生成,A项不可选;B.NO 通入KI溶液中发生的反应过程为:
2
16.【答案】D
3NO +H O=2HNO +NO、8HNO+6KI=6KNO +3I +4H O+2NO↑。因此该实验现象溶液变为黄色且
2 2 3 3 3 2 2
【解析】空气通入浓氨水后,氨气和氧气的混合气体经过干燥后进入装有催化剂的硬质玻璃管,
有无色气体产生,B项不可选;C.CO 通入CaCl 溶液中,除了其与水反应生成碳酸外,没有其他
2 2
反应发生,不会生成碳酸钙沉淀,所以没有明显现象,C项可选;D.SO 通入HS溶液中发生反
2 2
发生催化氧化,4NH +5O 4NO+6H O,生成的气体经过无水CaCl ,除去氨气和水蒸气,在
3 2 2 2
应的方程式为:SO +2H S=3S↓+2H O。因此该实验现象为溶液变浑浊;答案选C。
2 2 2
装置③中NO与空气中的氧气反应生成NO ,并收集,④中的水可以吸收排出的二氧化氮,尾气中
13.【答案】A 2
的NO在⑤中被吸收,防止污染,因此⑤中可以选用氢氧化钠溶液,据此分析解答。A.根据上述
【解析】A.铜与浓硫酸反应反应过程中,有近一半HSO 被还原成SO ,所以制取等量硫酸铜,
2 4 2
分析,装置①、②、⑤依次盛装碱石灰、无水CaCl 、NaOH溶液,故A正确;B.装置③NO被氧
三种方法消耗的硫酸不一样多,故A错误;B.常温下向装有稀硫酸和铜片的烧杯中不断通入空气, 2
化生成NO ,气体呈红棕色,故B正确;C.装置④中发生3NO +H O=2HNO +NO,溶液显酸性,
发生反应的化学方程式是2Cu+O+2HSO =2CuSO+2H O,故其离子方程式是2Cu+O+4H+=2Cu2+ 2 2 2 3
2 2 4 4 2 2
可使紫色石蕊溶液变红,故C正确;D.通空气的主要作用是鼓出氨气并提供氧气,空气不能用N
+2HO,故B正确;C.①耗能,有SO 生成不环保;②耗能,环保;③既不耗能,也环保。故③ 2
2 2
代替,故D错误;故选D。
为最佳方案,故C正确;D.在①的反应中,硫酸体现酸性和强氧化性,②③体现了硫酸的酸性,
17.【答案】(1)1∶2
故D正确;本题答案A。
(2)0.1mol/L
14.【答案】B
【解析】(1)产生的沉淀是硫酸钡,物质的量是 2.33g÷233g/mol=0.01mol,根据原子守恒可知硫
【解析】铜与浓硝酸反应生成硝酸铜、二氧化氮和水,随着反应的进行,浓硝酸变为稀硝酸,
酸铵的质量是 0.01mol×132g/mol=1.32g,则氯化铵的质量是 2.39g-1.32g=1.07g,物质的量是
铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应生成的二氧化氮、一氧化氮又被氧气氧化为硝酸,
1.07g÷53.5g/mol=0.02mol,因此混合物中n[(NH )SO ]∶n(NHCl)为1∶2;(2)每一份中硫酸铵和氯化
最 后 等 效 于 铜 失 电 的 数 目 等 于 氧 气 得 电 子 数 目 。 1.92g Cu 的 物 质 的 量 为 4 2 4 4
铵分别是0.01mol、0.02mol,另一份固体混合物中NH与Ba(OH) 溶液(浓度同上)恰好完全反应时,
2
消耗氢氧化钡是0.02mol,因此溶液体积是200mL,则溶液中c(Cl−)=0.02mol÷0.2L=0.1mol/L。
,反应时失去电子数目为2×0.03mol=0.06mol,反应整个过程为HNO
3
18.【答案】(1)SiO+2C=====Si+2CO↑
2
(2)浓硫酸 使滴入烧瓶中的SiHCl 汽化 有固体物质生成 在该反应温度下,普通
3
玻璃会软化 SiHCl +H ===========Si+3HCl 排尽装置中的空气
3 2【解析】(1)高温下用碳与二氧化硅发生置换反应:SiO+2C=====Si+2CO↑;(2)①通过锌 易溶于水,根据F仪器的构造可知其作用为防倒吸;实验室制取Cl 所用试剂为MnO 和浓盐酸,
2 2 2
与稀硫酸反应制备的氢气中混有水蒸气,但SiHCl 能与HO剧烈反应,在空气中易自燃,应在氢 固、液混合加热制取气体,故应选①装置,故答案为:防倒吸;①;(2)将Cl 和SO 同时通入水中
3 2 2 2
气参加反应前先干燥,所以B中的试剂是浓硫酸; C装置的目的是使SiHCl 和氢气充分混合,进 时 , Cl 将 SO 氧 化 生 成 HSO , Cl 被 还 原 生 成 HCl , 其 离 子 方 程 式 为 :
3 2 2 2 4 2
而进入D装置中反应,因此加热C的目的是使SiHCl 汽化;②D中SiHCl 和氢气反应生成固体硅,
3 3
;(3)若Cl 过量,则装置D中的溶液中除含有HSO 、HCl外,
2 2 4
反应方程式为:SiHCl +H ===========Si+3HCl,因为反应加热到1000~1100℃,所以必须用石
3 2
英管。③由于在高温下硅和氧气可以化合生成二氧化硅,所以必须排尽装置中的空气。
还含有Cl 及HClO,具有强氧化性,可将 氧化为 ,使硫氰化钾溶液变红,故可选择②和
19.【答案】(1)NO+NO+2NaOH=NaNO +H O 1 2
2 2 2
(2)离子键 共价键 22 ③进行检验,现象是溶液变红色;若SO 过量,则装置D中的溶液中会含有SO 、HSO ,SO 具有
2 2 2 3 2
(3)KNO NaN 63.1g
3 3 还原性,故可选用①进行检验,因Cl 过量时也会使品红溶液褪色,故不能用品红溶液来检验,不
2
【解析】一氧化氮和二氧化氮的混合气和氢氧化钠首先合成亚硝酸钠,亚硝酸钠溶液中通入肼,
可以合成叠氮化钠,叠氮化钠微溶于乙醇,所以向叠氮化钠溶液中加入乙醇可以使叠氮化钠溶解度 选④,选①氯化铁溶液,过量的SO 2 会与 发生氧化还原反应,使 转化为 ,现象是溶
降低而结晶析出。由于叠氮化钠不溶于乙醚,过滤之后用乙醚洗涤,最后得到叠氮化钠的固体。
液由棕黄色变为浅绿色,故答案为:②;③;溶液呈红色;①;溶液由棕黄色变为浅绿色。
(1)NO和NO 混合气体与NaOH溶液反应可以合成NaNO ,此反应是一个氧化还原反应,一氧
2 2 21.【答案】(1)2NH Cl+Ca(OH) ====2NH ↑+CaCl +2H O
4 2 3 2 2
化氮中+2价的氮化合价升高到亚硝酸钠中的+3价,二氧化氮+4价氮也降低到亚硝酸钠中的+3价。
(2)生石灰 浓氨水
所以反应的化学方程式为:NO+NO
2
+2NaOH=NaNO
2
+H
2
O。生成1mol NaNO
2
转移1mol电子。故 (3)碱石灰
答案为:NO+NO +2NaOH=NaNO +H O,1;(2)叠氮化钠中阳离子是钠离子,阳离子与阴离子 (4)试纸变蓝
2 2 2
个数比为1∶1,所以阴离子是N,三个氮原子通过共价键形成阴离子。所以在叠氮化钠中含有的化 (5)产生白烟
学键既有离子键,又有共价键。在1N个中,电子数为3×7+1=22。故答案为:离子键,共价键; (6)防止倒吸
(7)用止水夹夹住b中橡胶管,向分液漏斗里加足量水,再打开分液漏斗活塞,过一会水不再
22;(3)在10NaN +2KNO =====KO+5Na O+16N↑中,叠氮化钠中氮的化合价由负价升高到零
3 3 2 2 2
滴下,则证明气密性良好
价,故叠氮化钠是还原剂,硝酸钾中+5价的氮降低到0价,故硝酸钾是氧化剂。欲使安全气囊中
(8)打开止水夹,用热毛巾焐热圆底烧瓶,NH 受热膨胀,赶出玻璃导管中的空气,玻璃导管
充满标准状况下氮气56L,根据反应的方程式:10NaN +2KNO =====KO+5Na O+16N↑,可求出 3
3 3 2 2 2
口有气泡冒出,NH 与HO接触,移走热毛巾
KO和NaO的总质量。即10NaN +2KNO =====KO+5Na O + 16N↑ 3 2
2 2 3 3 2 2 2
【解析】(1)装置a适用于固体(或固体混合物)加热制气体。选择装置 a制NH ,使用
94g+5×62g 16×22.4L 3
Ca(OH) 和 NH Cl 的 混 合 物 共 热 制 NH , 反 应 的 化 学 方 程 式 为
m 56L 2 4 3
总
可求得m 总 =63.1g。故答案为:KNO 3 ,NaN 3 。 Ca(OH) 2 +2NH 4 Cl====CaCl 2 +2NH 3 ↑+2H 2 O。(2)装置b适用于固体与液体常温下制气体。选择装
20.【答案】(1)防倒吸 ① 置b制NH ,所用试剂为生石灰和浓氨水,反应的化学方程式为CaO+NH·H O=Ca(OH) +NH↑。
3 3 2 2 3
(3)干燥NH 选用碱石灰作干燥剂。(4)NH 的水溶液呈碱性,使红色石蕊试纸变蓝;C装置中
(2) 3 3
的现象是:湿润的红色石蕊试纸变蓝。(5)浓盐酸具有挥发性,NH 与HCl化合成白色固体
3
(3)② ③ 溶液呈红色 ① 溶液由棕黄色变为浅绿色
NH Cl,挤压D装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是:产生大量白烟,反应
4
【解析】根据实验装置图可看出,气体发生装置B是为了制备氯气,经过盛有饱和食盐水的装
的化学方程式为NH +HCl=NH Cl。(6)NH 极易溶于水,为防止产生倒吸使用倒扣的漏斗;E中
3 4 3
置除去氯气中的HCl后进入装置D,气体发生装置A是为了制备二氧化硫,二氧化硫能溶于水,
倒扣漏斗的作用是:防止倒吸。(7)检查装置b的气密性可用液差法。实验的操作与现象:用止
使用装置F可有效防倒吸,D中两种气体与水发生氧化还原反应生成 HCl和HSO ,最后多余的氯
2 4
水夹夹住b中橡胶管,向分液漏斗里加足量水,再打开分液漏斗活塞,过一会水不再滴下,则证明
气或二氧化硫被氢氧化钠溶液吸收,装置E是尾气处理装置。(1)装置A为制取SO 的装置,因SO
2 2气密性良好。(8)形成喷泉实验要产生较大的压强差,c装置中若没有胶头滴管,引发喷泉的简
单操作是:打开止水夹,用热毛巾焐热圆底烧瓶,NH 受热膨胀,赶出玻璃导管中的空气,玻璃导
3
管口有气泡冒出,NH 与HO接触,移走热毛巾。
3 2