文档内容
第六章第一节化学反应与能量变化小题训练--人教版
(2019)必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.甲醛(HCHO)与 在羟基磷灰石(HAP)表面发生反应的能量—历程关系如图。下列
说法错误的是
A.该反应为放热反应
B.反应过程中,甲醛的键断裂
C. 中的氧原子全部来自
D.化学方程式为
2.下列装置能够组成原电池的是
A. B.
C. D.
3.如图是以稀硫酸为电解质溶液的原电池装置,下列叙述正确的是A.锌片质量增加
B.锌片为负极,铜片发生氧化反应
C.电解质溶液中的H+向铜极移动
D.电子流动方向为:锌极→导线→铜极→电解质溶液→锌极
4.已知稳定性:反—2—丁烯>顺—2—丁烯>1—丁烯。下列说法正确的是
A.相同条件下,1mol的1,3—丁二烯和1mol氢气总能量比1mol的1—丁烯能量低
B.其他条件不变,选择合适的催化剂可以降低活化能和焓变,其中 变化最大
C.相同条件下,1mol的1,3—丁二烯和1mol氢气反应达到平衡时产物中反—2—丁
烯最少
D.顺—2—丁烯转化为反—2—丁烯是放热反应
5.化学学科在资源、材料、健康等领域发挥越来越重要的作用,下列应用中错误的是
A.高效化学电源应用于新能源汽车
B.高铁酸钠 用于饮用水处理
C.过氧化钠作为供氧剂用于呼吸面具或潜水艇中
D.碳酸钠用于治疗胃酸过多的药物
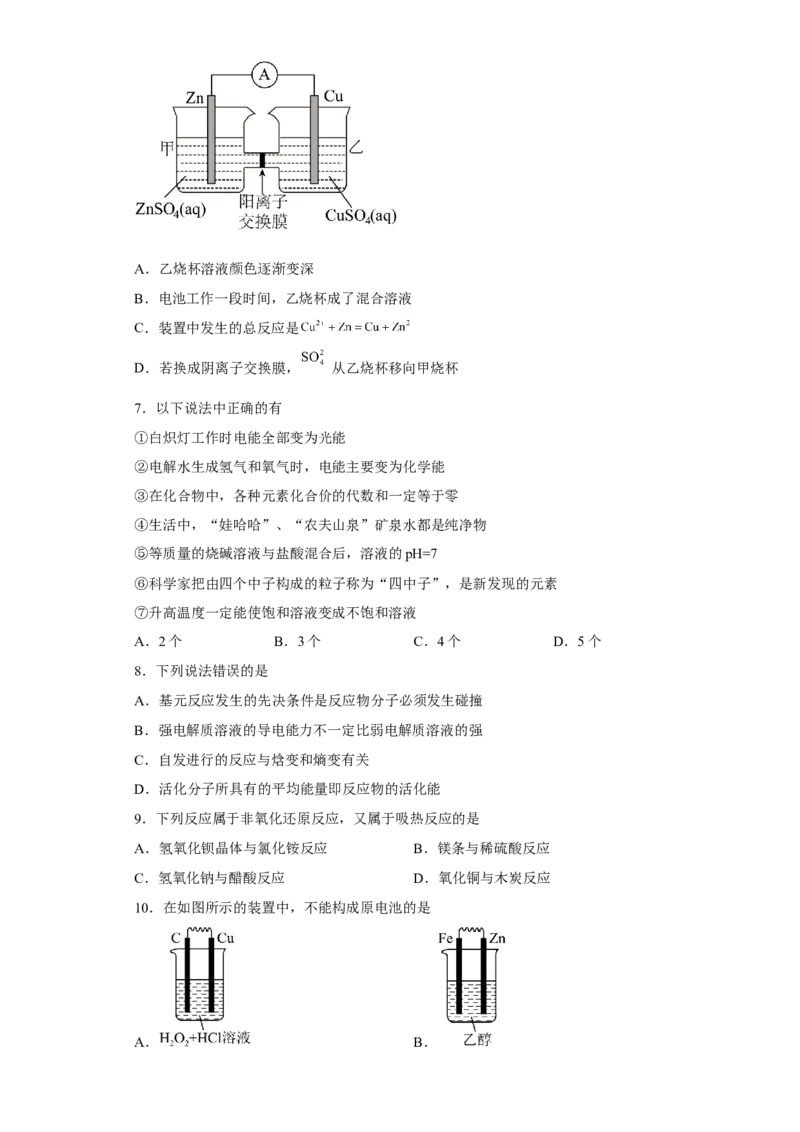
6.下列关于如图所示电池的说法中不正确的是
试卷第2页,共3页A.乙烧杯溶液颜色逐渐变深
B.电池工作一段时间,乙烧杯成了混合溶液
C.装置中发生的总反应是
D.若换成阴离子交换膜, 从乙烧杯移向甲烧杯
7.以下说法中正确的有
①白炽灯工作时电能全部变为光能
②电解水生成氢气和氧气时,电能主要变为化学能
③在化合物中,各种元素化合价的代数和一定等于零
④生活中,“娃哈哈”、“农夫山泉”矿泉水都是纯净物
⑤等质量的烧碱溶液与盐酸混合后,溶液的pH=7
⑥科学家把由四个中子构成的粒子称为“四中子”,是新发现的元素
⑦升高温度一定能使饱和溶液变成不饱和溶液
A.2个 B.3个 C.4个 D.5个
8.下列说法错误的是
A.基元反应发生的先决条件是反应物分子必须发生碰撞
B.强电解质溶液的导电能力不一定比弱电解质溶液的强
C.自发进行的反应与焓变和熵变有关
D.活化分子所具有的平均能量即反应物的活化能
9.下列反应属于非氧化还原反应,又属于吸热反应的是
A.氢氧化钡晶体与氯化铵反应 B.镁条与稀硫酸反应
C.氢氧化钠与醋酸反应 D.氧化铜与木炭反应
10.在如图所示的装置中,不能构成原电池的是
A. B.C. D.
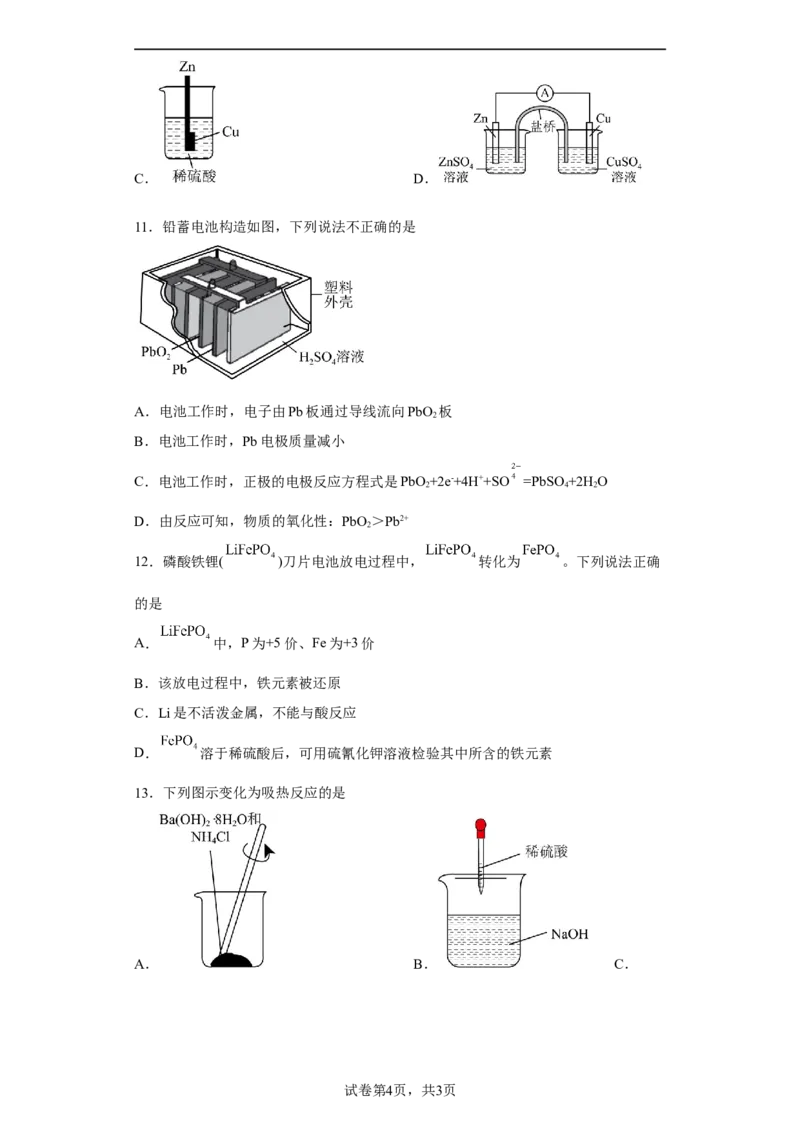
11.铅蓄电池构造如图,下列说法不正确的是
A.电池工作时,电子由Pb板通过导线流向PbO 板
2
B.电池工作时,Pb电极质量减小
C.电池工作时,正极的电极反应方程式是PbO +2e-+4H++SO =PbSO+2H O
2 4 2
D.由反应可知,物质的氧化性:PbO >Pb2+
2
12.磷酸铁锂( )刀片电池放电过程中, 转化为 。下列说法正确
的是
A. 中,P为+5价、Fe为+3价
B.该放电过程中,铁元素被还原
C.Li是不活泼金属,不能与酸反应
D. 溶于稀硫酸后,可用硫氰化钾溶液检验其中所含的铁元素
13.下列图示变化为吸热反应的是
A. B. C.
试卷第4页,共3页D.
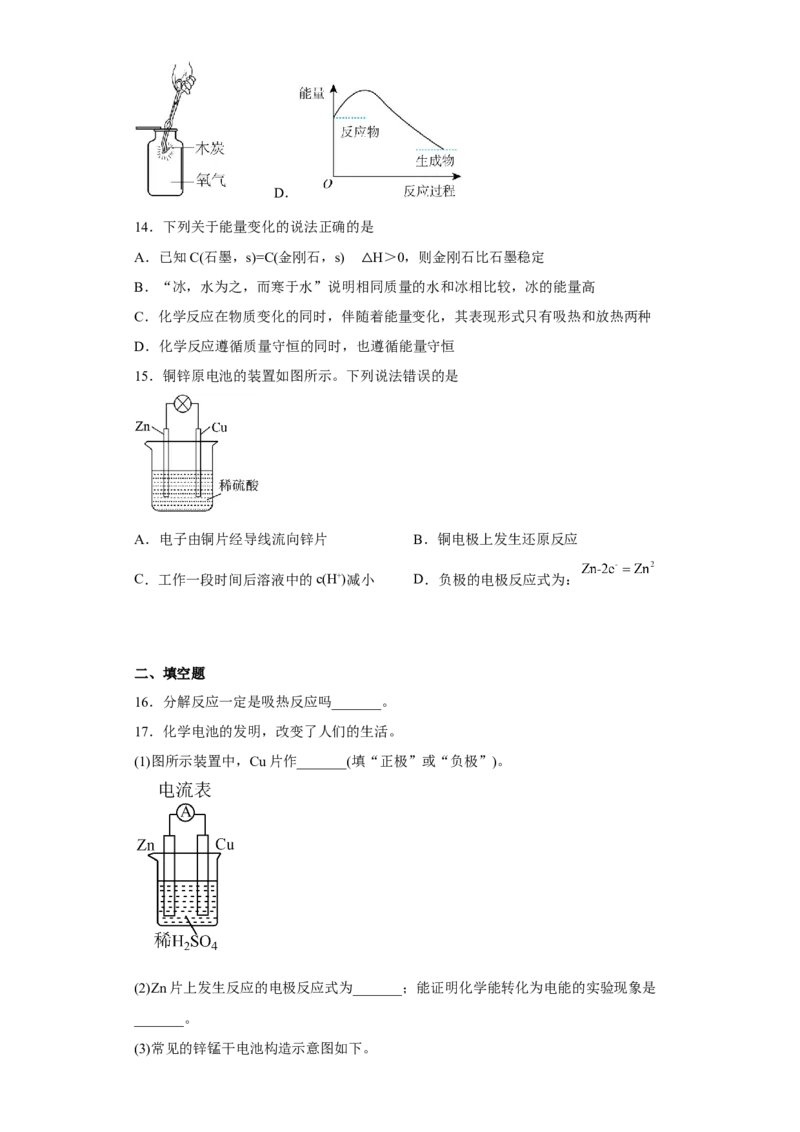
14.下列关于能量变化的说法正确的是
A.已知C(石墨,s)=C(金刚石,s) H>0,则金刚石比石墨稳定
B.“冰,水为之,而寒于水”说明相△同质量的水和冰相比较,冰的能量高
C.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
D.化学反应遵循质量守恒的同时,也遵循能量守恒
15.铜锌原电池的装置如图所示。下列说法错误的是
A.电子由铜片经导线流向锌片 B.铜电极上发生还原反应
C.工作一段时间后溶液中的c(H+)减小 D.负极的电极反应式为:
二、填空题
16.分解反应一定是吸热反应吗_______。
17.化学电池的发明,改变了人们的生活。
(1)图所示装置中,Cu片作_______(填“正极”或“负极”)。
(2)Zn片上发生反应的电极反应式为_______;能证明化学能转化为电能的实验现象是
_______。
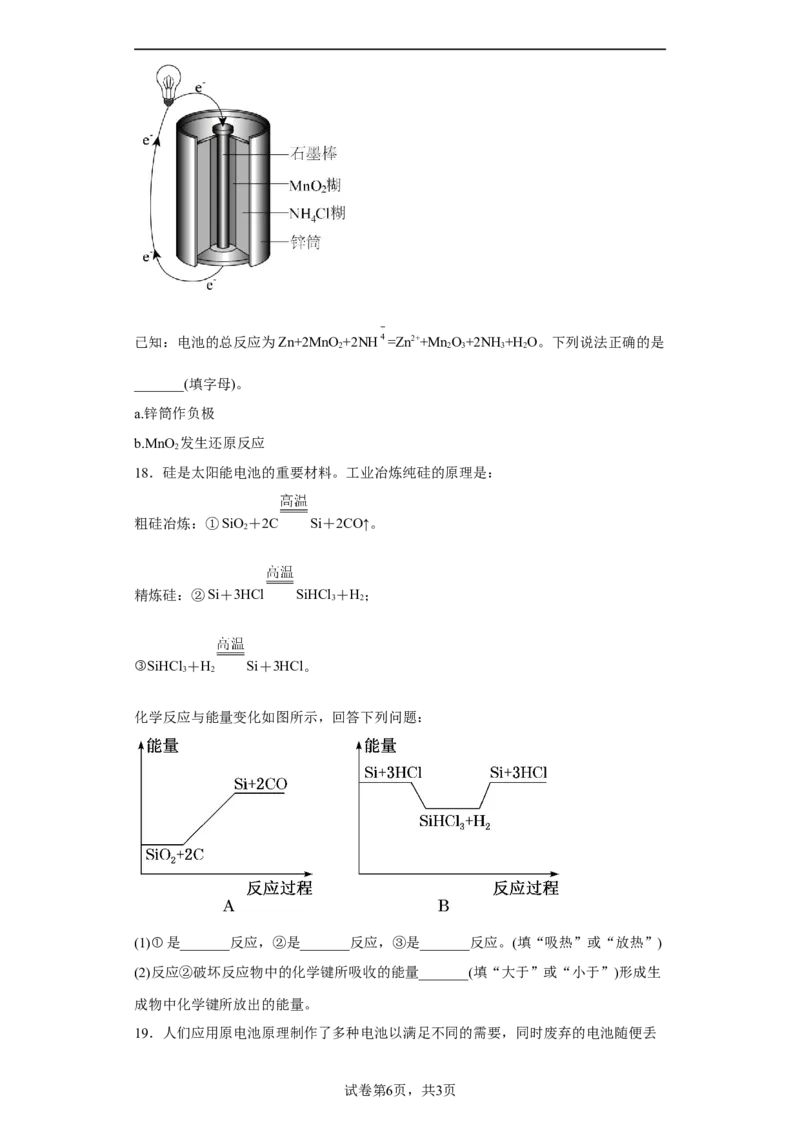
(3)常见的锌锰干电池构造示意图如下。已知:电池的总反应为Zn+2MnO +2NH =Zn2++Mn O+2NH+H O。下列说法正确的是
2 2 3 3 2
_______(填字母)。
a.锌筒作负极
b.MnO 发生还原反应
2
18.硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:①SiO+2C Si+2CO↑。
2
精炼硅:②Si+3HCl SiHCl +H;
3 2
③SiHCl +H Si+3HCl。
3 2
化学反应与能量变化如图所示,回答下列问题:
(1)①是_______反应,②是_______反应,③是_______反应。(填“吸热”或“放热”)
(2)反应②破坏反应物中的化学键所吸收的能量_______(填“大于”或“小于”)形成生
成物中化学键所放出的能量。
19.人们应用原电池原理制作了多种电池以满足不同的需要,同时废弃的电池随便丢
试卷第6页,共3页弃也会对环境造成污染。请回答下列问题:
(1)电子表和电子计算器中所用的是纽扣式微型银锌电池,其电极分别为Ag O和Zn,
2
电解质为KOH溶液,工作时电池总反应为Ag O+Zn+HO=2Ag+Zn(OH) 。
2 2 2
①工作时电流从_______极流向_______极(填“Ag O”或“Zn”)。
2
②电极反应式:正极:_______,负极:_______。
③工作时电池正极区的pH_______(填“增大”“减小”或“不变”)。
(2)氢镍电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。
氢镍电池的总反应式为 H+NiO(OH) Ni(OH) 。电池放电时,负极反应式为
2 2
_______,正极反应式为_______,正极附近溶液的pH_______(填“增大”“减小”或
“不变”)。
20.利用反应Zn+CuSO =Cu+ZnSO,设计一个原电池。
4 4
(1)选用_______为负极材料,_______为正极材料,电解质溶液为_______。
(2)写出电极反应式:负极_______,正极_______。
(3)试画出上述装置图_______。参考答案:
1.C
【详解】A.根据图示,反应物总能量大于生成物总能量,该反应为放热反应,故A正确;
B.根据图示,甲醛和氧气反应生成二氧化碳和水,反应过程中,甲醛的 键断裂,故
B正确;
C.根据图示, 中有1个氧原子来自 ,故C错误;
D.甲醛和氧气在羟基磷灰石( )表面反应生成二氧化碳和水,化学方程式为
,故D正确;
选C。
2.D
【分析】构成原电池的条件是:①有两个活泼性不同的电极;②将电极插入电解质溶液中;
③两电极间构成闭合回路;④能自发的发生氧化还原反应;
【详解】A.酒精不导电,没有构成闭合电路,不能构成原电池,故A不选;
B.两个电极相同,不能构成原电池,故B不选;
C.不是自发氧化还原反应,不能构成原电池,故C不选;
D.存在两个活泼性不同的电极(锌、铜),存在电解质溶液(硫酸铜溶液);构成了闭合回路;
能自发的进行氧化还原反应(锌与铜离子发生置换反应),满足构成原电池的条件,故D选;
故选D。
3.C
【分析】锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极方程式为
Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-=H ↑,据此分析作答。
2
【详解】A.根据上述分析可知,锌电极为负极,发生电极反应Zn-2e-=Zn2+,电极质量减
少,故A错误;
B.锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,故
B错误;
C.铜极为正极,电解质溶液中的H+向(正极)铜极移动,故C正确;
D.电子由负极经外电路流向正极,电子不能进入电解质溶液中,故D错误;
故选:C。
4.D【详解】A.1,3-丁二烯与氢气加成生成1-丁烯,属于放热反应,A项错误;
B.催化剂改变活化能,但是不改变反应的焓变, B项错误;
C.稳定性越大,物质能量越低,所以稳定性最差的1-丁烯能量最高,产量最少,C项错误;
D.能量上顺-2-丁烯大于反-2-丁烯,所以为放热反应,D项正确;
答案选D。
5.D
【详解】A.高效化学电源应用于新能源汽车,A正确;
B.高铁酸钠 中的铁为+6价,具有强氧化性,常用于杀菌消毒,其还原产物是
三价铁,三价铁可发生水解,生成氢氧化铁胶体,有类似于明矾的净水作用,所以用于饮
用水处理,B正确;
C.过氧化钠能和水、二氧化碳反应生成氧气,所以可作为供氧剂用于呼吸面具或潜水艇
中,C正确;
D.碳酸钠碱性较强会伤及人体,应该用碳酸氢钠作为治疗胃酸过多的药物,D错误;
故选D。
6.A
【分析】Zn的金属性比Cu活泼,Zn为负极,Cu为正极,据此分析。
【详解】A.Zn的金属性比Cu活泼,Zn为负极,Cu为正极,Cu电极反应式为
,乙烧杯溶液颜色逐渐变浅,故A说法不正确;
B.为平衡电荷,甲烧杯中的阳离子,即 向乙烧杯移动,故乙烧杯成了混合溶液,故
B说法正确;
C.根据B选项分析,装置中发生的总反应是 ,故C说法正确;
D.乙烧杯 放电, 从乙烧杯移向甲烧杯,故D说法正确。
故选A。
7.A
【详解】①白炽灯工作时,电能转化为光能和热能,故错误;
②电解水时,电能主要变为化学能,故正确;
③化合物中各元素的代数和为0,故正确;
④生活中,“娃哈哈”、“农夫山泉”矿泉水等物质都是由多种物质组成的物质,都是混
合物,故错误;
答案第2页,共2页⑤氢氧化钠和盐酸反应的化学方程式为:NaOH+HCl=NaCl+H O,氯化氢和氢氧化钠完全
2
反应的质量比是36.5:40,但题目中未说明两种溶液中溶质的质量分数,故不知氯化氢和
氢氧化钠的质量,无法判断谁过量,故错误;
⑥科学家把由四个中子构成的粒子称为“四中子”,不是新发现的元素,故错误;
⑦升高温度不一定能使饱和溶液变成不饱和溶液,例如氢氧化钙的溶解度随着温度的升高
而减小,升高温度时,饱和氢氧化钙溶液仍然是饱和溶液,故错误;
综上,只有②③正确,故A正确;
故选A。
8.C
【详解】A.基元反应发生的先决条件是反应物分子必须发生,但并不是反应物分子的每
一次碰撞都能发生化学反应,故A错误;
B.导电能力取决于带电离子浓度及所带电荷量,与强弱电解质无直接关系,故B错误;
C.一个化学反应能否自发进行,既与反应的焓变有关,又与反应的熵变有关,故C正确;
D.活化分子的平均能量与反应物分子平均能量的差值即为活化能,故D错误;
故选C。
9.A
【详解】A.氢氧化钡晶体与氯化铵反应放出氨气为吸热反应,没有元素的化合价变化,
为非氧化还原反应,故A选;
B.镁条与稀硫酸反应为放热反应,故B不选;
C.氢氧化钠与醋酸反应是放热反应,故C不选;
D.氧化铜与木炭反应是吸热反应,且Cu和C元素化合价发生变化,属于氧化还原反应,
故D不选;
故选A。
10.B
【详解】A.C和 形成两极, 和 的混合溶液作电解质,可以形成原电池,A错
误;
B.乙醇不是电解质,不能构成原电池,B正确;
C. 和 作两极,稀硫酸作电解质溶液,可以形成原电池,C错误;
D. 和 作两极,有电解质溶液,有盐桥,可以形成原电池,D错误;
故选B。11.B
【详解】A.电池工作时,Pb是负极、PbO 是正极,电子由Pb板通过导线流向PbO 板,
2 2
故A正确;
B.电池工作时,Pb是负极,负极反应式为Pb-2e-+SO =PbSO,Pb电极质量增大,故B
4
错误;
C.电池工作时,正极PbO 得电子生成硫酸铅,电极反应方程式是PbO +2e-+4H++SO
2 2
=PbSO+2H O,故C正确;
4 2
D.总反应为Pb+PbO+4H++2SO =2PbSO+2H O,PbO 是氧化剂、PbSO 既是氧化产物又
2 4 2 2 4
是还原产物,物质的氧化性:PbO >Pb2+,故D正确;
2
选B。
12.D
【详解】A. 中,Li为+1价、P为+5价、O为-2价,依据化合价代数和为0可知
Fe为+2价,A错误;
B.该放电过程中铁元素化合价从+2价升高到+3价,失去电子,铁元素被氧化,B错误;
C.Li是活泼金属,能与酸反应,C错误;
D. 溶于稀硫酸后,溶液中含有铁离子,所以可用硫氰化钾溶液检验其中所含的铁
元素,D正确;
答案选D。
13.A
【详解】A.氢氧化钡晶体和氯化铵的反应属于吸热反应,A符合;
B.稀硫酸和氢氧化钠反应属于放热反应,B不符合;
C.木炭燃烧属于放热反应,C不符合;
D.反应物总能量高于生成物总能量,属于放热反应,D不符合;
答案选A。
14.D
【详解】A.已知C(石墨,s)=C(金刚石,s) H>0为吸热反应,故石墨的能量更低,则
金刚石没有石墨稳定,A错误; △
B.“冰,水为之,而寒于水”说明相同质量的水和冰相比较冰的温度更低,冰转化为水
答案第4页,共2页需要吸收能量,冰的能量低,B错误;
C.化学反应在物质变化的同时,伴随着能量变化,其表现形式不只有吸热和放热两种,
还有光、波、电等等形式,C错误;
D.化学反应遵循质量守恒的同时,也遵循能量守恒,D正确;
答案选D。
15.A
【分析】铜锌原电池,锌为负极,铜为正极,电子由锌片经导线流向铜片,负极发生氧化
反应,正极发生还原反应,据此分析。
【详解】A.原电池中电子由负极流向正极,铜锌原电池,锌为负极,铜为正极,电子由
锌片经导线流向铜片,A错误;
B.铜作正极,正极发生还原反应,B正确;
C.根据电池的总反应:Zn+2H+= Zn2++H ,氢离子在反应过程中被消耗,工作一段时间
2
后溶液中的c(H+)减小,C正确;
D.负极发生氧化反应,电极反应式为: ,D正确;
故本题选A。
16.不一定。如 分解生成 、 等,属于放热反应
【详解】分解反应不一定是吸热反应,例如 分解生成 、 和HO,属于放热反
2
应,故错误。
17.(1)正极
(2) Zn–2e-=Zn2+ 电流表指针偏转
(3)ab
【详解】(1)图所示装置为原电池,电解质是稀硫酸,由于Zn比Cu活泼,故Zn片为负
极,Cu片为正极;
(2)Zn片为负极,Zn失去2个电子生成Zn2+,发生反应的电极反应式为Zn–2e-=Zn2+;电
流表指针偏转能证明化学能转化为电能;
(3)a.由电池的总反应可知Zn失去电子生成Zn2+,所以锌筒作负极,a正确;
b.MnO 中Mn的化合价由+4价降低到+3价,做氧化剂,发生还原反应,b正确;
2故答案为:ab。
18.(1) 吸热 放热 吸热
(2)小于
【详解】(1)由图A可知反应①中反应物的总能量低于生成物的总能量,所以该反应为
吸热反应,由图B可知反应②中反应物总能量高于生成物总能量,所以该反应为放热反应;
反应③中反应物总能量低于生成物总能量,所以该反应为吸热反应;
(2)因为反应②是放热反应,所以破坏反应物中的化学键所吸收的能量小于形成生成物中
化学键所放出的能量。
19.(1) Ag O Zn Ag O+2e-+HO=2Ag+2OH- Zn-2e-+2OH-=Zn(OH) 增大
2 2 2 2
(2) H-e-+OH-=H O NiO(OH)+e-+HO=Ni(OH) +OH- 增大
2 2 2 2
【详解】(1)该电池中Zn失电子为负极,正极为Ag O,故电流从Ag O极流向Zn极;正
2 2
极的电极反应式为Ag O+2e-+HO=2Ag+2OH-,负极的电极反应式为Zn-2e-+2OH-
2 2
=Zn(OH) ;工作时电池正极区生成OH-,故正极区的pH增大;
2
(2)氢镍电池放电时,负极的电极反应式为 H-e-+OH-=H O,正极的电极反应式为
2 2
NiO(OH)+e-+HO=Ni(OH) +OH-,正极区生成OH-,故正极附近溶液的pH增大。
2 2
20.(1) 锌片 铜片(或碳棒) CuSO 溶液
4
(2) Zn-2e-=Zn2+ Cu2++2e-=Cu
(3)
【详解】(1)根据反应Zn+CuSO =Cu+ZnSO 可知Zn是还原剂,CuSO 是氧化剂,故用
4 4 4
锌片作负极,正极选用金属性弱于锌的金属或能导电的非金属,因此可以是铜片或碳棒为
正极材料,电解质溶液为CuSO 溶液;
4
(2)Zn在负极发生氧化反应生成Zn2+,即Zn-2e-=Zn2+,Cu2+在正极被还原得到Cu,即
答案第6页,共2页Cu2++2e-=Cu;
(3)根据反应Zn+CuSO =Cu+ZnSO 可知Zn是还原剂,CuSO 是氧化剂,故用锌片作负
4 4 4
极,铜片或碳棒作正极,电解质溶液为CuSO 溶液,画出上述装置图为:
4
。答案第8页,共2页