文档内容
第四章�第节 原子结构与元素周期表课时作业 2022-2023学
年高中化学人教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.对于以下六种核素: 、 、 、 、 、 ,下列说法正确的是
A. 和 的中子数相等
B. 和 的中子数不相等
C. 和 在元素周期表中所处的位置不同
D. 和 质量数相等,二者互为同位素
2.Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,
并在水中电离出电子层结构相同的离子,该化合物是( )
A.KCl B.NaS C.NaO D.KS
2 2 2
3.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。下列关于质量
数293的Lv原子的叙述错误的是
A.中子数为177 B.该原子可表示为
C.核外电子数116 D.鉝元素的相对原子质量293
4.据报道,法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为
“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的
是
A.该粒子不显电性 B.该粒子质量比氢原子大
C.该粒子质量数为4 D.在周期表中与氢元素占同一位置
5.下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝
的还原性比钠强
C.镁、铝在空气中都能形成致密氧化膜
D.金属元素的单质在常温下都为固体
6.下列说法正确的是A.O、O 是氧元素的同素异形体,两者都为非极性分子
2 3
B.35Cl与37Cl−互为同位素
C.乙二醇( ) 和甘油( )互为同系物
D.CHCHO 与 互为同分异构体
3
7.以下关于元素周期表结构的叙述正确的是
A.元素周期表有7个主族,8个副族
B.元素周期表有3个长周期、3个短周期和1个不完全周期
C.第ⅢA族位于元素周期表的第三列(从左往右)
D.0族位于元素周期表的第18列(从左往右)
8.少量 与 反应生成 和 。下列说法正确的是
A. 的俗名为纯碱 B.中子数为10的氧原子可表示为
C. 中氧元素的化合价为 D. 与 具有相同的电子层结构
9.化学与生产、生活密切相关,下列说法正确的是( )
A.明矾净水时发生了物理及化学变化,明矾能起到杀菌消毒的作用
B.可用淀粉溶液检验加碘食盐中所含的碘酸钾
C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
D.石油的分馏和煤的干馏均属于物理变化
10.下列各组物质的分类正确的是
①碱性氧化物:NaO、Fe O 、FeO
2 3 4
②同素异形体:C 、金刚石、石墨
60
③酸性氧化物:CO、CO、Al O
2 2 3
④混合物:漂白粉、液氯、硬铝
⑤电解质:硫酸、氢氧化钠、偏铝酸钠
⑥干冰、液氯、乙醇都是非电解质
A.②⑤ B.②⑤⑥ C.②④⑤⑥ D.①②③④⑤⑥
11.下列说法正确的是
A.单质硫有S、S、S 等,它们都是硫的同素异形体
2 4 6
B.O 和O 分子式不同,结构相同
2 3
C.石墨导电、金刚石不导电,故二者不是同素异形体
D.红磷转化为白磷,属于物理变化
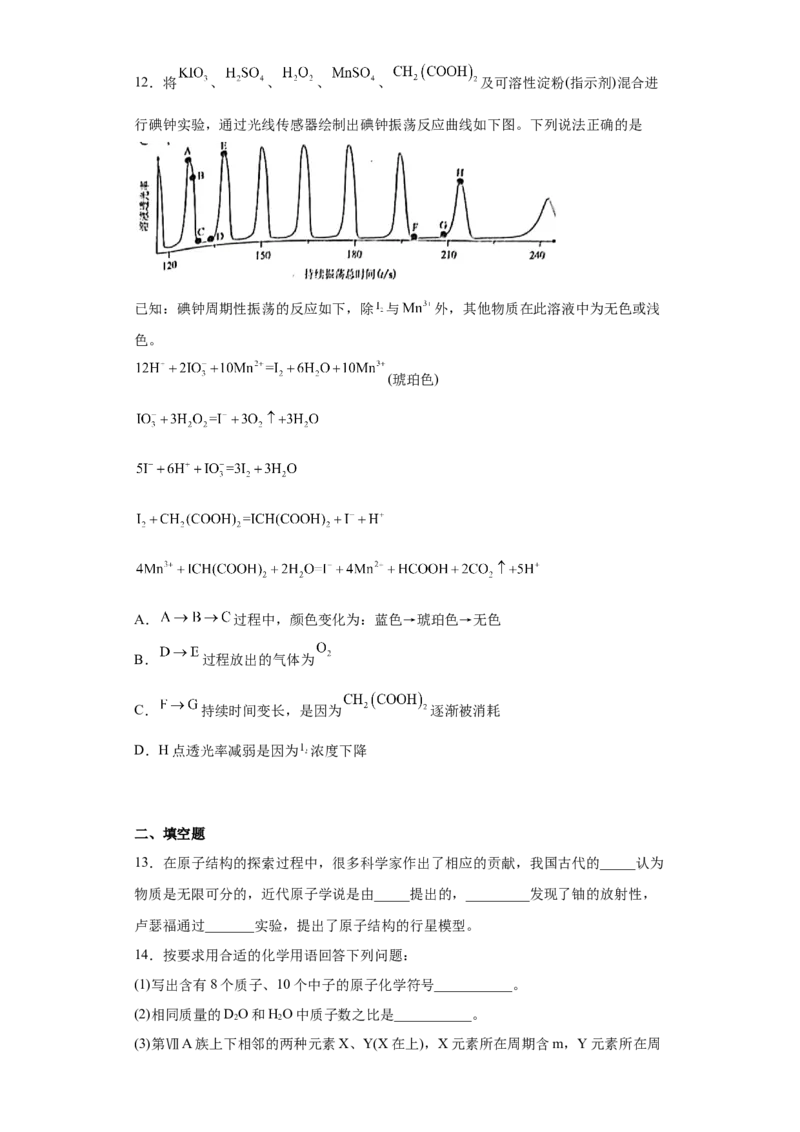
试卷第2页,共3页12.将 、 、 、 、 及可溶性淀粉(指示剂)混合进
行碘钟实验,通过光线传感器绘制出碘钟振荡反应曲线如下图。下列说法正确的是
已知:碘钟周期性振荡的反应如下,除 与 外,其他物质在此溶液中为无色或浅
色。
(琥珀色)
A. 过程中,颜色变化为:蓝色→琥珀色→无色
B. 过程放出的气体为
C. 持续时间变长,是因为 逐渐被消耗
D.H点透光率减弱是因为 浓度下降
二、填空题
13.在原子结构的探索过程中,很多科学家作出了相应的贡献,我国古代的_____认为
物质是无限可分的,近代原子学说是由_____提出的,_________发现了铀的放射性,
卢瑟福通过_______实验,提出了原子结构的行星模型。
14.按要求用合适的化学用语回答下列问题:
(1)写出含有8个质子、10个中子的原子化学符号___________。
(2)相同质量的DO和HO中质子数之比是___________。
2 2
(3)第ⅦA族上下相邻的两种元素X、Y(X在上),X元素所在周期含m,Y元素所在周期含n种元素,若X的原子序数为x,则Y的原子序数为___________。
(4)金属Li与氧气加热生成物质的化学式___________。
(5)向NaHSO 溶液中滴加Ba(OH) 溶液至溶液呈中性的离子方程式:___________。
4 2
(6)“洁厕灵”和“84消毒液”混合发生氯气中毒的离子方程式:___________。
(7)标况下,VL NH 溶于1L水中所形成的氨水的密度为dg/cm3,该溶液的物质的量浓
3
度为___________。
(8)—种固体管道疏通剂的主要成分是NaOH和Al粉,试解释其疏通原理(用化学方程
式回答):___________。
三、实验题
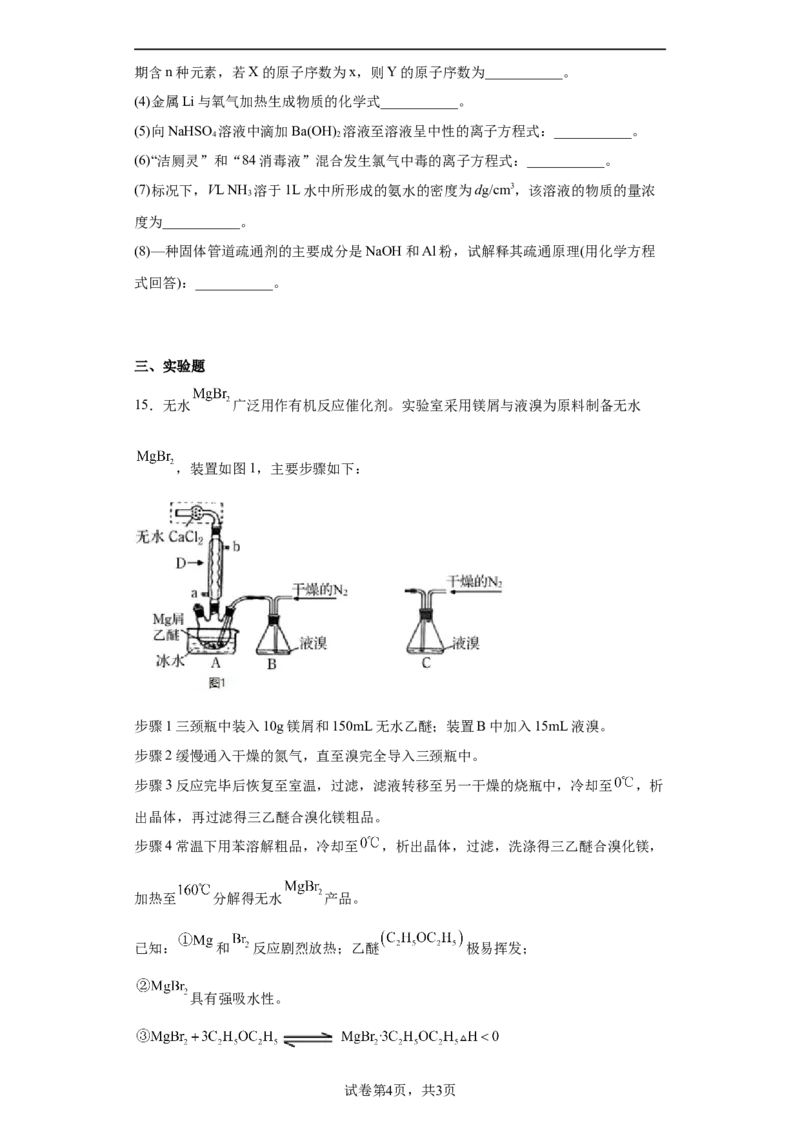
15.无水 广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水
,装置如图1,主要步骤如下:
步骤1三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至 ,析
出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4常温下用苯溶解粗品,冷却至 ,析出晶体,过滤,洗涤得三乙醚合溴化镁,
加热至 分解得无水 产品。
已知: 和 反应剧烈放热;乙醚 极易挥发;
具有强吸水性。
试卷第4页,共3页请回答下列问题:
仪器D的名称是___________________。冷凝水应该从________ 填a或 口通入;
干燥的 可将液溴吹出,是因为液溴具有___________的性质;实验中不能用干燥
空气代替干燥 ,原因是___________;
将装置B改为装置C,可能会导致的后果是_____________________________;
步骤3中,第一次过滤除去的物质是___________________________________;
试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水
产品的原因:__________________________;
为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:
;测定前,先称取 无水 产品,溶解后,用
0.0500mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液20.00mL,则测得无
水 产品的纯度是_________________ 以质量分数表示 。
四、有机推断题
16.(1)在 中,中子数为________;该原子与 是_________关系。
(2)标准状况下,有以下三种物质余① ,② ,③ ,上述物质
质量最大的_____(填序号,下同),所含原子数最多的是______,体积最小的是_______。
(3)已知A、B、C、D均含有同一种元素,其中A为活泼金属单质,热的C溶液可用于
洗涤油污。且它们四种物质之间存在如下转化关系,请回答下列问题:
①D的化学式为:_____。②写出过程③的化学方程式:__________。
试卷第6页,共3页参考答案:
1.A
【详解】A. 的中子数为27-13=14, 的中子数为28-14=14,两者中子数相等,A
正确;
B. 的中子数为14-6=8, 的中子数为16-8=8,两者中子数相等,B错误;
C. 和 质子数相等,都是氧元素,在元素周期表中所处的位置相同,C错误;
D.质子数相同、中子数不同的核素互为同位素, 和 质子数不同,二者不是同位素,
D错误;
答案选A。
2.D
【详解】由信息“Y元素最高正价与最低负价的绝对值之差是4”,可确定Y元素位于第
ⅥA族;
A.Cl是第ⅥIA族元素,故A不符合题意;
B.钠离子和硫离子核外电子层不相同,故B不符合题意;
C.氧不存在最高正价,不符合元素最高正价与最低负价的绝对值之差是4,故C不符合题
意;
D.KS电离出的K+与S2-具有相同的电子层结构,故D符合题意;
2
故选:D。
3.D
【详解】A.Lv的中子数为293-116=177,A正确;
B.元素左上角为质量数,左下角为质子数,因此该原子可表示为 ,B正确;
C.核外电子数=质子数=116,C正确;
D.鉝元素的质量数为293,质量数=质子数+中子数,而相对原子质量以12C原子的质量的
作为标准,其他原子的质量跟它相比所得的数值,大多数元素是由不同的同位素组成,
因此,一种元素的相对原子质量实际上是按其各种同位素原子所占百分含量计算而得的平
均值,所以鉝元素的相对原子质量不是293,D错误;
故选D。4.D
【详解】A.中子不带电荷,故A正确;
B.中子的质量数为1,故四中子的质量数为4,H的质量数为1,该粒子质量比氢原子大,
故B正确;
C.中子的质量数为1,故四中子的质量数为4,故C正确;
D.四中子又被称为零号元素,故不可能与H占同一位置,故D错误。
答案选D。
5.C
【详解】A、金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又
有还原性,如亚铁离子既有氧化性又有还原性,故A错误;
B、单质还原性强弱,与失去电子的难易程度有关,与失去电子数目多少无关,如Al原子
失去3个电子,Na原子失去1个电子,但还原性Na比Al强,故B错误;
C、镁、铝在空气中都能形成致密氧化膜,有保护作用,故C正确;
D、金属元素的单质在常温下不一定为固体,如金属汞在常温下为液态,故D错误。
答案选C。
【点睛】本题考查金属元素的性质,熟悉常见的金属单质及金属对应的阳离子是解答本题
的关键,注意特殊情况。
6.D
【详解】A.O、O 是氧元素形成的不同性质的单质,属于同素异形体关系,氧气为非极
2 3
性分子,臭氧是极性分子,A错误;
B.同位素是指质子数相同,中子数不同的同种元素的不同核素的互称,其研究的对象为
原子, 35Cl与37Cl为同位素关系,37Cl−为离子,与上述两种原子间不属于同位素关系, B
错误;
C.乙二醇( ) 和甘油( )所含羟基数目不同,结构不同,不可
能互为同系物,C错误;
D.CHCHO 与 分子式相同结构不同,互为同分异构体,D正确;
3
答案选D。
7.D
【详解】A.元素周期表有7个主族,7个副族,故A错误;
答案第2页,共2页B.元素周期表有4个长周期、3个短周期,故B错误;
C.第ⅢA族位于元素周期表的第13列(从左往右),故C错误;
D.0族位于元素周期表的第18列(从左往右),故D正确;
选D。
8.D
【详解】A. 的俗名为烧碱、火碱、苛性钠,故A错误;
B.中子数为10的氧原子质量数为10+8=18,可表示为 ,故B错误;
C. 中H为+1价,氧元素的化合价为 ,故C错误;
D. 与 核外有10个电子,都是两层,故具有相同的电子层结构,故D正确;
故答案为D。
9.C
【详解】A.明矾为KAl(SO )·12H O,溶于水能够电离出Al3+,Al3+在水溶液中水解得到
4 2 2
Al(OH) 胶体,Al(OH) 胶体体表面积大,能够吸附水中的杂质,可用于净水,但是不能起
3 3
到杀菌消毒的作用,A错误;
B.淀粉遇碘单质变蓝色,淀粉溶液遇IO -不变蓝色,因此不能用淀粉溶液检验KIO ,B
3 3
错误;
C.Mg、钢制内胆和水可形成原电池,Mg比较活泼,失去电子被腐蚀,保护了内胆,采
用的是牺牲阳极的阴极保护法,C正确;
D.石油的分馏是利用石油中各组分的沸点不同进行分离一种方法,没有新物质生产,是
物理变化;煤的干馏是是将煤隔绝空气加强热,可得到出炉煤气、煤焦油等,是化学变化,
D错误;
答案选C。
10.A
【详解】①碱性氧化物是指与酸反应生成一种盐和水的氧化物,Fe O 与盐酸反应生成氯化
3 4
铁、氯化亚铁和水,生成的盐不只一种,则Fe O 不是碱性氧化物,故①错误;
3 4
②由同一种元素形成的不同单质互为同素异形体,C 、金刚石、石墨均是碳元素形成的不
60
同单质,三者互为同素异形体,故②正确;
③能与碱反应生成盐和水的氧化物是酸性氧化物,CO属于不成盐氧化物,不是酸性氧化
物,故③错误;④液氯是单质,故④错误;
⑤溶于水或熔融状态下能导电的化合物是电解质,硫酸、氢氧化钠、偏铝酸钠溶于水均能
导电,属于电解质,故⑤正确;
⑥溶于水和熔融状态下均不能导电的化合物是非电解质,液氯是单质,既不是电解质,也
不是非电解质,故⑥错误;
综上所述,正确的是②⑤,故选A。
11.A
【详解】A. 单质硫有S、S、S 等,都是由硫元素组成的不同的单质,它们都是硫的同
2 4 6
素异形体,故A正确;
B. O 和O 分子式不同,结构不相同,故B错误;
2 3
C. 石墨导电、金刚石不导电,与二者是否是同素异形体没有必然联系,故C错误;
D. 红磷转化为白磷,生成了新物质,属于化学变化,故D错误;
故选A。
12.C
【分析】在淀粉作指示剂的情况下混合反应,混合液在特定的时间内保持无色,而后突然
转变为蓝色。由于混合液由无色到蓝色这段时间可以精确计时,因此这一反应被称为碘钟
反应。据此解答。
【详解】A.根据已知信息可知A点生成单质碘:
,则 过程中,颜色变化为:蓝色→琥
珀色,A错误;
B.D→E反应为 ,B错误;
C.根据 可判断 持续时间变长,是因为
逐渐被消耗,C正确;
D.H点生成单质碘,由于生成单质碘需要消耗碘酸根,因此透光率减弱是因为碘酸根浓
度下降,D错误;
答案选C。
13. 惠施 道尔顿 贝克勒尔 a散射
答案第4页,共2页【详解】在原子结构的探索过程中,我国战国中期惠施认为物质是无限可分的,1808年,
英国科学家道尔顿提出了原子论,他认为物质是由原子直接构成的,原子是一个实心球体,
不可再分割,创立了近现代原子论;1896年贝克勒尔发现了铀的放射性,1897年,英国科
学家汤姆生发现原子中存在电子.1904年汤姆生提出了葡萄干面包原子模型,1911年,英
国科学家卢瑟福通过a散射,提出了原子结构的行星模型,1913年丹麦物理学家波尔(卢
瑟福的学生)引入量子论观点,提出电子在一定轨道上运动的原子结构模型。
14.(1)
(2)9:10
(3)x+n
(4)Li O
2
(5)
(6)
(7)
(8)
【解析】(1)
质量数 质子数 中子数,因而该粒子为 ;
(2)
的摩尔质量为20g/mol,HO的质量数为 ,设相同质量为mg,则 和
2
的质子数之比为 ;
(3)
由题意, 为上下相邻两种元素,因而Y元素的原子序数为 ;
(4)
形成锂的氧化物,其化学式为:LiO;
2
(5)反应后溶液呈中性,因而 和 的物质的量之比为2∶1,该反应的离子方程式:
;
(6)
84消毒液主要成分是次氯酸钠 ,而洁则灵主要成分为盐酸 ,两者发生氧化还原
反应: ,对应的离子方程式为:
;
(7)
浓度等于氨气的物质的量除以溶液的体积,其中溶液的体积用溶液的质量除以溶液的密度
来计算,溶液的质量为氨气的质量和水的质量的和,具体的计算过程为:
;
(8)
铝粉和氢氧化钠溶液反应产生氢气,并放出热量,从而达到疏通的目的,
。
15. 球形冷凝管 a 极易挥发 镁屑会与空气中的氧气反应,
生成的MgO阻碍反应的继续进行 会将液溴挤压入三颈瓶中,反应加剧大量放热
存在安全隐患 镁屑 加热促使乙醚挥发,且逆反应是吸热反应,加热后
平衡朝有利于三乙醚合溴化镁分解的方向移动
【详解】(1)根据仪器构造,D为球形冷凝管;冷凝水应该从a口通入;故答案为:球形
冷凝管; a;
(2)干燥的 可将液溴吹出,是因为液溴具有极易挥发的性质;实验中不能用干燥空气
答案第6页,共2页代替干燥 ,原因是镁屑与氧气反应生成的氧化镁阻碍Mg和 的反应;
故答案为:极易挥发;镁屑会与空气中的氧气反应,生成的MgO阻碍反应的继续进行;
(3)将装置B改为C装置,当干燥的氮气通入,会使气压变大,将液溴快速压入三颈瓶,
反应过快大量放热存在安全隐患,装置B是利用干燥的氮气将溴蒸气带入三颈瓶中,反应
容易控制,防止反应过快。
故答案为:会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;
(4)步骤3过滤除去的是未反应的镁屑。
故答案为:镁屑;
(5)加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解
的方向移动;故答案为:加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于
三乙醚合溴化镁分解的方向移动;
(6)依据方程式Mg2++EDTA=EDTA—Mg2+分析,溴化镁的物质的量
,则溴化镁的质量为 ,溴化
镁的产品的纯度 。
故答案为: 。
【点睛】本题考查了物质制备实验方案的设计、产品纯度的计算、物质分离提纯的综合应
用,是高考常考题型,掌握基础是解题关键,侧重知识的综合能力考查。
16. 10 同位素 ② ② ③ NaHCO
3
NaCO+ CO+H O=2NaHCO
2 3 2 2 3
【分析】(1)质量数=质子数+中子数;同位素是同种元素的不同核素;
(2) 标准状况下:①22gCO 的物质的量为 =0.5mol,体积
2
为0.5mol×22.4L/mol=11.2L;②33.6LCH 的物质的量为 =1.5mol,质量为
4
1.5mol×16g/mol=24g;③1molH O的质量为1mol×18g/mol=18g,体积为18mL;
2
(3)常用热的NaCO 溶液洗涤油污,且Na为活泼金属,则A为Na、B为NaOH、C为
2 3
NaCO、D为NaHCO 。
2 3 3
【详解】(1)在 中,中子数为18-8=10; 与 具有相同质子数和不同中子数,互为同位素;
(2) 标准状况下:①22gCO 的物质的量为 =0.5mol,体积
2
为0.5mol×22.4L/mol=11.2L,含有的原子总物质的量为1.5mol;②33.6LCH 的物质的量为
4
=1.5mol,质量为1.5mol×16g/mol=24g,含有的原子总物质的量为7.5mol;
③1molH O的质量为1mol×18g/mol=18g,体积为18mL,含有的原子总物质的量为3mol;
2
则上述物质质量最大的②,所含原子数最多的是②,体积最小的是③;
(3) 常用热的NaCO 溶液洗涤油污,且Na为活泼金属,则A为Na、B为NaOH、C为
2 3
NaCO、D为NaHCO ;
2 3 3
①D为碳酸氢钠,化学式为NaHCO ;
3
②过程③为碳酸钠与水、CO 反应生成NaHCO ,发生反应的化学方程式NaCO+
2 3 2 3
CO+H O=2NaHCO 。
2 2 3
答案第8页,共2页