文档内容
绝密★启用前
江苏省 20242025 学年高三上学期期初迎考卷
化 学
注意事项:
1. 本试卷分为选择题和非选择题两部分,试卷满分100分。考试时间75分钟。
2. 答题前。考生务必将班级、姓名、学号写在密封线内。
可能用到的相对原子质量:H—1 C—12 O—16 Nd—144
一、 单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项最符合题意。
1. 从科技前沿到人类的日常生活,化学无处不在。下列说法不正确的是 ( )
A. 国产大型飞机C919用到的氮化硅陶瓷是新型无机非金属材料
B. 光化学烟雾、臭氧层空洞、白色污染的形成都与氮氧化物有关
C. 漂粉精既可作棉麻织物漂白剂,又可用作环境的消毒剂
D. 粒子直径为1~100 nm的铁粉材料,不属于胶体
2. 《Green Chemistry》报道,我国科研工作者发现了一种在低压条件下高效电催化还原CO 的新方
2
法,其总反应为 NaCl+CO NaClO+CO。下列有关化学用语表示正确的是 ( )
2
A. 中子数为20的氯原子:20Cl B. Na+的结构示意图:
·· ··
C. CO 分子的空间结构为V形 D. NaClO的电子式:Na+[· O ·Cl·]-
2 · · ·
·· ··
3. 下列实验室制取NH 的相关实验装置正确的是 ( )
3
A. 制取NH B. 干燥NH C. 收集NH D. 吸
3 3 3
收尾气
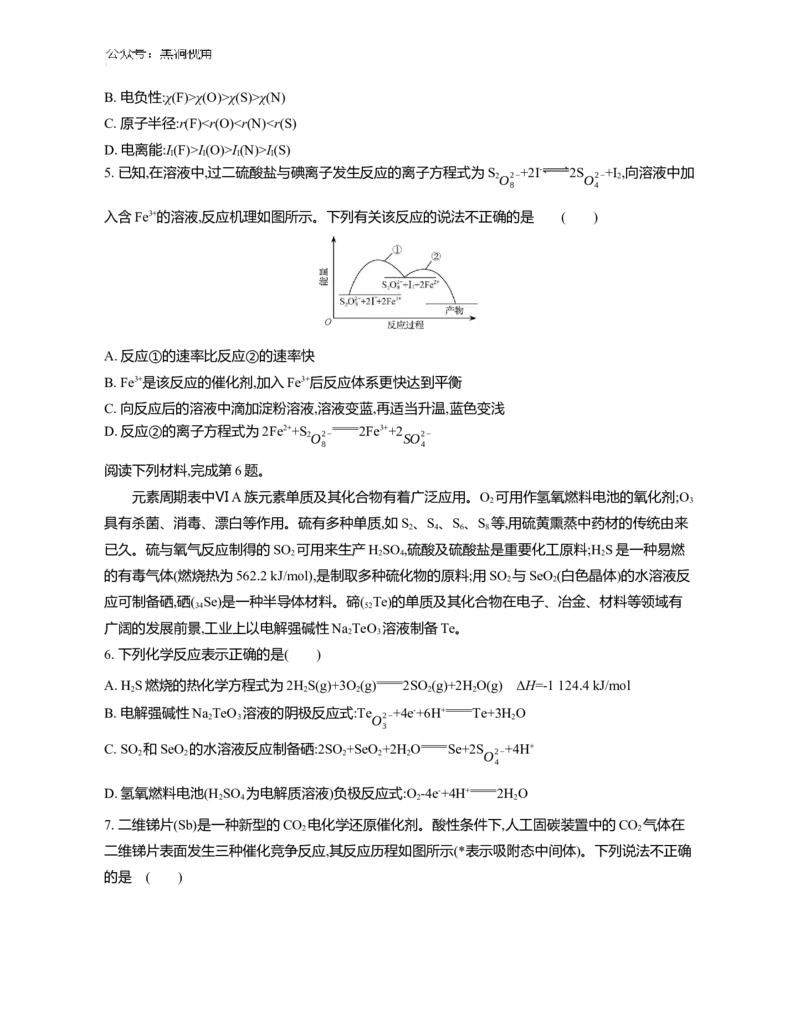
4. 我国科研人员发现氟磺酰基叠氮(FSO N )是一种安全、高效的“点击化学”试剂,其结构式如图
2 3
所示,其中S元素为+6价。下列说法正确的是 ( )
A. 该分子中N原子均为sp2杂化B. 电负性:χ(F)>χ(O)>χ(S)>χ(N)
C. 原子半径:r(F)I(O)>I(N)>I(S)
I I I I
5. 已知,在溶液中,过二硫酸盐与碘离子发生反应的离子方程式为S +2I- 2S +I ,向溶液中加
2O2− O2− 2
8 4
入含Fe3+的溶液,反应机理如图所示。下列有关该反应的说法不正确的是 ( )
A. 反应①的速率比反应②的速率快
B. Fe3+是该反应的催化剂,加入Fe3+后反应体系更快达到平衡
C. 向反应后的溶液中滴加淀粉溶液,溶液变蓝,再适当升温,蓝色变浅
D. 反应②的离子方程式为2Fe2++S 2Fe3++2
2O2− SO2−
8 4
阅读下列材料,完成第6题。
元素周期表中ⅥA族元素单质及其化合物有着广泛应用。O 可用作氢氧燃料电池的氧化剂;O
2 3
具有杀菌、消毒、漂白等作用。硫有多种单质,如S 、S 、S 、S 等,用硫黄熏蒸中药材的传统由来
2 4 6 8
已久。硫与氧气反应制得的SO 可用来生产H SO ,硫酸及硫酸盐是重要化工原料;H S是一种易燃
2 2 4 2
的有毒气体(燃烧热为562.2 kJ/mol),是制取多种硫化物的原料;用SO 与SeO (白色晶体)的水溶液反
2 2
应可制备硒,硒( Se)是一种半导体材料。碲( Te)的单质及其化合物在电子、冶金、材料等领域有
34 52
广阔的发展前景,工业上以电解强碱性Na TeO 溶液制备Te。
2 3
6. 下列化学反应表示正确的是( )
A. H S燃烧的热化学方程式为2H S(g)+3O (g) 2SO (g)+2H O(g) ΔH=-1 124.4 kJ/mol
2 2 2 2 2
B. 电解强碱性Na TeO 溶液的阴极反应式:Te +4e-+6H+ Te+3H O
2 3 O2− 2
3
C. SO 和SeO 的水溶液反应制备硒:2SO +SeO +2H O Se+2S +4H+
2 2 2 2 2 O2−
4
D. 氢氧燃料电池(H SO 为电解质溶液)负极反应式:O -4e-+4H+ 2H O
2 4 2 2
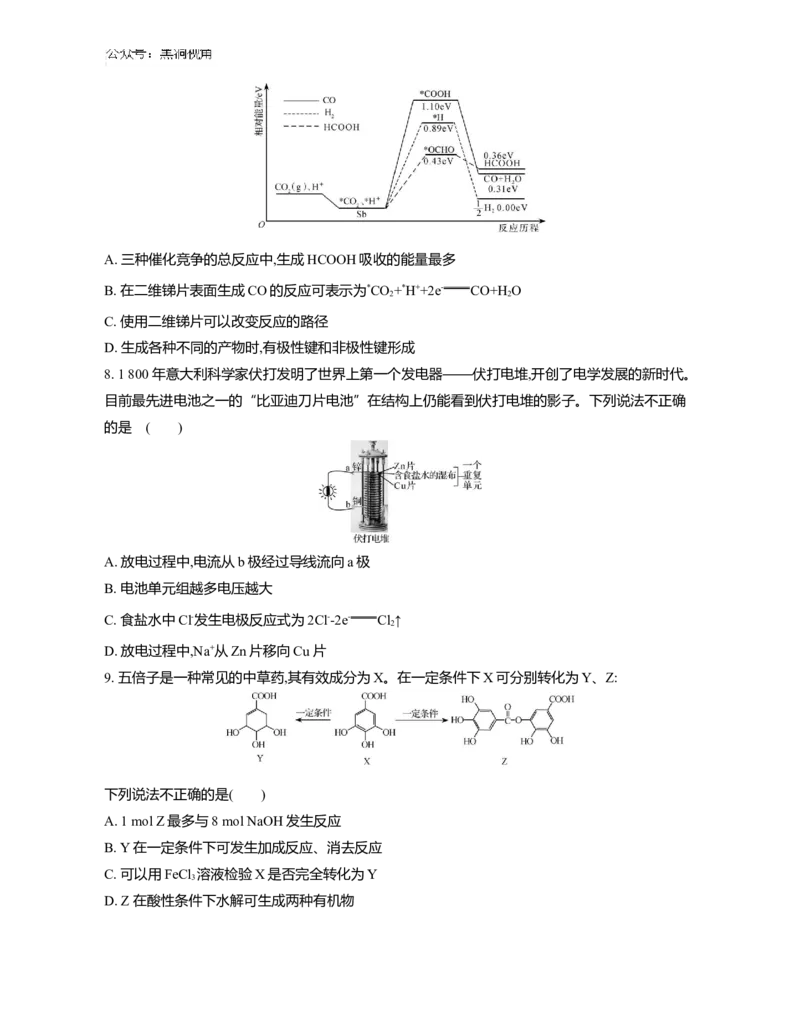
7. 二维锑片(Sb)是一种新型的CO 电化学还原催化剂。酸性条件下,人工固碳装置中的CO 气体在
2 2
二维锑片表面发生三种催化竞争反应,其反应历程如图所示(*表示吸附态中间体)。下列说法不正确
的是 ( )A. 三种催化竞争的总反应中,生成HCOOH吸收的能量最多
B. 在二维锑片表面生成CO的反应可表示为*CO +*H++2e- CO+H O
2 2
C. 使用二维锑片可以改变反应的路径
D. 生成各种不同的产物时,有极性键和非极性键形成
8. 1 800年意大利科学家伏打发明了世界上第一个发电器——伏打电堆,开创了电学发展的新时代。
目前最先进电池之一的“比亚迪刀片电池”在结构上仍能看到伏打电堆的影子。下列说法不正确
的是 ( )
A. 放电过程中,电流从b极经过导线流向a极
B. 电池单元组越多电压越大
C. 食盐水中Cl-发生电极反应式为2Cl--2e- Cl ↑
2
D. 放电过程中,Na+从Zn片移向Cu片
9. 五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z:
下列说法不正确的是( )
A. 1 mol Z最多与8 mol NaOH发生反应
B. Y在一定条件下可发生加成反应、消去反应
C. 可以用FeCl 溶液检验X是否完全转化为Y
3
D. Z 在酸性条件下水解可生成两种有机物10. 下列有关氮、硫、氯的单质及其化合物的转化都能实现的是 ( )
A. 工业制备漂白粉:饱和食盐水 Cl 漂白粉
2
B. 工业制备FeCl :Fe FeI FeCl
3 2 3
C. 工业制备硫酸:FeS SO H SO
2 3 2 4
D. 实验室制备SO :Na SO +2HNO 2NaNO +SO ↑+H O
2 2 3 3 3 2 2
11. 下列实验操作和现象能够得出相应实验结论的是( )
选项实验操作和现象实验结论
将纯碱与浓盐酸反应产生的气体直接通入NaSiO 溶液,产生白色胶
A 2 3 非金属性:C>Si
状沉淀
向等体积、等物质的量浓度的KSO 、KS的稀溶液中分别滴加1
B 2 4 2 K (Ag SO )>K (Ag S)
滴0.1 mol/L AgNO 溶液,充分振荡,只有KS溶液中产生沉淀 sp 2 4 sp 2
3 2
将锌片、铜片用导线连接后同时浸入含有酚酞的食盐水,露置于空
C 装置中发生析氢腐蚀
气中,一段时间后,铜片附近溶液变红色
D 将某补铁剂药片研磨后加入盐酸溶解,滴加KSCN溶液,溶液变红 补铁剂中不含Fe2+
12. 一种吸收SO 再经氧化得到硫酸盐的过程如图所示。室温下,用0.1 mol/L NaOH溶液吸收SO ,
2 2
若通入SO 所引起的溶液体积变化和H O的挥发可忽略,溶液中含硫物种的浓度c =c(H SO )+c(HS
2 2 总 2 3
)+c(S )。H SO 的电离常数分别为K =1.29×10-2,K =6.24×10-8。下列说法正确的是 ( )
O- O2− 2 3 a1 a2
3 3
A. “吸收”所得溶液中:c(Na+)+c(H+)=c(HS )+c(S )+c(OH-)
O- O2−
3 3
B. “吸收”过程中,溶液中c =0.1 mol/L时:K >K ·K
总 w a1 a2
C. 若“吸收”所得溶液pH=7,则溶液中c(S )>c(H SO )
O2− 2 3
3
D. “氧化”时调节溶液pH约为5,主要发生反应:2S +O 2S
O2− 2 O2−
3 4
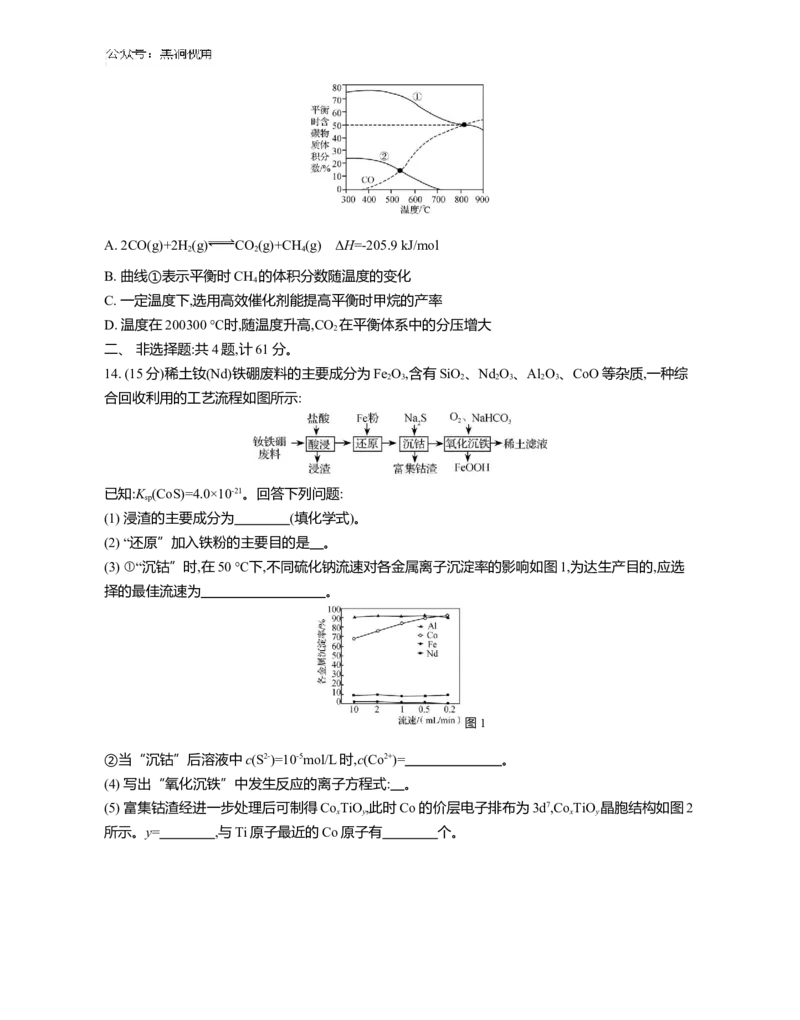
13. 二氧化碳加氢制甲烷过程中的主要反应如下:
反应Ⅰ:CO (g)+4H (g) CH (g)+2H O(g) ΔH =-164.7 kJ/mol
2 2 4 2 1
反应Ⅱ:CO (g)+H (g) CO(g)+H O(g) ΔH =+41.2 kJ/mol
2 2 2 2
在1.01×105Pa恒压条件下,按n (CO )∶n (H )=1∶1投料比进行反应,平衡时含碳物质体积分数随温
起始 2 起始 2
度的变化如图所示。下列说法正确的是 ( )A. 2CO(g)+2H (g) CO (g)+CH (g) ΔH=-205.9 kJ/mol
2 2 4
B. 曲线①表示平衡时CH 的体积分数随温度的变化
4
C. 一定温度下,选用高效催化剂能提高平衡时甲烷的产率
D. 温度在200300 ℃时,随温度升高,CO 在平衡体系中的分压增大
2
二、 非选择题:共4题,计61分。
14. (15分)稀土钕(Nd)铁硼废料的主要成分为Fe O ,含有SiO 、Nd O 、Al O 、CoO等杂质,一种综
2 3 2 2 3 2 3
合回收利用的工艺流程如图所示:
已知:K (CoS)=4.0×10-21。回答下列问题:
sp
(1) 浸渣的主要成分为 (填化学式)。
(2) “还原”加入铁粉的主要目的是 。
(3) ①“沉钴”时,在50 ℃下,不同硫化钠流速对各金属离子沉淀率的影响如图1,为达生产目的,应选
择的最佳流速为 。
图1
②当“沉钴”后溶液中c(S2-)=10-5mol/L时,c(Co2+)= 。
(4) 写出“氧化沉铁”中发生反应的离子方程式: 。
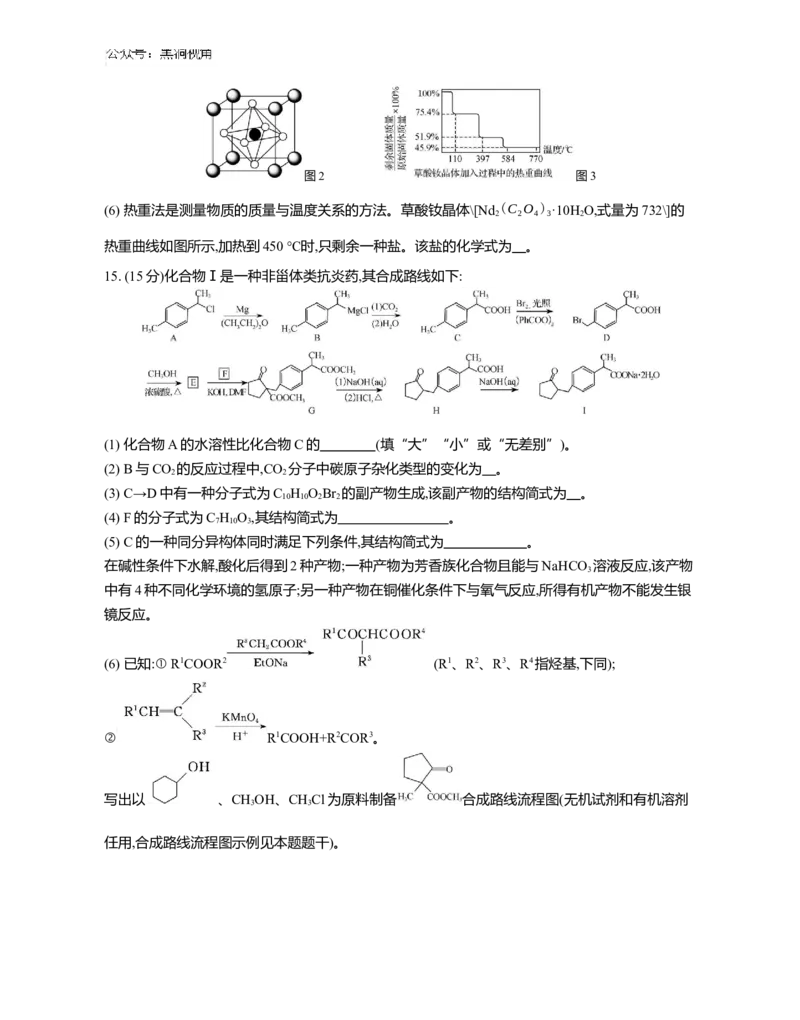
(5) 富集钴渣经进一步处理后可制得Co TiO ,此时Co的价层电子排布为3d7,Co TiO 晶胞结构如图2
x y x y
所示。y= ,与Ti原子最近的Co原子有 个。图2 图3
(6) 热重法是测量物质的质量与温度关系的方法。草酸钕晶体\[Nd (C O ) ·10H O,式量为732\]的
2 2 4 3 2
热重曲线如图所示,加热到450 ℃时,只剩余一种盐。该盐的化学式为 。
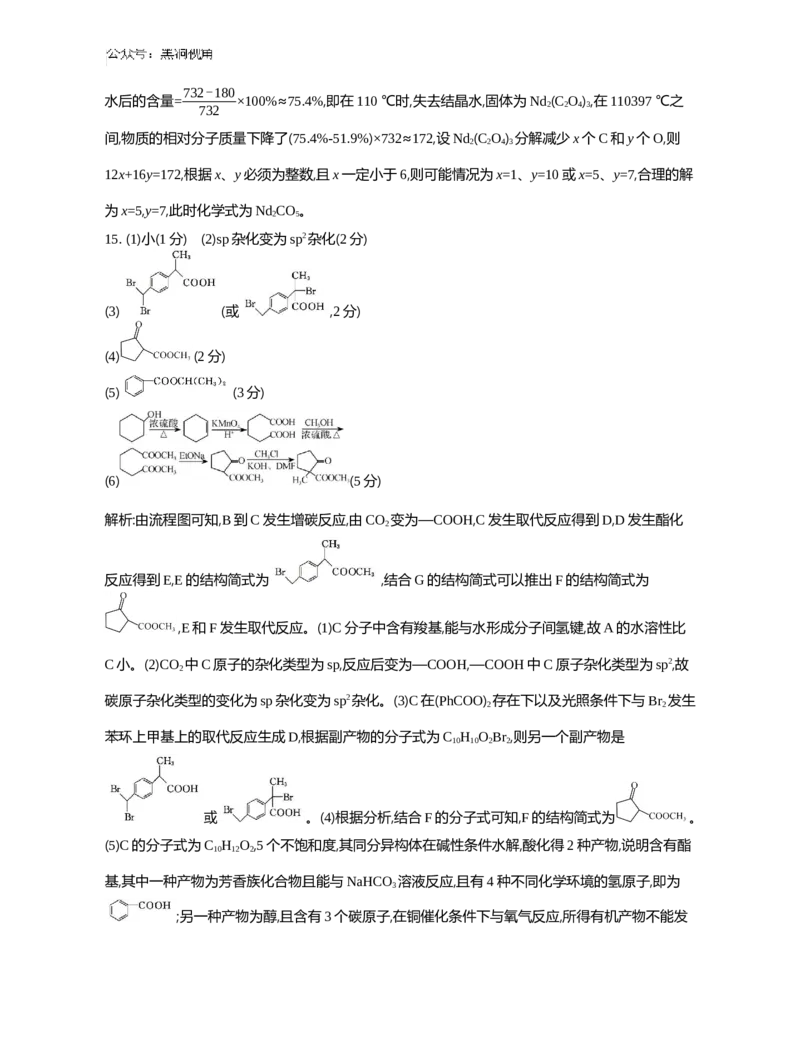
15. (15分)化合物Ⅰ是一种非甾体类抗炎药,其合成路线如下:
(1) 化合物A的水溶性比化合物C的 (填“大”“小”或“无差别”)。
(2) B与CO 的反应过程中,CO 分子中碳原子杂化类型的变化为 。
2 2
(3) C→D中有一种分子式为C H O Br 的副产物生成,该副产物的结构简式为 。
10 10 2 2
(4) F的分子式为C H O ,其结构简式为 。
7 10 3
(5) C的一种同分异构体同时满足下列条件,其结构简式为 。
在碱性条件下水解,酸化后得到2种产物;一种产物为芳香族化合物且能与NaHCO 溶液反应,该产物
3
中有4种不同化学环境的氢原子;另一种产物在铜催化条件下与氧气反应,所得有机产物不能发生银
镜反应。
(6) 已知:① R1COOR2 (R1、R2、R3、R4指烃基,下同);
② R1COOH+R2COR3。
写出以 、CH OH、CH Cl为原料制备 合成路线流程图(无机试剂和有机溶剂
3 3
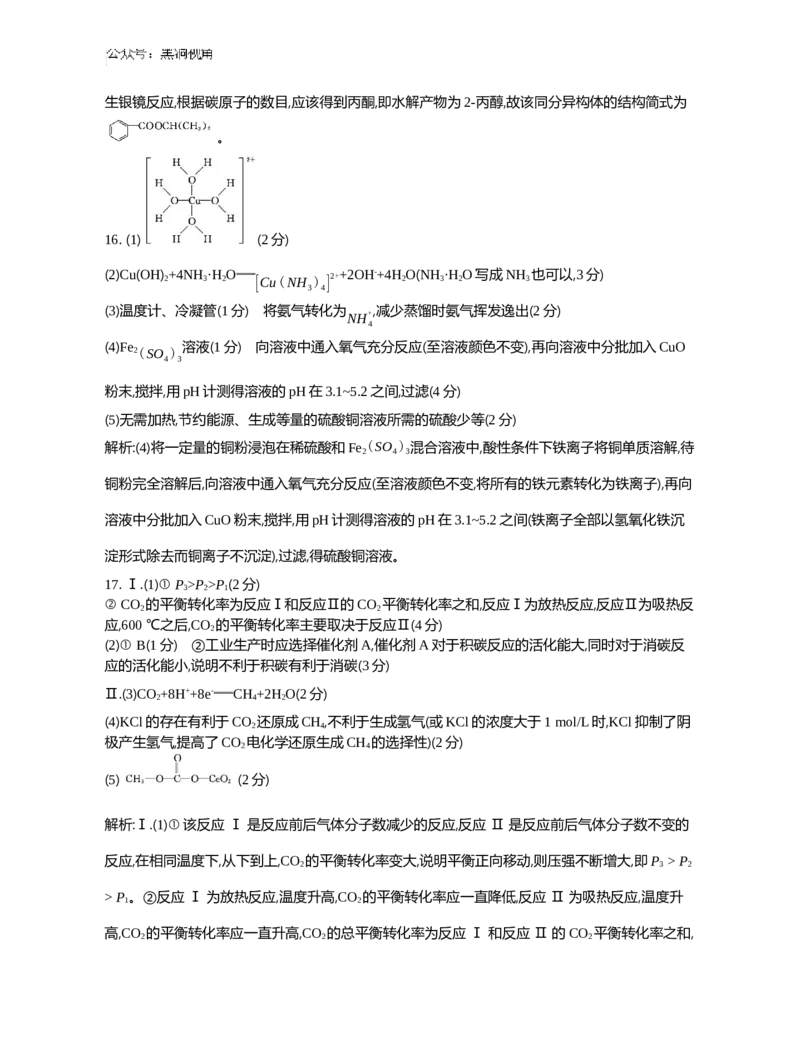
任用,合成路线流程图示例见本题题干)。16. (15分)一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱
[Cu(NH ) SO ·H O]
3 4 4 2
杀菌剂。
Ⅰ.利用硫酸铜溶液制备少量一水硫酸四氨合铜晶体并回收乙醇,实验步骤如下。
步骤1:向硫酸铜溶液中滴加1 mol/L氨水至产生蓝色絮状沉淀。
步骤2:向“步骤1”所得沉淀中继续滴加氨水至转化成深蓝色溶液。
步骤3:向“步骤2”所得溶液中加入稍过量的乙醇溶液,析出深蓝色晶体,过滤。
步骤4:向“步骤3”所得的滤液中加入稀硫酸调节溶液的pH至5左右后蒸馏。
(1) 画出
[Cu(H O) ]
2+结构式: 。
2 4
(2) “步骤2”中主要反应的离子方程式为 。
(3) “步骤4”中蒸馏所需的玻璃仪器除酒精灯、蒸馏烧瓶、承接管、锥形瓶外还需玻璃仪器有
。蒸馏前用稀硫酸调节溶液pH的目的是
。
Ⅱ.工业上常用Fe3+、铜粉来制备硫酸铜溶液。
(4) 补充完整制取硫酸铜溶液的实验方案:将一定量的铜粉浸泡在稀硫酸和 混合溶液
中,铜粉完全溶解后,
,
得到硫酸铜溶液(实验中可选用试剂:FeCl 溶液、Fe (SO ) 溶液、O 、CuO粉末)。
3 2 4 3 2
已知:一定浓度的Fe3+、Cu2+、Fe2+形成氢氧化物沉淀的pH范围如下表所示:
金属离子Fe3+Cu2+Fe2+
开始沉淀2.45.27.6
完全沉淀3.16.49.6
(5) 该方法与铜与浓硫酸直接反应制备硫酸铜溶液相比,优点有除不产生污染性气体外,还有
。
17. (16分)碳中和是科学研究的重要方向,将二氧化碳转化为甲烷、碳酸二甲酯等,是资源化利用CO
2
的有效方式。
Ⅰ.合成CH 过程中涉及如下反应:
4
反应Ⅰ\[甲烷化反应(主反应)\]:CO (g)+4H (g) CH (g)+2H O(g)
2 2 4 2
ΔH =-164.7 kJ/mol
1反应Ⅱ\[逆变换反应(副反应)\]:CO (g)+H (g) CO(g)+H O(g)
2 2 2
ΔH =+41.1 kJ/mol
2
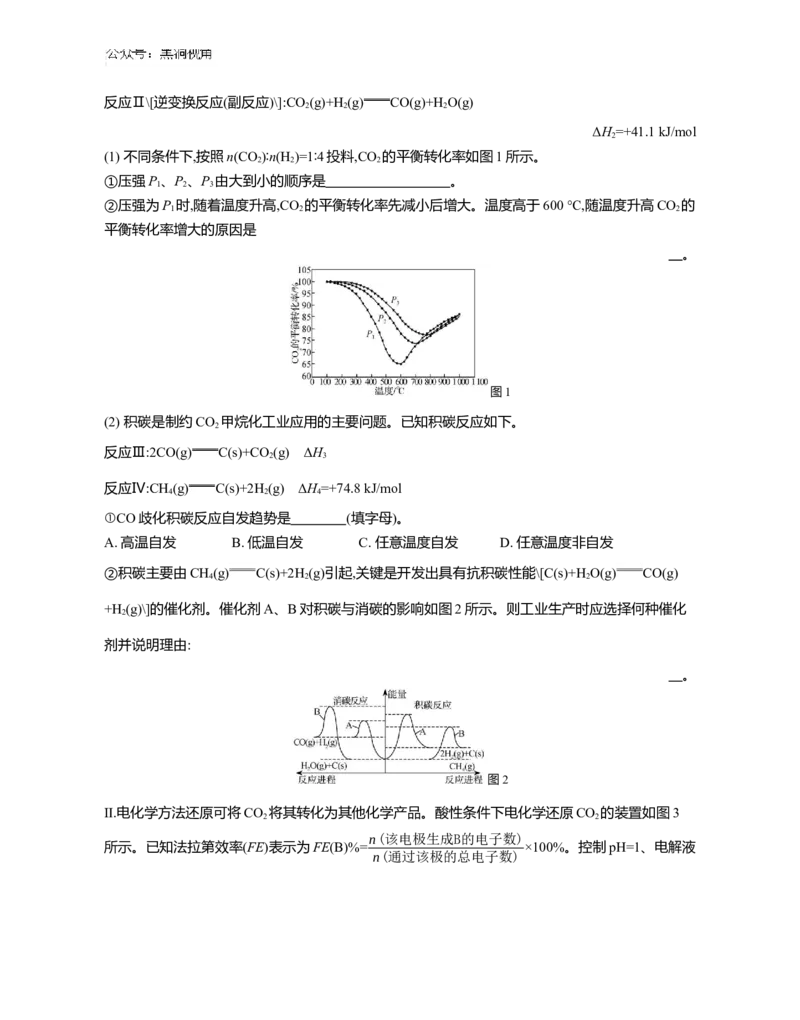
(1) 不同条件下,按照n(CO )∶n(H )=1∶4投料,CO 的平衡转化率如图1所示。
2 2 2
①压强P 、P 、P 由大到小的顺序是 。
1 2 3
②压强为P 时,随着温度升高,CO 的平衡转化率先减小后增大。温度高于600 ℃,随温度升高CO 的
1 2 2
平衡转化率增大的原因是
。
图1
(2) 积碳是制约CO 甲烷化工业应用的主要问题。已知积碳反应如下。
2
反应Ⅲ:2CO(g) C(s)+CO (g) ΔH
2 3
反应Ⅳ:CH (g) C(s)+2H (g) ΔH =+74.8 kJ/mol
4 2 4
①CO歧化积碳反应自发趋势是 (填字母)。
A. 高温自发 B. 低温自发 C. 任意温度自发 D. 任意温度非自发
②积碳主要由CH (g) C(s)+2H (g)引起,关键是开发出具有抗积碳性能\[C(s)+H O(g) CO(g)
4 2 2
+H (g)\]的催化剂。催化剂A、B对积碳与消碳的影响如图2所示。则工业生产时应选择何种催化
2
剂并说明理由:
。
图2
Ⅱ.电化学方法还原可将CO 将其转化为其他化学产品。酸性条件下电化学还原CO 的装置如图3
2 2
n(该电极生成B的电子数)
所示。已知法拉第效率(FE)表示为FE(B)%= ×100%。控制pH=1、电解液
n(通过该极的总电子数)中存在KCl时,电化学还原CO 过程中CH (其他含碳产物未标出)和H 的法拉第效率变化如图4所
2 4 2
示。
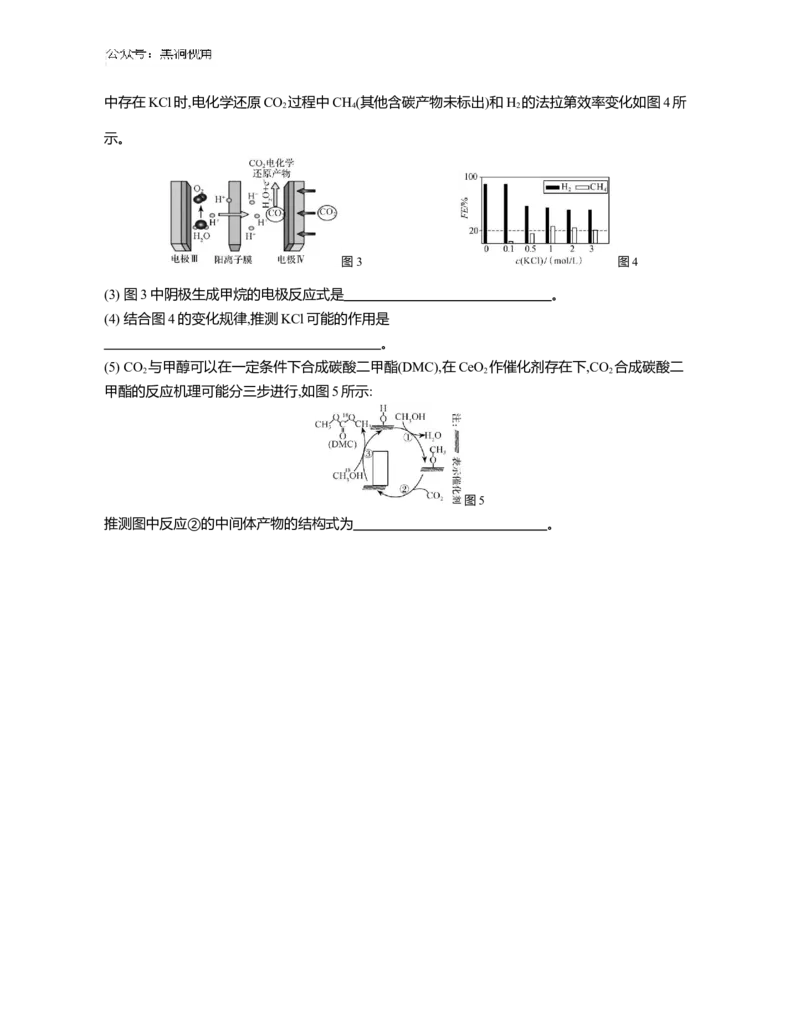
图3 图4
(3) 图3中阴极生成甲烷的电极反应式是 。
(4) 结合图4的变化规律,推测KCl可能的作用是
。
(5) CO 与甲醇可以在一定条件下合成碳酸二甲酯(DMC),在CeO 作催化剂存在下,CO 合成碳酸二
2 2 2
甲酯的反应机理可能分三步进行,如图5所示:
图5
推测图中反应②的中间体产物的结构式为 。江苏省 20242025 学年高三上学期期初迎考卷
化学参考答案与评分标准
1. B 解析:白色污染的形成与氮氧化物无关,B错误。
37
2. D 解析:中子数为20的氯原子应表示为 Cl,A错误;Na+的结构示意图为 ,B错误;CO 分子
17 2
中C原子是sp杂化,空间结构为直线形,C错误。
3. C 解析:NH Cl受热分解生成的氨气和氯化氢在试管口遇冷又重新化合生成氯化铵,无法获得氨
4
气,A错误;氨气与浓硫酸发生反应,不能用浓硫酸干燥氨气,B错误;氨气极易溶于水,将氨气直接通入
水中会发生倒吸现象,D错误。
4. C 解析:该分子中与S相连的N原子价层电子对数为2+1=3,杂化类型为sp2杂化,另外两个N原
子价层电子对数为2,杂化类型为sp杂化,A错误;元素的非金属性越强,其电负性越大,非金属性:
F>O>N>S,电负性:F>O>N>S,B错误;同一主族从上到下,元素的第一电离能逐渐减小,同一周期从左
到右,主族元素的第一电离能呈增大趋势,但第ⅡA族、第ⅤA族元素的原子核外电子处于全满、
半满的稳定状态,其第一电离能比同周期相邻元素的大,则第一电离能:F>N>O>S,D错误。
5. A 解析:由图可知,反应①的活化能比反应②的大,因此反应②的速率更快,A错误;图中产物应为
2S +I +2Fe3+,因此Fe3+是该反应的催化剂,可加快反应速率,B正确;由图可知,该反应为放热反应,升
O2- 2
4
高温度,平衡逆向移动,c(I )下降,溶液蓝色变浅,C正确;反应②的离子方程式为2Fe2++S 2Fe3+
2 2O2-
8
+2S ,D正确。
O2-
4
6. C 解析:该热化学方程式中的水应为液态,A错误;电解强碱性Na TeO 溶液的阴极反应式中不应
2 3
该出现H+,正确的阴极反应式为Te +4e-+3H O Te+6OH-,B错误;SO 将SeO 中Se还原为Se单
O2- 2 2 2
3
质,本身被氧化为S ,C正确;氢氧燃料电池(H SO 为电解质溶液)中通入氢气一极为负极,负极电极
O2- 2 4
4
反应式应为H -2e- 2H+,D错误。
2
7. B 解析:由图可知,HCOOH的能量最高,则生成HCOOH吸收的能量最多,A正确;该反应中氢原子
不守恒,在二维锑片表面生成CO的反应正确为*CO +2*H++2e- CO+H O,B错误;二维锑片是该反应
2 2
的催化剂,催化剂改变了该反应的路径,C正确;该反应生成的产物有H 、HCOOH、CO、H O,有极
2 2
性键和非极性键形成,D正确。8. C 解析:该电池是原电池,锌比铜活泼,Zn作负极,Cu作正极,电流从正极b铜电极经过导线流向负
极a极锌电极,A正确;电池单元组越多,电势差越大,电压越大,B正确;Zn为活泼金属,作负极,发生失
电子的反应应为Zn-2e- Zn2+,C错误;放电过程中,阳离子移向正极b,即Na+移向Cu片,D正确。
9. D 解析:Z分子含5个酚羟基、1个羧基和一个酚酯基,所以1 mol X最多与8 mol NaOH 发生反
应,A正确;Y分子中含有碳碳双键,在一定条件下可以发生加成反应,Y分子中含有醇羟基,且相邻碳
原子上含有氢原子,在浓硫酸加热条件下可发生消去反应,B正确;X分子含有酚羟基,可与FeCl 溶液
3
发生显色反应,Y分子中不含酚羟基,若加入FeCl 溶液后没有紫色,说明X完全转化为Y,若有紫色说
3
明未完全转化,能根据溶液颜色确定X是否完全转化,C正确;在酸性条件下,Z分子中的酯基发生水
解,生成的有机物仅为 一种产物,D错误。
10. B 解析:制得的氯气应通入冷的石灰乳中来制备漂白粉,A错误;I 具有弱氧化性,只能将Fe氧化
2
为FeI ,FeI 中的Fe2+和I-都能被Cl 氧化,可得到FeCl ,B正确;FeS 在高温下与氧气反应生成的是
2 2 2 3 2
SO ,C错误;实验室一般是用Na SO 固体与浓硫酸制备SO ,HNO 具有强氧化性,会氧化Na SO 生成
2 2 3 2 3 2 3
Na SO ,无法制得SO ,D错误。
2 4 2
11. B 解析:浓盐酸易挥发,纯碱与浓盐酸反应产生的CO 中混有HCl气体,HCl也能与Na SiO 溶液
2 2 3
反应产生白色胶状沉淀,不能说明碳酸的酸性强于硅酸,即无法得出结论非金属性:C>Si,A错误;向等
体积、等物质的量浓度的K SO 、K S的稀溶液中滴加1滴0.1 mol/L AgNO 溶液,只有K S溶液中
2 4 2 3 2
产生沉淀,溶度积小的先沉淀,说明K (Ag SO )>K (Ag S),B正确;金属活动性:Zn >Cu, Cu作正极,氧
sp 2 4 sp 2
气在铜片上得电子发生还原反应,电极反应式为O +4e-+ 2H O 4OH-,铜片附近溶液变红色,发生吸
2 2
氧腐蚀,C错误;将某补铁剂药片研磨后加入盐酸溶解,滴加KSCN溶液,溶液变红,说明溶液中含有
Fe3+,但不能说明补铁剂中不含Fe2+,D错误。
12. C 解析:溶液中存在电荷守恒:c(Na+)+c(H+)=c(HS )+2c(S )+c(OH-),A错误;“吸收”所得溶液
O- O2-
3 3
中c =0.1 mol/L时,即为NaHSO 溶液,根据K = K = 10-14 c(HS
O- O2- O- O2-
3 3 3 3)+c(S )+c(H SO ),则可得c(S )>c(H SO ),C正确;“氧化”时调节溶液pH约为5,此时溶液中
O- O2- 2 3 O2- 2 3
3 3 3
溶质主要成分为NaHSO ,反应为2HS +O 2S +2H+,D错误。
3 O- 2 O2-
3 4
13. D 解析:根据盖斯定律,由反应 Ⅰ-2×反应 Ⅱ 可得2CO(g)+2H (g) CO (g)+CH (g) ΔH=-164.7
2 2 4
kJ/mol-(2×41.2 kJ/mol)=-247.1 kJ/mol,A错误;由图可知,曲线②最终降为0,根据可逆反应中反应物不
可能完全转化,则曲线②表示的是CH 的体积分数随温度的变化,因反应Ⅰ是放热反应,温度升高,平
4
衡逆移,甲烷的量减少,最终降为0,则曲线①表示的是CO 的体积分数随温度的变化,B错误;催化剂
2
不能使平衡发生移动,不能提高平衡时甲烷的产率,C错误;由图可知,在300 ℃时,体系中CO的含量
为0,即温度高于300 ℃,反应Ⅱ才进行,温度在200300 ℃之间时,仅发生反应Ⅰ,反应Ⅰ为放热反应,则
在200300 ℃之间时,随温度升高,平衡逆移,恒压体系中,CO 在平衡体系中的分压增大,D正确。
2
14. (1)SiO (1分) (2)将Fe3+还原为Fe2+,防止Fe3+在“沉钴”时转化为沉淀Fe(OH) 析出(2分)
2 3
(3)① 0.5 mL/min(1分) ②4.0×10-16mol/L(2分)
(4)4Fe2++O +8 4FeOOH↓+8CO ↑+2H O(3分) (5)3(1分) 8(1分) (6)Nd CO (4分)
2 HCO- 2 2 2 5
3
解析:(1)根据流程图中“沉钴”“氧化沉铁”“稀土滤液”等信息可知,CoO、Fe O 、Nd O 均溶解
2 3 2 3
进入后续流程,故“酸浸”时没有溶解的是SiO ,所以浸渣的主要成分为SiO 。(2)Na S在水溶液中
2 2 2
水解呈碱性,容易将Fe3+转化为Fe(OH) 沉淀析出,故用铁粉将Fe3+还原为Fe2+,防止Fe3+转化为
3
Fe(OH) 析出。(3)①根据曲线趋势可知,铝、铁与稀土金属钕的沉淀率受Na S浓度影响不大,主要观
3 2
察钴的沉淀率趋势,Na S流速达到0.5 mL/min时钴的沉淀率达到较高值,再降低Na S流速,钴的沉淀
2 2
率变化不大,故应选择0.5 mL/min。②当“沉钴”后溶液中c(S2-)=10-5mol/L时,溶液中的Co2+与S2-
达到沉淀溶解平衡状态,故c(Co2+)=K (cos) =4.0×10-21mol/L=4.0×10-16mol/L,Co2+已经完全沉淀。
sp
c(S2-) 10-5
(4)根据流程,氧气将Fe2+氧化为Fe3+,同时与 水解出的OH-反应生成FeOOH沉淀,再利用电荷守
HCO-
3
恒和原子守恒可写出该反应的离子方程式。(5)Co的价层电子排布为3d7,即为Co2+,该晶胞中顶角原
1 1
子数为8× =1,面心原子数为6× =3,体心原子数为1,其比例为1∶1∶3,化学式为Co TiO ,则x=1、y=3
x y
8 2
或x=3、y=1,由Co元素显+2价、O元素显-2价,可排除x=3、y=1,故x=1、y=3,即Ti和Co互为顶角
和体心关系,相互间距离最短且相等的原子都为8个。(6)M\[Nd (C O ) ·10H O\]=732,其中除去结晶
r 2 2 4 3 2732-180
水后的含量= ×100%≈75.4%,即在110 ℃时,失去结晶水,固体为Nd (C O ) ,在110397 ℃之
2 2 4 3
732
间,物质的相对分子质量下降了(75.4%-51.9%)×732≈172,设Nd (C O ) 分解减少x个C和y个O,则
2 2 4 3
12x+16y=172,根据x、y必须为整数,且x一定小于6,则可能情况为x=1、y=10或x=5、y=7,合理的解
为x=5,y=7,此时化学式为Nd CO 。
2 5
15. (1)小(1分) (2)sp杂化变为sp2杂化(2分)
(3) (或 ,2分)
(4) (2分)
(5) (3分)
(6) (5分)
解析:由流程图可知,B到C发生增碳反应,由CO 变为—COOH,C发生取代反应得到D,D发生酯化
2
反应得到E,E的结构简式为 ,结合G的结构简式可以推出F的结构简式为
,E和F发生取代反应。(1)C分子中含有羧基,能与水形成分子间氢键,故A的水溶性比
C小。(2)CO 中C原子的杂化类型为sp,反应后变为—COOH,—COOH中C原子杂化类型为sp2,故
2
碳原子杂化类型的变化为sp杂化变为sp2杂化。(3)C在(PhCOO) 存在下以及光照条件下与Br 发生
2 2
苯环上甲基上的取代反应生成D,根据副产物的分子式为C H O Br ,则另一个副产物是
10 10 2 2
或 。(4)根据分析,结合F的分子式可知,F的结构简式为 。
(5)C的分子式为C H O ,5个不饱和度,其同分异构体在碱性条件水解,酸化得2种产物,说明含有酯
10 12 2
基,其中一种产物为芳香族化合物且能与NaHCO 溶液反应,且有4种不同化学环境的氢原子,即为
3
;另一种产物为醇,且含有3个碳原子,在铜催化条件下与氧气反应,所得有机产物不能发生银镜反应,根据碳原子的数目,应该得到丙酮,即水解产物为2-丙醇,故该同分异构体的结构简式为
。
16. (1) (2分)
(2)Cu(OH)
2
+4NH
3
·H
2
O
[Cu(NH ) ]
2++2OH-+4H
2
O(NH
3
·H
2
O写成NH
3
也可以,3分)
3 4
(3)温度计、冷凝管(1分) 将氨气转化为 ,减少蒸馏时氨气挥发逸出(2分)
NH+
4
(4)Fe 溶液(1分) 向溶液中通入氧气充分反应(至溶液颜色不变),再向溶液中分批加入CuO
2(SO )
4 3
粉末,搅拌,用pH计测得溶液的pH在3.1~5.2之间,过滤(4分)
(5)无需加热,节约能源、生成等量的硫酸铜溶液所需的硫酸少等(2分)
解析:(4)将一定量的铜粉浸泡在稀硫酸和Fe (SO ) 混合溶液中,酸性条件下铁离子将铜单质溶解,待
2 4 3
铜粉完全溶解后,向溶液中通入氧气充分反应(至溶液颜色不变,将所有的铁元素转化为铁离子),再向
溶液中分批加入CuO粉末,搅拌,用pH计测得溶液的pH在3.1~5.2之间(铁离子全部以氢氧化铁沉
淀形式除去而铜离子不沉淀),过滤,得硫酸铜溶液。
17. Ⅰ.(1)① P >P >P (2分)
3 2 1
② CO 的平衡转化率为反应Ⅰ和反应Ⅱ的CO 平衡转化率之和,反应Ⅰ为放热反应,反应Ⅱ为吸热反
2 2
应,600 ℃之后,CO 的平衡转化率主要取决于反应Ⅱ(4分)
2
(2)① B(1分) ②工业生产时应选择催化剂A,催化剂A对于积碳反应的活化能大,同时对于消碳反
应的活化能小,说明不利于积碳有利于消碳(3分)
Ⅱ.(3)CO +8H++8e- CH +2H O(2分)
2 4 2
(4)KCl的存在有利于CO 还原成CH ,不利于生成氢气(或KCl的浓度大于1 mol/L时,KCl抑制了阴
2 4
极产生氢气,提高了CO 电化学还原生成CH 的选择性)(2分)
2 4
(5) (2分)
解析:Ⅰ.(1)①该反应 Ⅰ 是反应前后气体分子数减少的反应,反应 Ⅱ 是反应前后气体分子数不变的
反应,在相同温度下,从下到上,CO 的平衡转化率变大,说明平衡正向移动,则压强不断增大,即P > P
2 3 2
> P 。②反应 Ⅰ 为放热反应,温度升高,CO 的平衡转化率应一直降低,反应 Ⅱ 为吸热反应,温度升
1 2
高,CO 的平衡转化率应一直升高,CO 的总平衡转化率为反应 Ⅰ 和反应 Ⅱ 的CO 平衡转化率之和,
2 2 2而随着温度升高,CO 的平衡转化率先减小后增大,说明低于600℃之前,CO 的平衡转化率主要取决
2 2
于反应 Ⅰ,高于600 ℃之后,CO 的平衡转化率主要取决于反应Ⅱ。(2)①根据盖斯定律,由反应Ⅰ-
2
Ⅱ×2+Ⅳ得反应2CO(g) C(s)+CO (g) ΔH =ΔH -2ΔH +ΔH =-164.7 kJ/mol-(+41.1 kJ/mol)×2+74.8
2 3 1 2 4
kJ/mol=-172.1 kJ/mol,即ΔH <0,则2CO(g) C(s)+CO (g)在低温下能自发进行。②为了消除积碳,应
3 2
该抑制积碳反应的发生,促进消碳反应的进行,由图可知催化剂A对于积碳反应的活化能较大,同时
对于消碳反应的活化能较小,故应该选择催化剂A。Ⅱ.(5)根据流程可知, 与CO 反应生成中
2
间产物,中间产物与CH 18OH反应生成DMC和 ,推得中间产物为 。
3