文档内容
【解析】常温下,Fe在稀硝酸中剧烈反应,不会发生钝化,A项错误;MnO 和稀盐酸不反应,
(新教材)下学期高一第一次月考卷 2
制取氯气应用浓盐酸,B项错误;室温下,钠与氧气反应生成氧化钠,在加热条件下才生成过氧化
化 学(B) 钠,D项错误。
3.NO 和Br 蒸汽都是红棕色、有刺激性气味的气体。下列不能用来区别这两种气体的试剂是
2 2
注意事项:
A.CCl B.浓HSO C.蒸馏水 D.AgNO 溶液
4 2 4 3
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码
【答案】B
粘贴在答题卡上的指定位置。
【解析】A.溴蒸汽能够被CCl 溶解,二氧化氮不能,现象不同,能够区分,故 A正确;B.
4
2.选择题的作答:每小题选出答案后,用 2B铅笔把答题卡上对应题目的答案标号涂黑,
浓硫酸与NO 和Br 蒸汽都没有明显的现象,不能区分,故B错误;C.溴水有颜色,二氧化氮与
2 2
写在试题卷、草稿纸和答题卡上的非答题区域均无效。
水反应生成的硝酸无色,现象不同,能够区分,故C正确;D.溴与AgNO 溶液反应生成淡黄色沉
3
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿
淀,二氧化氮没有,现象不同,能够区分,故D正确;故选B。
纸和答题卡上的非答题区域均无效。
4.某博物馆陈列着大量明清砖瓦和精美瓷器(婺州窑),婺州窑瓷器胎体的原料为高岭土
4.考试结束后,请将本试题卷和答题卡一并上交。
[AlSi O(OH) ]。下列说法不正确的是
n 2 5 4
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Mn 55 Ba 137
A.古代的陶瓷、砖瓦都是硅酸盐产品 B.高岭土为含水的铝硅酸盐
C.n=3 D.我国在新石器时代已能烧制陶器
一、选择题
【答案】C
1.陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说
【解析】A.古代的陶瓷、砖瓦都是硅酸盐产品,故A正确;B.高岭土为含水的铝硅酸盐,故
法错误的是
B正确;C.根据化合物中正负化合价代数和为 0的规则:n×(+3)+2×(+4)+5×(-2)+4×(-1)=0,解得
A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁
n=2,故C错误;D.我国在新石器时代已能烧制陶器,故D正确;故选C。
B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
5.硫酸是一种重要的化工原料,下列关于硫酸的说法中不正确的是
C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
A.硫酸可用于生产化肥、农药和炸药等
D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
B.硫黄和黄铁矿可以作为制备硫酸的原料
【答案】A
C.工业制备硫酸时,SO 转化为SO 的反应需要在加热和催化剂存在的条件下进行
2 3
【解析】A.氧化铁为棕红色固体,瓷器的青色不可能来自氧化铁,故A错误;B.秦兵马俑是
D.反应生成的SO 可以用水直接吸收来制备硫酸
3
陶制品,陶制品是由粘土或含有粘土的混合物经混炼、成形、煅烧而制成的,故 B正确;C.陶瓷
【答案】D
的主要原料是取之于自然界的硅酸盐矿物,陶瓷的主要成分是硅酸盐,与水泥、玻璃等同属硅酸盐
【解析】A.硫酸可用于生产化肥,如硫酸铵,生产农药,如制备硫酸铜来配制波尔多液,生
产品,故C正确;D.陶瓷的主要成分是硅酸盐,硅酸盐的化学性质不活泼,具有不与酸或碱反应、
产炸药,如制备TNT作催化剂,A项正确;B.硫黄或黄铁矿和氧气焙烧产生二氧化硫、二氧化硫
抗氧化的特点,故D正确。故选A。
和氧气反应产生三氧化硫、三氧化硫溶于水得硫酸,因此以硫黄或黄铁矿作为原料可用于制取硫酸,
2.下列有关化学反应的叙述正确的是
B项正确;C.工业制备硫酸时,SO 转化为SO 的反应在400-500℃、VO 作催化剂的条件下进行,
2 3 2 5
A.Fe在稀硝酸中发生钝化
C项正确;D.三氧化硫极易溶于水,溶于水易形成酸雾,因此工业生产中用 98.3%的浓硫酸来吸
B.MnO 和稀盐酸反应制取Cl
2 2
收SO ,D项错误;答案选D。
3
C.SO 与过量氨水反应生成(NH )SO
2 4 2 3
6.向FeCl 和BaCl 的酸性混合溶液中通入SO 气体,有白色沉淀生成,此沉淀是
3 2 2
D.室温下Na与空气中O 反应制取NaO
2 2 2
A.BaSO B.Fe (SO ) C.BaSO D.S
4 2 4 3 3
【答案】C
【答案】A
封密不订装只卷此
号位座
号场考
号证考准
名姓
级班【解析】Fe3+有氧化性,SO 有还原性,两者可发生氧化还原反应,硫元素化合价升高,生成的 D.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量
2
SO与Ba2+结合成BaSO,故A符合;故选A。 【答案】B
4
7.汽车尾气中的氮氧化合物NO 与大气中的NH 发生如下作用,形成一种雾霾。 【解析】瓷器是由瓷石、高岭土、石英石(SiO )、莫来石等烧制而成,SiO 只是主要成分之
x 3 2 2
一,A选项错误;将“生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结”,属于固体直接
转化为气体后再变成固体,类似于碘的升华,因此涉及的操作方法是升华,选项 B正确;0.001微
米(μm)=1纳米(nm),胶体粒子直径在1~100纳米之间,PM2.5不在此范围内,即不能够形
有关该雾霾的叙述错误的是
成胶体,C选项错误;农作物收获后,就地焚烧秸秆,是可以增加土壤中钾肥含量,但同时会产生
A.该雾霾中含硝酸铵固体 B.反应②是非氧化还原反应
C.NH 是形成该雾霾的催化剂 D.NH 可能来自过度施用氮肥 有害气体和烟尘,造成严重的环境污染问题,所以国家限制就地焚烧秸秆,D选项错误;正确答案
3 3
【答案】C B。
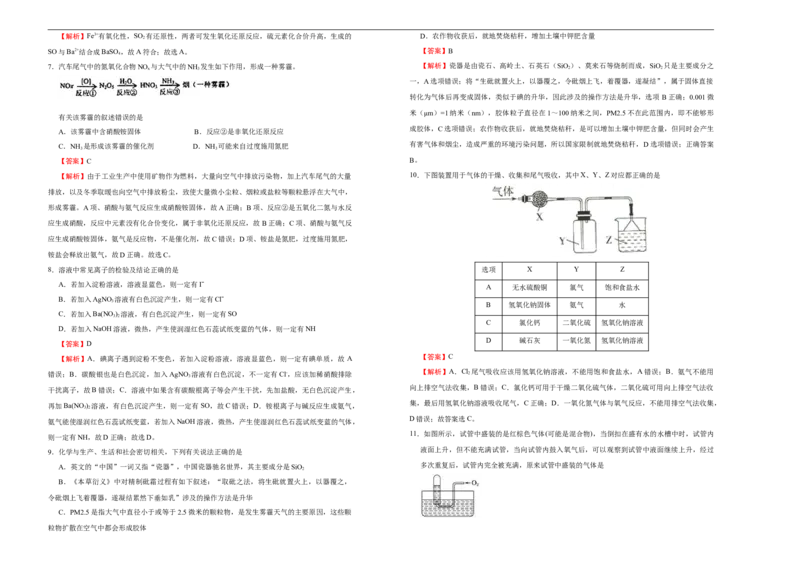
【解析】由于工业生产中使用矿物作为燃料,大量向空气中排放污染物,加上汽车尾气的大量 10.下图装置用于气体的干燥、收集和尾气吸收,其中X、Y、Z对应都正确的是
排放,以及冬季取暖也向空气中排放粉尘,致使大量微小尘粒、烟粒或盐粒等颗粒悬浮在大气中,
形成雾霾。A项、硝酸与氨气反应生成硝酸铵固体,故A正确;B项、反应②是五氧化二氮与水反
应生成硝酸,反应中元素没有化合价变化,属于非氧化还原反应,故 B正确;C项、硝酸与氨气反
应生成硝酸铵固体,氨气是反应物,不是催化剂,故C错误;D项、铵盐是氮肥,过度施用氮肥,
铵盐会释放出氨气,故D正确。故选C。
8.溶液中常见离子的检验及结论正确的是 选项 X Y Z
A.若加入淀粉溶液,溶液显蓝色,则一定有Iˉ
A 无水硫酸铜 氯气 饱和食盐水
B.若加入AgNO 溶液有白色沉淀产生,则一定有Clˉ
3
B 氢氧化钠固体 氨气 水
C.若加入Ba(NO ) 溶液,有白色沉淀产生,则一定有SO
3 2
C 氯化钙 二氧化硫 氢氧化钠溶液
D.若加入NaOH溶液,微热,产生使润湿红色石蕊试纸变蓝的气体,则一定有NH
D 碱石灰 一氧化氮 氢氧化钠溶液
【答案】D
【解析】A.碘离子遇到淀粉不变色,若加入淀粉溶液,溶液显蓝色,则一定有碘单质,故 A 【答案】C
【解析】A.Cl 尾气吸收应该用氢氧化钠溶液,不能用饱和食盐水,A错误;B.氨气不能用
错误;B.碳酸银也是白色沉淀,加入AgNO 溶液有白色沉淀,不一定有Cl-,应该加稀硝酸排除 2
3
向上排空气法收集,B错误;C.氯化钙可用于干燥二氧化硫气体,二氧化硫可用向上排空气法收
干扰离子,故B错误;C.溶液中如果含有碳酸根离子等会产生干扰,先加盐酸,无白色沉淀产生,
集,最后用氢氧化钠溶液吸收尾气,C正确;D.一氧化氮气体与氧气反应,不能用排空气法收集,
再加Ba(NO ) 溶液,有白色沉淀产生,则一定有SO,故C错误;D.铵根离子与碱反应生成氨气,
3 2
D错误;故答案选C。
氨气能使湿润红色石蕊试纸变蓝,若加入NaOH溶液,微热,产生使湿润红色石蕊试纸变蓝的气体,
11.如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内
则一定有NH,故D正确;故选D。
液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过
9.化学与生产、生活和社会密切相关,下列有关说法正确的是
A.英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO 多次重复后,试管内完全被充满,原来试管中盛装的气体是
2
B.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,
令砒烟上飞着覆器,遂凝结累然下垂如乳”涉及的操作方法是升华
C.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是发生雾霾天气的主要原因,这些颗
粒物扩散在空气中都会形成胶体A.可能是N 和NO 的混合气体 B.一定是NO 气体 14.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
2 2 2
C.一定是NO与NO 的混合气体 D.可能是NO 一种气体
2 2
【答案】D
【解析】试管内气体为红棕色,故一定含有NO ,也可能含有NO,因为2NO+O ===2NO ,生
2 2 2
成的 NO 又可与水反应,使液面上升,NO 、O 与水反应的总反应的化学方程式为 ① ② ③
2 2 2
4NO +O +2H O===4HNO ,故当试管内气体为NO 或NO 与NO的混合物时,通入适量O ,最终 A.由①中的红棕色气体,推断产生的气体一定是混合气体
2 2 2 3 2 2 2
试管内可完全充满液体。由于N 不溶于水,故不可能含有N。由此可知答案为C。 B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
2 2
12.下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是 C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
选项 物质(括号内为杂质) 除杂试剂 D.③的气体产物中检测出CO,由此说明木炭一定与浓硝酸发生了反应
2
A FeCl 2 溶液(FeCl 3 ) Fe粉 【答案】D
B NaCl溶液(MgCl ) NaOH溶液、稀盐酸
2 【解析】图①中产生的红棕色气体应为NO 和O 的混合气体,原因是灼热的碎玻璃促进了硝酸
2 2
C Cl(HCl) HO、浓硫酸
2 2
的分解,A项正确;图②中的气体可能是红热的木炭促进了硝酸分解生成的,也可能是木炭与浓硝
D NO(NO ) HO、无水CaCl
2 2 2
酸反应生成的,B项正确;图③中,由于红热的木炭没有插入浓硝酸中,但仍有红棕色气体产生,
【答案】B
说明浓硝酸具有挥发性,生成的红棕色气体NO 为还原产物,C项正确;图③中气体产物中的二氧
【解析】A项,主反应Fe+2FeCl =3FeCl 属于氧化还原反应,A不选;B项,加入足量NaOH 2
3 2
化碳也可能是硝酸分解产生的O 与红热的木炭反应生成的,D项错误。
溶液发生复分解反应生成Mg(OH) 沉淀,过滤后用盐酸中和过量的NaOH得到不含MgCl 的NaCl 2
2 2
15.将NO 、NH 和O 的混合气体28L通过稀HSO 后,溶液质量增加 42g,气体体积缩小为
溶液,B正确;C项,除去Cl 中的HCl,可将混合气体通过饱和食盐水,然后再用浓硫酸干燥,C 2 3 2 2 4
2
4.48L。将带火星的木条插入其中,木条不复燃。则原混合气体的平均相对分子质量为(气体体
不选;D项,主反应3NO +H O=2HNO +NO属于氧化还原反应,D不选。
2 2 3
积都是在标准状况下测定)
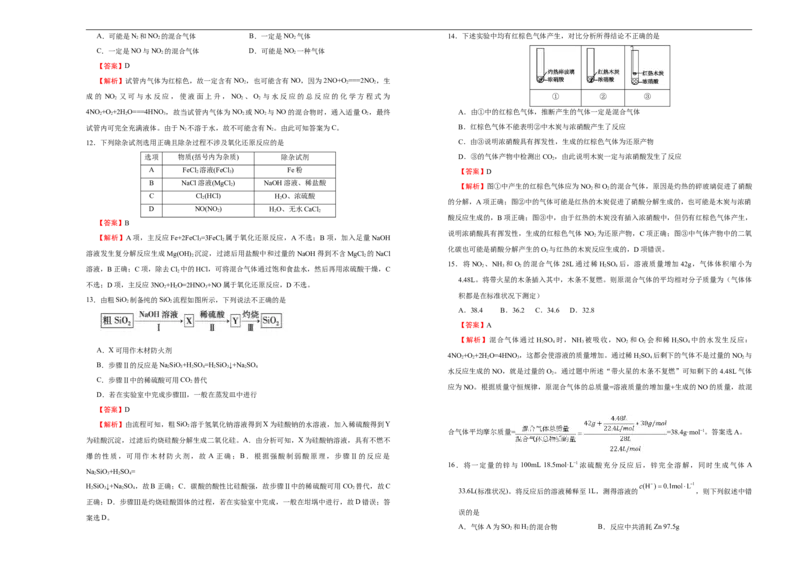
13.由粗SiO 制备纯的SiO 流程如图所示,下列说法不正确的是
2 2
A.38.4 B.36.2 C.34.6 D.32.8
【答案】A
【解析】混合气体通过 HSO 时,NH 被吸收,NO 和O 会和稀 HSO 中的水发生反应:
2 4 3 2 2 2 4
A.X可用作木材防火剂
4NO +O +2H O=4HNO ,这都会使溶液的质量增加。通过稀HSO 后剩下的气体不是过量的NO 与
2 2 2 3 2 4 2
B.步骤Ⅱ的反应是NaSiO+H SO =H SiO↓+Na SO
2 3 2 4 2 3 2 4
水反应生成的NO,就是过量的O 。通过题中所述“带火星的木条不复燃”可知剩下的4.48L气体
2
C.步骤Ⅱ中的稀硫酸可用CO 替代
2
应为NO。根据质量守恒规律,原混合气体的总质量=溶液质量的增加量+生成的NO的质量,故混
D.若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行
【答案】D
【解析】由流程可知,粗SiO 溶于氢氧化钠溶液得到X为硅酸钠的水溶液,加入稀硫酸得到Y
2
合气体平均摩尔质量= =38.4g·mol−1。答案选A。
为硅酸沉淀,过滤后灼烧硅酸分解生成二氧化硅。A.由分析可知,X为硅酸钠溶液,具有不燃不
爆的性质,可用作木材防火剂,故 A 正确;B.根据强酸制弱酸原理,步骤Ⅱ的反应是
16.将一定量的锌与 100mL 18.5mol·L−1浓硫酸充分反应后,锌完全溶解,同时生成气体 A
NaSiO+H SO =
2 3 2 4
HSiO↓+Na SO ,故B正确;C.碳酸的酸性比硅酸强,故步骤Ⅱ中的稀硫酸可用CO 替代,故C
2 3 2 4 2 33.6L(标准状况)。将反应后的溶液稀释至1L,测得溶液的 ,则下列叙述中错
正确;D.步骤Ⅲ是灼烧硅酸固体的过程,若在实验室中完成,一般在坩埚中进行,故D错误;答
误的是
案选D。
A.气体A为SO 和H 的混合物 B.反应中共消耗Zn 97.5g
2 2C.气体A中SO 和H 的体积比为4∶1 D.反应中共转移3mol电子
2 2
【答案】C
【解析】气体的物质的量为1.5mol,浓硫酸中n(H SO )=18.5mol/L×0.1L=1.85mol,浓硫酸中
2 4
n(H+)=2n(HSO )=1.85mol×2=3.7mol,反应后溶液中c(H+)=0.1mol/L,则参加反应n (H+)=3.7mol-0.1
2 4
mol/L×1L=3.6mol,Zn+2H SO (浓)=ZnSO +SO↑+2H O、Zn+H SO =ZnSO +H ↑,设二氧化硫的物
2 4 4 2 2 2 4 4 2
质的量为 x,氢气的物质的量为 y,根据 H 原子守恒、气体的物质的量列方程,x+y=1.5,
4x+2y=3.6;解得x=0.3,y=1.2;所以二氧化硫、氢气的物质的量分别是0.3mol、1.2mol。A.通过
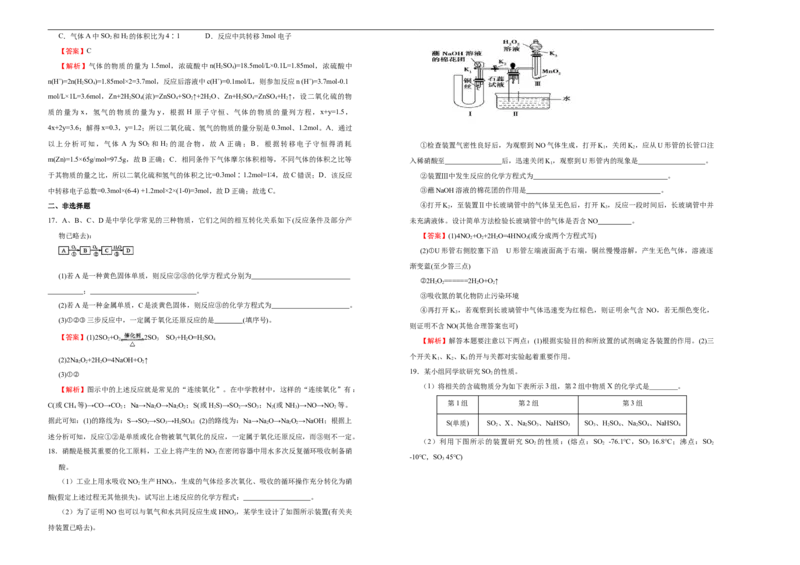
以上分析可知,气体 A 为 SO 2 和 H 2 的混合物,故 A 正确;B.根据转移电子守恒得消耗 ①检查装置气密性良好后,为观察到NO气体生成,打开K 1 ,关闭K 2 ,应从U形管的长管口注
m(Zn)=1.5×65g/mol=97.5g,故B正确;C.相同条件下气体摩尔体积相等,不同气体的体积之比等 入稀硝酸至 后,迅速关闭K,观察到U形管内的现象是 。
1
于其物质的量之比,所以二氧化硫和氢气的体积之比=0.3mol∶1.2mol=1∶4,故C错误;D.该反应 ②装置Ⅲ中发生反应的化学方程式为 。
中转移电子总数=0.3mol×(6-4) +1.2mol×2×(1-0)=3mol,故D正确;故选C。 ③蘸NaOH溶液的棉花团的作用是 。
二、非选择题 ④打开K,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K,反应一段时间后,长玻璃管中并
2 3
17.A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(反应条件及部分产 未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
物已略去): 【答案】(1)4NO +O +2H O=4HNO (或分成两个方程式写)
2 2 2 3
(2)①U形管右侧胶塞下沿 U形管左端液面高于右端,铜丝慢慢溶解,产生无色气体,溶液逐
渐变蓝(至少答三点)
(1)若A是一种黄色固体单质,则反应②③的化学方程式分别为
②2H O======2HO+O↑
2 2 2 2
; 。
③吸收氮的氧化物防止污染环境
(2)若A是一种金属单质,C是淡黄色固体,则反应③的化学方程式为 。
④再打开K ,若观察到长玻璃管中气体迅速变为红棕色,则证明余气含 NO,若无颜色变化,
3
(3)①②③三步反应中,一定属于氧化还原反应的是 (填序号)。
则证明不含NO(其他合理答案也可)
【答案】(1)2SO +O 2SO SO +H O=HSO
2 2 3 3 2 2 4 【解析】解答本题要注意以下两点:(1)根据实验目的和所放置的试剂确定各装置的作用。(2)三
个开关K、K、K 的开与关都对实验起着重要作用。
(2)2Na O+2H O=4NaOH+O ↑ 1 2 3
2 2 2 2
19.某小组同学欲研究SO 的性质。
(3)①② 2
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是________。
【解析】图示中的上述反应就是常见的“连续氧化”。在中学教材中,这样的“连续氧化”有:
C(或CH 等)→CO→CO ;Na→Na O→Na O ;S(或HS)→SO →SO ;N(或NH )→NO→NO 等。 第1组 第2组 第3组
4 2 2 2 2 2 2 3 2 3 2
据此可知:(1)的路线为:S→SO 2 →SO 3 →H 2 SO 4 ;(2)的路线为:Na→Na 2 O→Na 2 O 2 →NaOH;根据上 S(单质) SO 2 、X、Na 2 SO 3 、NaHSO 3 SO 3 、H 2 SO 4 、Na 2 SO 4 、NaHSO 4
述分析可知,反应①②是单质或化合物被氧气氧化的反应,一定属于氧化还原反应,而③则不一定。
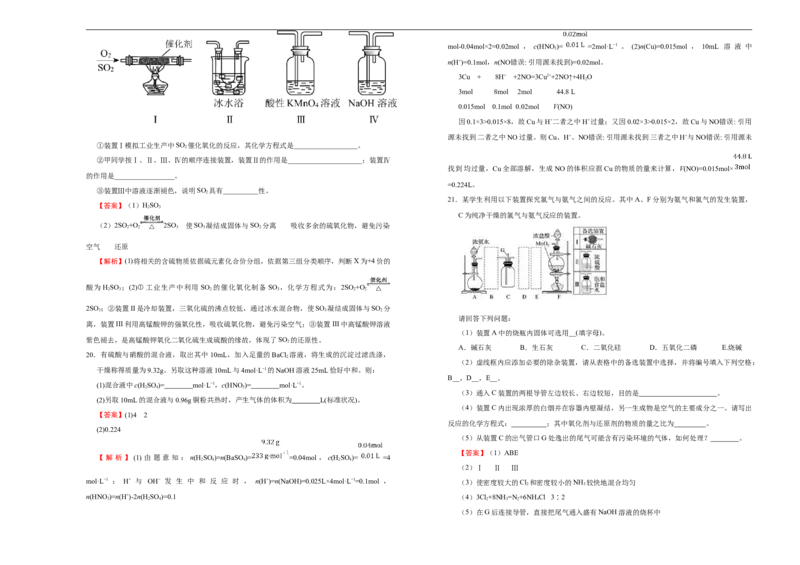
(2)利用下图所示的装置研究 SO 的性质:(熔点:SO -76.1℃,SO 16.8℃;沸点:SO
2 2 3 2
18.硝酸是极其重要的化工原料,工业上将产生的NO 在密闭容器中用水多次反复循环吸收制备硝
2
-10℃,SO 45℃)
3
酸。
(1)工业上用水吸收NO 生产HNO ,生成的气体经多次氧化、吸收的循环操作充分转化为硝
2 3
酸(假定上述过程无其他损失)。试写出上述反应的化学方程式: 。
(2)为了证明NO也可以与氧气和水共同反应生成HNO ,某学生设计了如图所示装置(有关夹
3
持装置已略去)。mol-0.04mol×2=0.02mol , c(HNO)= =2mol·L−1 。 (2)n(Cu)=0.015mol , 10mL 溶 液 中
3
n(H+)=0.1mol,n(NO错误: 引用源未找到)=0.02mol。
3Cu + 8H+ +2NO=3Cu2++2NO↑+4HO
2
3mol 8mol 2mol 44.8 L
0.015mol 0.1mol 0.02mol V(NO)
因0.1×3>0.015×8,故Cu与H+二者之中H+过量;又因0.02×3>0.015×2,故Cu与NO错误: 引用
源未找到二者之中NO过量。则Cu、H+、NO错误: 引用源未找到三者之中H+与NO错误: 引用源未
①装置Ⅰ模拟工业生产中SO 催化氧化的反应,其化学方程式是__________________。
2
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是_____________________;装置Ⅳ
找到均过量,Cu全部溶解,生成NO的体积应据Cu的物质的量来计算,V(NO)=0.015mol×
的作用是_________________。
=0.224L。
③装置Ⅲ中溶液逐渐褪色,说明SO 具有__________性。
2
21.某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,
【答案】(1)HSO
2 3
C为纯净干燥的氯气与氨气反应的装置。
(2)2SO +O 2SO 使SO 凝结成固体与SO 分离 吸收多余的硫氧化物,避免污染
2 2 3 3 2
空气 还原
【解析】(1)将相关的含硫物质依据硫元素化合价分组,依据第三组分类顺序,判断X为+4价的
酸为 HSO ;(2)①工业生产中利用 SO 的催化氧化制备 SO ,化学方程式为:2SO +O
2 3 2 3 2 2
2SO ;②装置II是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO 凝结成固体与SO 分
3 3 2
请回答下列问题:
离,装置III利用高锰酸钾的强氧化性,吸收硫氧化物,避免污染空气;③装置III中高锰酸钾溶液
(1)装置A中的烧瓶内固体可选用__(填字母)。
紫色褪去,是高锰酸钾氧化二氧化硫生成硫酸的缘故,体现了SO 的还原性。
2
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
20.有硫酸与硝酸的混合液,取出其中10mL,加入足量的BaCl 溶液,将生成的沉淀过滤洗涤,
2
(2)虚线框内应添加必要的除杂装置,请从表格中的备选装置中选择,并将编号填入下列空格:
干燥称得质量为9.32g。另取这种溶液10mL与4mol·L−1的NaOH溶液25mL恰好中和。则:
B__,D__,E__。
(1)混合液中c(H SO )= mol·L−1,c(HNO)= mol·L−1。
2 4 3
(3)通入C装置的两根导管左边较长、右边较短,目的是 。
(2)另取10mL的混合液与0.96g铜粉共热时,产生气体的体积为 L(标准状况)。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出
【答案】(1)4 2
反应的化学方程式: ;其中氧化剂与还原剂的物质的量之比为 。
(2)0.224
(5)从装置C的出气管口G处逸出的尾气可能含有污染环境的气体,如何处理? 。
【答案】(1)ABE
【 解 析 】 (1) 由 题 意 知 : n(H SO )=n(BaSO)= =0.04mol , c(H SO )= =4
2 4 4 2 4
(2)Ⅰ Ⅱ Ⅲ
mol·L−1 ; H+ 与 OH− 发 生 中 和 反 应 时 , n(H+)=n(NaOH)=0.025L×4mol·L−1=0.1mol , (3)使密度较大的Cl 和密度较小的NH 较快地混合均匀
2 3
n(HNO)=n(H+)-2n(H SO )=0.1 (4)3Cl+8NH =N +6NH Cl 3∶2
3 2 4 2 3 2 4
(5)在G后连接导管,直接把尾气通入盛有NaOH溶液的烧杯中【解析】探究氯气和氨气的反应,则首先要制得氨气和氯气,装置A用于制取氨气,制得的氨
气中含有水蒸气,需要除去,干燥氨气选用碱石灰,装置F制取氯气,氯气中含有HCl和HO,需
2
要除去和干燥,利用饱和食盐水除去HCl,利用浓硫酸除去HO。在C中发生氨气与氯气的反应。
2
(1)装置A用于制取氨气,碱石灰、生石灰、烧碱遇水都会放热,使氨水温度升高,导致氨气逸出,
可以选ABE;(2)氨气是碱性气体,要用碱性干燥剂碱石灰干燥;由于浓盐酸有挥发性,所以制取
的Cl 含有杂质HCl,应该先用饱和NaCl溶液除去其中的HCl,再用浓硫酸干燥,所以B选Ⅰ装置,
2
D选Ⅱ装置,E选Ⅲ装置,经过除杂干燥后在装置C中发生反应;(3)氨气的密度比Cl 的密度小,
2
通入C装置的两根导管左边较长、右边较短,就可以使密度较大的Cl 和密度较小的NH 较快地混
2 3
合均匀;(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。则
白色固体是NH Cl,另一生成物是N ,根据得失电子守恒、原子守恒可得该反应的化学方程式是
4 2
3Cl+8NH =N +6NH Cl;在该反应中氧化剂是Cl ,还原剂是NH ,每有3mol Cl 发生反应,消耗
2 3 2 4 2 3 2
8mol NH ,其中有2mol NH 做还原剂。故氧化剂与还原剂的物质的量之比为3∶2;(5)从装置C
3 3
的出气管口G处逸出的尾气可能含有 Cl 、NH ,Cl 能够与NaOH溶液发生反应,NH 易溶于
2 3 2 3
NaOH溶液,则应该将尾气通入到盛有NaOH溶液的烧杯中。