文档内容
高三化学
本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。时间75分钟。
相对原子质量:H-1 C-12 N-14 O-16 Na-23 K-39 Fe-56 Mn-55 Cu-64 I-127
第Ⅰ卷
一、单选题:本大题共14小题,共42分。
1.科教兴国,“可上九天揽月,可下五洋捉鳖”。下列说法正确的是
A. “天舟六号”为中国空间站送去推进剂Xe气,Xe是第ⅠA族元素
B. 火星全球影像彩图显示了火星表土颜色,表土中赤铁矿主要成分为Fe
C. 创造了可控核聚变运行纪录的“人造太阳”,其原料中的2H与3H互为同位素
D. “深地一号”为进军万米深度提供核心装备,制造钻头用的金刚石为金属晶体
2.下列叙述正确的是( )
A. Mg分别与空气和氧气反应,生成的产物相同
B. SO 分别与HO和HS反应,反应的类型相同
2 2 2
C. NaO 分别与HO和CO 反应,生成的气体相同
2 2 2 2
D. 浓HSO 分别与Cu和C反应,生成的酸性气体相同
2 4
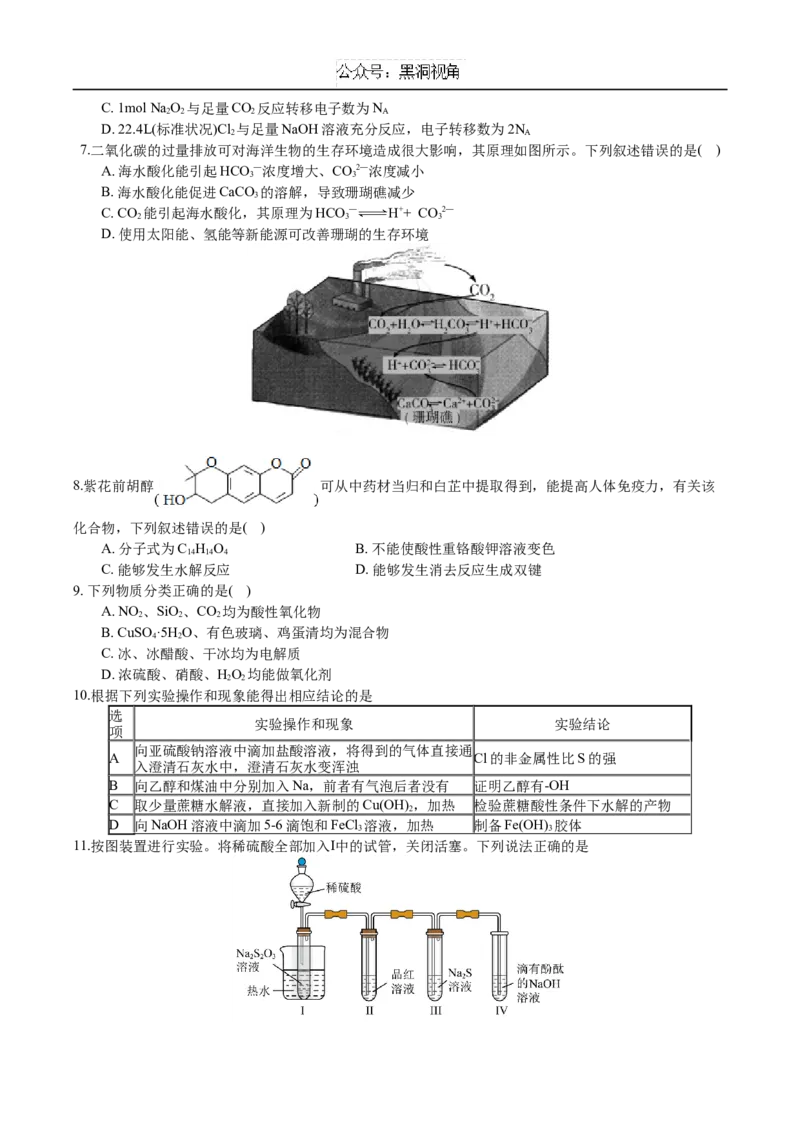
3.下列装置可以用于相应实验的是( )
A. 制备CO B. 分离乙醇和乙酸
2
C. 验证SO 酸性 D. 测量O 体积
2 2
4.一种由短周期主族元素组成的化合物 如图所示 ,具有良好的储氢性能,其中元素W、X、Y、Z的原子
序数依次增大、且总和为24。下列有关叙述错误的是( )
A. 该化合物中,W、X、Y之间均为共价键
B. Z的单质既能与水反应,也可与甲醇反应
C. Y的最高价氧化物的水化物为强酸
D. X的氟化物XF 中原子均为8电子稳定结构
3
5.下列过程中的化学反应对应的离子方程式正确的是
A. 用FeCl 溶液“腐蚀”覆铜板:Cu+2Fe3+=2Fe2++Cu2+
3
B. AgNO 溶液中滴加过量稀氨水:Ag++OH—=AgOH↓
3
C. 硫酸铝溶液中滴加少量氢氧化钾溶液:Al3++OH—=[Al(OH) ] —
4
D. 用小苏打可以缓解胃酸过多引起的不适:CO2—+2H+=H O+CO↑
3 2 2
6.用N 表示阿伏加德罗常数。下列说法正确的是
A
A. 1molN H 含有π键的数目为N
2 4 A
B. 1L0.1 mol·L-1CHCOOH溶液含CHCOO—的数目为0.1N
3 3 AC. 1mol Na O 与足量CO 反应转移电子数为N
2 2 2 A
D. 22.4L(标准状况)Cl 与足量NaOH溶液充分反应,电子转移数为2N
2 A
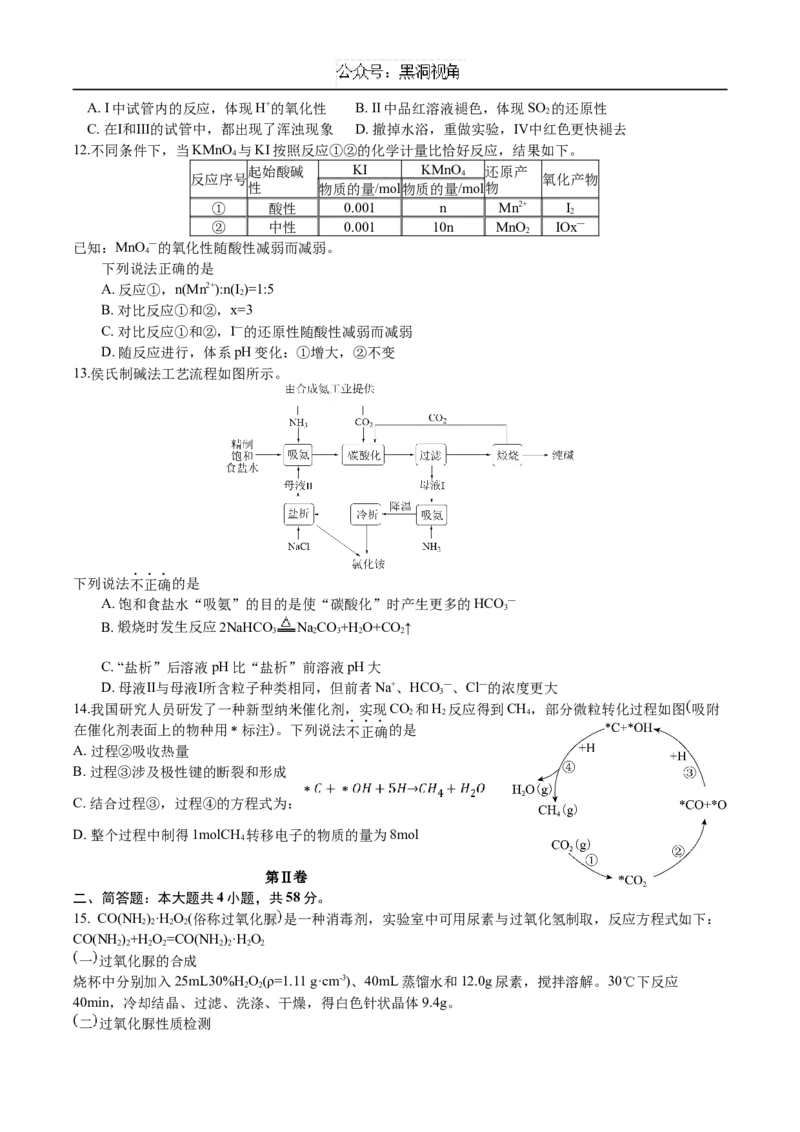
7.二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图所示。下列叙述错误的是( )
A. 海水酸化能引起HCO —浓度增大、CO2—浓度减小
3 3
B. 海水酸化能促进CaCO 的溶解,导致珊瑚礁减少
3
C. CO 能引起海水酸化,其原理为HCO — H++ CO2—
2 3 3
D. 使用太阳能、氢能等新能源可改善珊瑚的生存环境
8.紫花前胡醇 可从中药材当归和白芷中提取得到,能提高人体免疫力,有关该
化合物,下列叙述错误的是( )
A. 分子式为C H O B. 不能使酸性重铬酸钾溶液变色
14 14 4
C. 能够发生水解反应 D. 能够发生消去反应生成双键
9. 下列物质分类正确的是( )
A. NO 、SiO、CO 均为酸性氧化物
2 2 2
B. CuSO ·5H O、有色玻璃、鸡蛋清均为混合物
4 2
C. 冰、冰醋酸、干冰均为电解质
D. 浓硫酸、硝酸、HO 均能做氧化剂
2 2
10.根据下列实验操作和现象能得出相应结论的是
选
实验操作和现象 实验结论
项
向亚硫酸钠溶液中滴加盐酸溶液,将得到的气体直接通
A Cl的非金属性比S的强
入澄清石灰水中,澄清石灰水变浑浊
B 向乙醇和煤油中分别加入Na,前者有气泡后者没有 证明乙醇有-OH
C 取少量蔗糖水解液,直接加入新制的Cu(OH) ,加热 检验蔗糖酸性条件下水解的产物
2
D 向NaOH溶液中滴加5-6滴饱和FeCl 溶液,加热 制备Fe(OH) 胶体
3 3
11.按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是A. Ⅰ中试管内的反应,体现H+的氧化性 B. Ⅱ中品红溶液褪色,体现SO 的还原性
2
C. 在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D. 撤掉水浴,重做实验,Ⅳ中红色更快褪去
12.不同条件下,当KMnO 与KI按照反应①②的化学计量比恰好反应,结果如下。
4
起始酸碱 KI KMnO 还原产
反应序号 4 氧化产物
性 物质的量/mol物质的量/mol物
① 酸性 0.001 n Mn2+ I
2
② 中性 0.001 10n MnO IOx—
2
已知:MnO —的氧化性随酸性减弱而减弱。
4
下列说法正确的是
A. 反应①,n(Mn2+):n(I )=1:5
2
B. 对比反应①和②,x=3
C. 对比反应①和②,I—的还原性随酸性减弱而减弱
D. 随反应进行,体系pH变化:①增大,②不变
13.侯氏制碱法工艺流程如图所示。
下列说法不正确的是
A. 饱和食盐水“吸氨”的目的是使“碳酸化”时产生更多的HCO —
3
B. 煅烧时发生反应2NaHCO NaCO+H O+CO↑
3 2 3 2 2
C. “盐析”后溶液pH比“盐析”前溶液pH大
D. 母液Ⅱ与母液Ⅰ所含粒子种类相同,但前者Na+、HCO —、Cl—的浓度更大
3
14.我国研究人员研发了一种新型纳米催化剂,实现CO 和H 反应得到CH,部分微粒转化过程如图 吸附
2 2 4
在催化剂表面上的物种用 标注 。下列说法不正确的是
A. 过程②吸收热量
B. 过程③涉及极性键的断裂和形成
C. 结合过程③,过程④的方程式为:
D. 整个过程中制得1molCH 转移电子的物质的量为8mol
4
第Ⅱ卷
二、简答题:本大题共4小题,共58分。
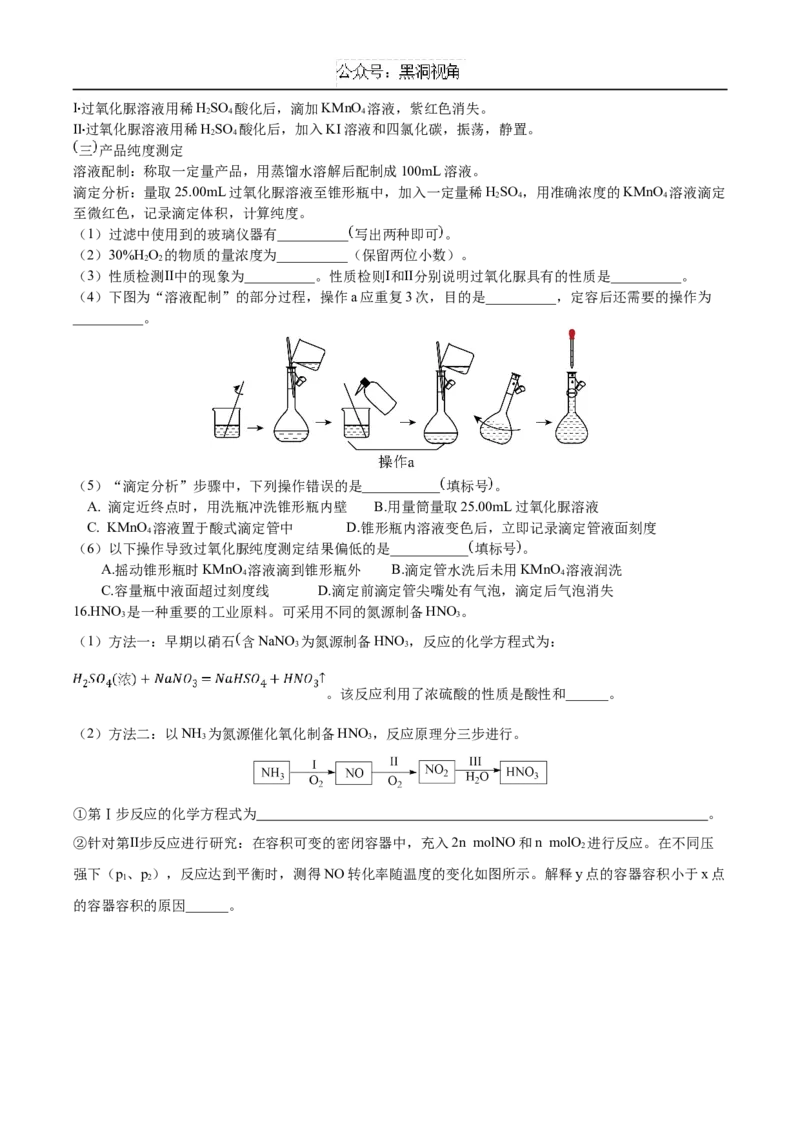
15. CO(NH)·H O(俗称过氧化脲 是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:
2 2 2 2
CO(NH)+H O=CO(NH )·H O
2 2 2 2 2 2 2 2
一 过氧化脲的合成
烧杯中分别加入25mL30%H O(ρ=1.11 g·cm-3)、40mL蒸馏水和12.0g尿素,搅拌溶解。30℃下反应
2 2
40min,冷却结晶、过滤、洗涤、干燥,得白色针状晶体9.4g。
二 过氧化脲性质检测Ⅰ过氧化脲溶液用稀HSO 酸化后,滴加KMnO 溶液,紫红色消失。
2 4 4
Ⅱ过氧化脲溶液用稀HSO 酸化后,加入KI溶液和四氯化碳,振荡,静置。
2 4
三 产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成100mL溶液。
滴定分析:量取25.00mL过氧化脲溶液至锥形瓶中,加入一定量稀HSO ,用准确浓度的KMnO 溶液滴定
2 4 4
至微红色,记录滴定体积,计算纯度。
(1)过滤中使用到的玻璃仪器有__________ 写出两种即可 。
(2)30%H O 的物质的量浓度为__________(保留两位小数)。
2 2
(3)性质检测Ⅱ中的现象为__________。性质检则Ⅰ和Ⅱ分别说明过氧化脲具有的性质是__________。
(4)下图为“溶液配制”的部分过程,操作a应重复3次,目的是__________,定容后还需要的操作为
__________。
(5)“滴定分析”步骤中,下列操作错误的是___________ 填标号 。
A. 滴定近终点时,用洗瓶冲洗锥形瓶内壁 B.用量筒量取25.00mL过氧化脲溶液
C. KMnO 溶液置于酸式滴定管中 D.锥形瓶内溶液变色后,立即记录滴定管液面刻度
4
(6)以下操作导致过氧化脲纯度测定结果偏低的是___________ 填标号 。
A.摇动锥形瓶时KMnO 溶液滴到锥形瓶外 B.滴定管水洗后未用KMnO 溶液润洗
4 4
C.容量瓶中液面超过刻度线 D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
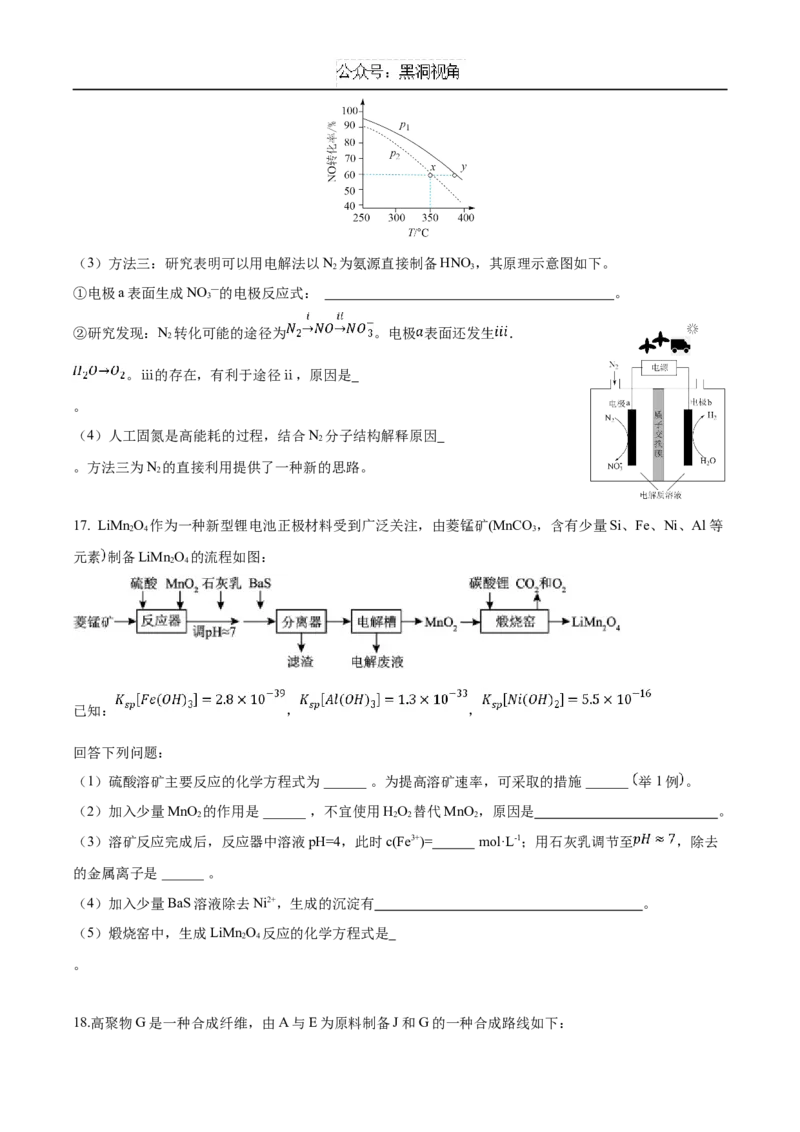
16.HNO 是一种重要的工业原料。可采用不同的氮源制备HNO。
3 3
(1)方法一:早期以硝石 含NaNO 为氮源制备HNO,反应的化学方程式为:
3 3
。该反应利用了浓硫酸的性质是酸性和______。
(2)方法二:以NH 为氮源催化氧化制备HNO,反应原理分三步进行。
3 3
①第Ⅰ步反应的化学方程式为 。
②针对第Ⅱ步反应进行研究:在容积可变的密闭容器中,充入2n molNO和n molO 进行反应。在不同压
2
强下(p、p),反应达到平衡时,测得NO转化率随温度的变化如图所示。解释y点的容器容积小于x点
1 2
的容器容积的原因______。(3)方法三:研究表明可以用电解法以N 为氨源直接制备HNO,其原理示意图如下。
2 3
①电极a表面生成NO —的电极反应式: 。
3
②研究发现:N 转化可能的途径为 。电极 表面还发生 .
2
。ⅲ的存在,有利于途径ⅱ,原因是
。
(4)人工固氮是高能耗的过程,结合N 分子结构解释原因
2
。方法三为N 的直接利用提供了一种新的思路。
2
17. LiMn O 作为一种新型锂电池正极材料受到广泛关注,由菱锰矿(MnCO ,含有少量Si、Fe、Ni、Al等
2 4 3
元素 制备LiMn O 的流程如图:
2 4
已知: , ,
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为 ______ 。为提高溶矿速率,可采取的措施 ______ 举1例 。
(2)加入少量MnO 的作用是 ______ ,不宜使用HO 替代MnO ,原因是 。
2 2 2 2
(3)溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)= mol·L-1;用石灰乳调节至 ,除去
的金属离子是 ______ 。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有 。
(5)煅烧窑中,生成LiMn O 反应的化学方程式是
2 4
。
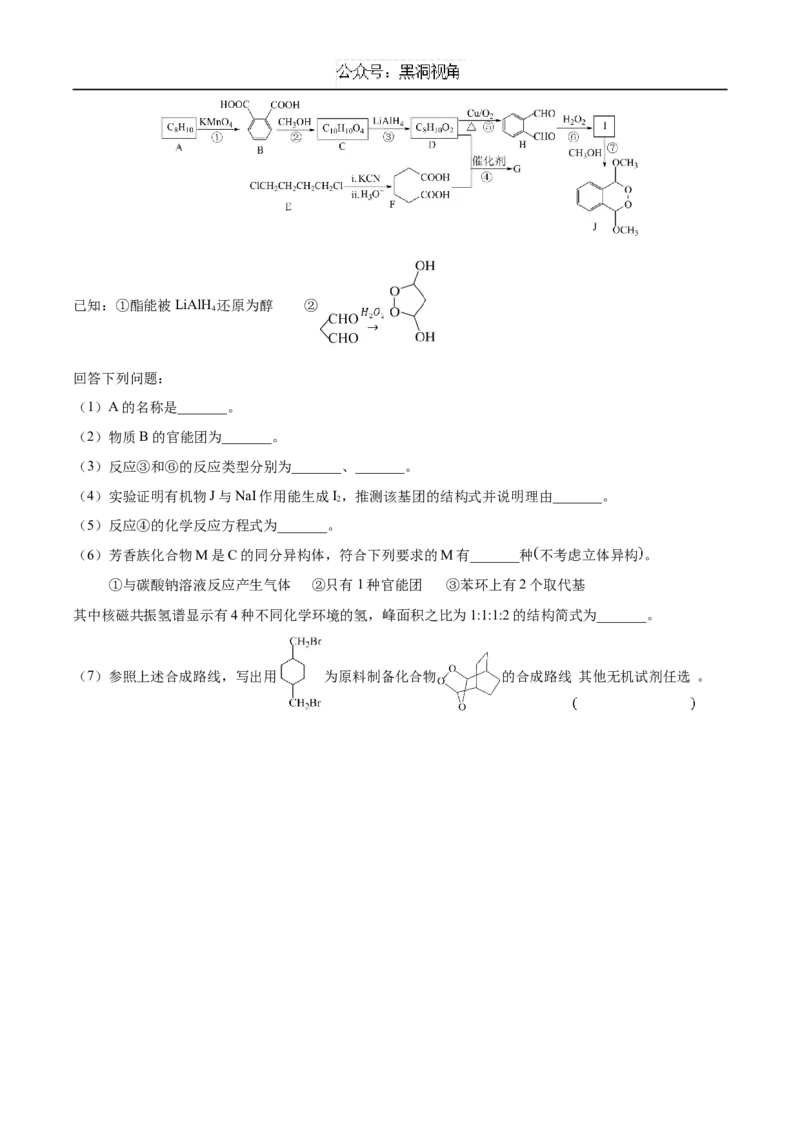
18.高聚物G是一种合成纤维,由A与E为原料制备J和G的一种合成路线如下:已知:①酯能被LiAlH 还原为醇 ②
4
回答下列问题:
(1)A的名称是_______。
(2)物质B的官能团为_______。
(3)反应③和⑥的反应类型分别为_______、_______。
(4)实验证明有机物J与NaI作用能生成I,推测该基团的结构式并说明理由_______。
2
(5)反应④的化学反应方程式为_______。
(6)芳香族化合物M是C的同分异构体,符合下列要求的M有_______种 不考虑立体异构 。
①与碳酸钠溶液反应产生气体 ②只有1种官能团 ③苯环上有2个取代基
其中核磁共振氢谱显示有4种不同化学环境的氢,峰面积之比为1:1:1:2的结构简式为_______。
(7)参照上述合成路线,写出用 为原料制备化合物 的合成路线 其他无机试剂任选 。