文档内容
晋江侨声中学、南安侨光中学 2025 秋季高一年两校联考二
化学试卷
(考试时间:90 分钟 满分:100 分 )
可能用到的相对原子质量:H-1;C-12;O-16;Na-23;N-14;
一、单选题(每题3分,共42分)
1.我国探月工程取得重大进展。可控核聚变的原料3He是一种安全高效而又清洁无污染的
物质,据统计,月球土壤的3He含量可达500万吨。关于3He的叙述正确的是( )
A.3He原子比4He原子少一个核外电子 B.3He和4He两种核素互为同位素
C.核聚变时,原子发生的是化学反应 D.在3He中存在:质子数=中子数=核外电子数
2.现代生活需要人们有一定的科学素养,下列有关化学的科学常识不正确的是
A. 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰
B. 钠具有强还原性,常用于冶炼金属,如钠能将熔融四氯化钛中的钛置换出来
C. 连花清瘟胶囊成分中的石膏CaSO ·2H O是纯净物
4 2
D. 碳酸氢钠在医疗上是一种治疗胃酸过多的药品
3.反应NH ClNaNO NaClN 2H O放热且产生气体,可用于冬天石油开采。
4 2 2 2
下列表示反应中相关微粒的化学用语正确的是
A. 溶于水可形成胶体 B.NaNO 中N的化合价:+5
2
N 4
C.Na+的结构示意图: D.NaNO 的电离方程式为NaNO Na NO
2 2 2
4.11P15CuSO 24H O5Cu P6H PO 15H SO 反应中,被氧化的磷原子与被还原的
4 2 3 3 4 2 4
磷原子个数比是( )
A.6:5 B.5:6 C.11:5 D.11:6
5.下列各组关于强电解质、弱电解质、非电解质的分类,完全正确的是( )
选项
强电解质
3 2 4
弱电解质 ( )
3 2 3 4 3
非电解质 酒精 蔗糖
4 2
A. B. C . D.
6. 是优良的水处理剂 ,一种制备方法是将 、 、 混合共熔,反应为
2 4 2 3 3
+3 +4 =2 +3 +2 。关于该反应的说法不正确的( )
2 3 3 2 4 2 2
A . 铁 元素 被 氧 化, 氮 元 素被 还 原 B. 氧 化 性: >
3 2 4
C. 每生成1 ,转移6 D. 具 有 氧化杀 菌 作 用
2 4 2 4
−
7.下列反应 的 离 子 方 程式书写正 确 的 是
A. 向少量铜粉中滴加稀硫酸:Cu2H Cu2 H
2
B. 少量Ca HCO 溶液与过量NaOH溶液反应:
3 2
2HCO 2OH Ca2 CaCO CO2 2H O
3 3 3 2
C. 过量CO 与稀NaOH溶液反应:2OH CO CO2
2 2 3
D. Mg与AgNO 溶液反应:MgAg Mg2 Ag
3
8.下列反应中,水只做还原剂的是( )
A. 氧化钠与水的反应: + =2
2 2
B. 钠与水的反应:2 + 2 = 2 +
2 2
↑
C.电解水:2 +
2 2 2
↑ ↑
D. 氟单质与水的反应:2 +2 =4 +
2 2 2
9.已知 、 、 、 、 五 种元素 是 周期 表 中原 子序数依次增大的前18号元素, 是原子序
数最小的 元 素; 元 素原 子最外层电子数是内层电子总数的2倍: 元素原子最外 层电子数
比其次外层电子数 多4个; 元素原子最外层有1个电子,其阳离 子与 的阴离子原子核外
电子总数相同;元素原子 层 和 层电子总数比 层电子数多一个。下列说 法不正确的是( )
A. 与 可形成 不止一种化 合物 B. 的一 种单质可导电
C. 的 氧化物不与酸反应 D. 的一种氧化物可用作自来水消毒剂
10. 下列各组离子在指定溶液中一定能大量共 存的
A. 澄清透明的溶液:K+、Cu2+、SO 2、Cl-
4
B. 含大量SO 2的澄清溶液:Mg2+、Ca2+、Cl-、NO
4 3
C. 强碱性溶液:Na+、Mg2+、NO 、SO 2
3 4
D. 强酸性溶液中:Na+、K+、ClO-、OH-
11.下列实验方案设计、现象和结论相符的一组是( )选项 方案设计、现象 结论
未知溶液中一定
A 向未知溶液中加入硝酸酸化的BaCl 溶液,有白色沉淀生成
2 含有SO2
4
将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取待 该溶液一定含有
B
测液,置于煤气灯的火焰上进行灼烧,火焰呈黄色 钠元素
取少量晶体于试管中,若加热时试管口出现小水珠,冷却后加 该晶体为
C
入足量盐酸,产生能使澄清石灰水变浑浊的无色无味的气体 NaHCO 试剂
3
向未知溶液中加入稀盐酸酸化后,再加入AgNO 溶液,有白色 未知溶液中一定
D 3
沉淀生成 含有Cl
A..A B.B C.C D.D
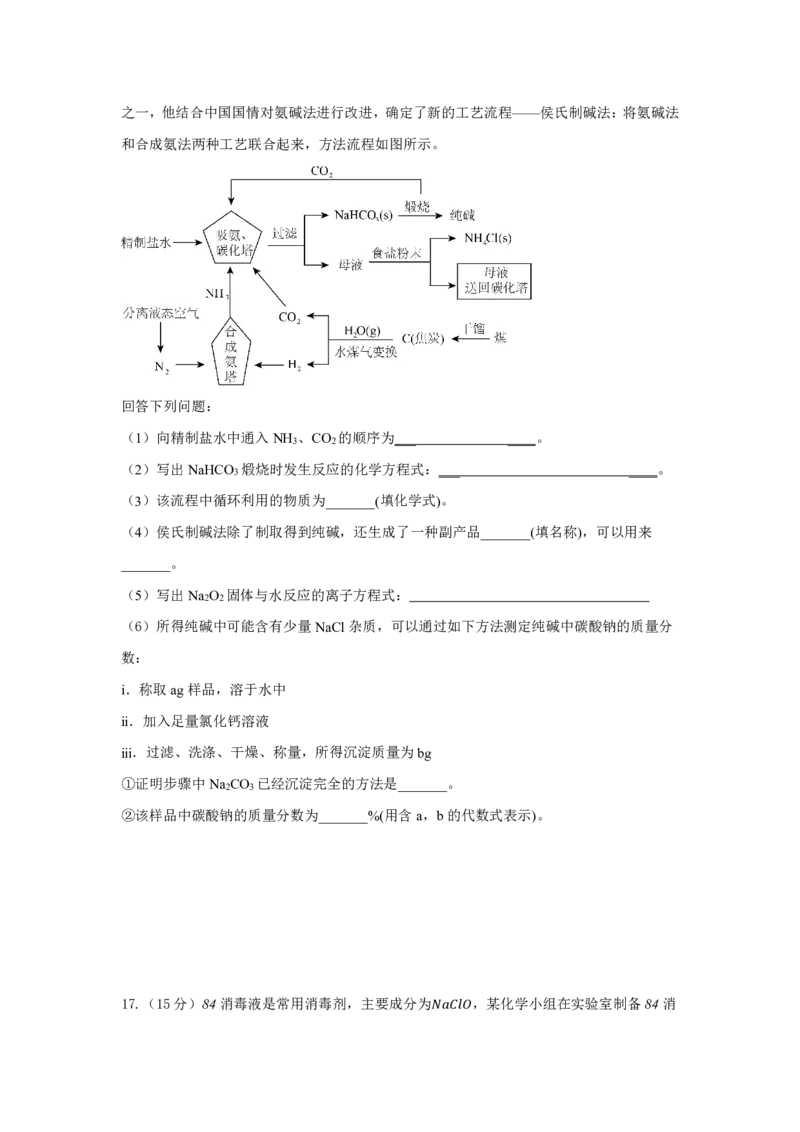
12.海洋中蕴含丰富的资源,利用海水提取溴和镁的过程如下图所示。
下列说法正确的是
A. 海水提溴的关键环节“富集”的主要目的是将 转化为
2
−
B. 步骤⑤中 和水可用 溶液代替,其他步 骤不变仍 能 实现溴的吸收
2 2 3
C. 步骤①中若 加入的石灰 乳 不 能用石灰水代替
D. 步骤⑨中发生的离子方程式为: ++ =
2
−
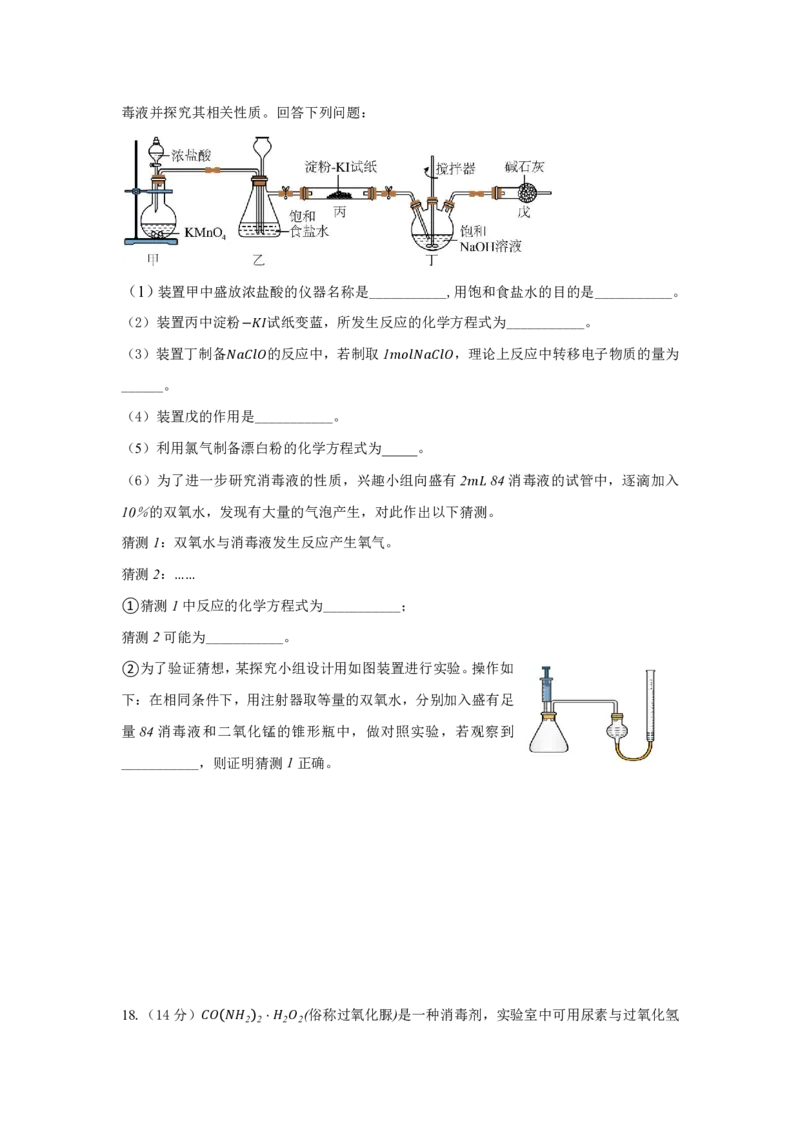
13.将一定量的Na CO 、NaHCO 组 成的 混
2 3 3
合物溶于水,配成1 L溶液,取出25 mL,向
其中逐滴加入一定物质的量浓度的盐酸,部
分物质的物质的量与加入盐酸的体积的关系
如图所示,下列说法正确的是( )
A.直线③代表产生的CO 的物质的量
2
B.原混合物中Na CO 的质量为5.3 g
2 3
C.滴加的盐酸浓度为0.5 molL-1
D.当收集到标准状况下CO 气体56 mL时消耗的盐酸为100 mL
2
14.设N 表示阿伏加德罗常数的值,下列说法正确的是
AA.CO g通过足量Na O s充分反应,固体增重14g时,反应中转移的电子数为0.5N
2 2 2 A
B.标准状况下,4.48LHF中含有的电子数目为2N
A
C.镁铝合金与盐酸反应时,当生成4gH 时转移的电子数目为2N
2 A
D.标准状况下,11.2LCl
2
溶于水,所得溶液中Cl、ClO、HClO的微粒数之和为N
A
二、填空题(共58分)
15.(15分)水是生命之源,与生活生产关系密切。保护水环境、珍爱水资源,是每个公民
应尽的责任和义务。
我国在水污染防治工作中已经建立健全流域生态环境综合管理体系。某河道两旁建有甲、乙
两化工厂,某兴趣小组的同学分别用试管A、B收集了两厂排放的污水带回学校进行实验探
究,工厂的师傅告诉同学们甲、乙两厂排放的工业废水中各含有 +、 +、 2+、 、 、
− −
中的三种(各不相同)。兴趣小组的同学向试管 的污水中滴 入酚 酞 试液 , 呈粉 红色 。 请
3
−
回 答下列问题:
(1)试管 的污水中所含的上述离子有________。
(2)若向 试管 的污水中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的
溶液,则加入的 药品是__________(填化学式)。
(3)若向由试管 污水中的阳离子组成的碳酸氢盐溶液中,滴入少量 ( ) 溶液,则发生
2
反应的离子方程式 为________________
(4)用于无土栽培的营养液中有KCl和K SO ,其中K+的浓度为0.5mol·L-1,Cl-的浓度为
2 4
0.1mol·L-1,则100mL该营养液中n( )= mol。
2−
(5)某物质的量浓度为0.05mol·L-1的S 金4 属氯化物溶液20mL,恰好与20mL0.15mol·L-1
的AgNO 溶液完全反应。则该氯化物中金属的化合价为 。
3
(6)3.6gH O的物质的量是 mol,含有 个质子(用N 表示)。
2 A
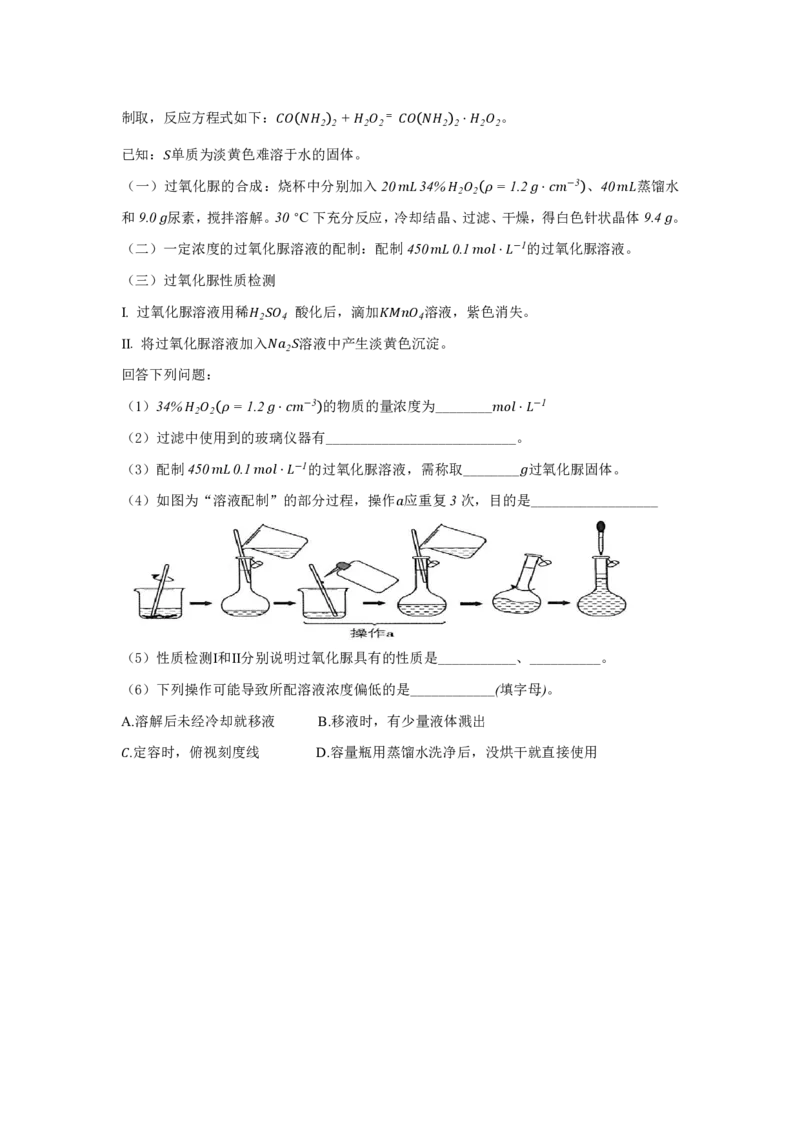
16 (14分)侯德榜为我国化工事业的发展做出了卓越贡献 是我国近代化学工业的奠基人之一,他结合中国国情对氨碱法进行改进,确定了新的工艺流程——侯氏制碱法:将氨碱法
和合成氨法两种工艺联合起来,方法流程如图所示。
回答下列问题:
(1)向精制盐水中通入NH 、CO 的顺序为___ ____。
3 2
(2)写出NaHCO 煅烧时发生反应的化学方程式:___ ____。
3
(3)该流程中循环利用的物质为_______(填化学式)。
(4)侯氏制碱法除了制取得到纯碱,还生成了一种副产品_______(填名称),可以用来
_______。
(5)写出Na O 固体与水反应的离子方程式:
2 2
(6)所得纯碱中可能含有少量NaCl杂质,可以通过如下方法测定纯碱中碳酸钠的质量分
数:
ⅰ.称取ag样品,溶于水中
ⅱ.加入足量氯化钙溶液
ⅲ.过滤、洗涤、干燥、称量,所得沉淀质量为bg
①证明步骤中Na CO 已经沉淀完全的方法是_______。
2 3
②该样品中碳酸钠的质量分数为_______%(用含a,b的代数式表示)。
17.(15分)84消毒液是常用消毒剂,主要成分为 ,某化学小组在实验室制备84消
毒液并探究其相关性质。回答下列问题:
(1)装置甲中盛放浓盐酸的仪器名称是___________,用饱和食盐水的目的是___________。
(2)装置丙中淀粉 试纸变蓝,所发生反应的化学方程式为___________。
(3)装置丁制备 − 的反应中,若制取1 ,理论上反应中转移电子物质的量为
______。
(4)装置戊的作用是___________。
(5)利用氯气制备漂白粉的化学方程式为_____。
(6)为了进一步研究消毒液的性质,兴趣小组向盛有2 84消毒液的试管中,逐滴加入
10%的双氧水,发现有大量的气泡产生,对此作出以下猜 测 。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:
①猜测1…中…反应的化学方程式为___________;
猜测2可能为___________。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如
下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足
量 84 消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到
___________,则证明猜测1正确。
18.(14分) (俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢
2 2 2 2
⋅ 制取,反应方程式如下: + 。
2 2 2 2 2 2 2 2
��
⋅
已知: 单质为淡黄色难溶于水的固体。
(一) 过氧化脲的合成:烧杯中分别加入20 34% =1.2 3 、40 蒸馏水
2 2
−
和9.0 尿素,搅拌溶解。30 C下充分反应,冷 却 结晶 、过 滤 、干燥 ,得⋅ 白色针状晶 体 9.4 。
∘
(二) 一定浓度的过氧化脲 溶液的配制:配制450 0.1 1的过氧化脲溶液。
−
(三)过氧化脲性质检测 ⋅
Ⅰ. 过氧化脲溶液用稀 酸化后,滴加 溶液,紫色消失。
2 4 4
Ⅱ. 将过氧化脲溶液加 入 溶液中产生淡 黄 色 沉淀。
2
回答下列问题:
(1)34% =1.2 3 的物质的量浓度为________ 1
2 2
− −
(2)过滤 中使 用 到的玻 璃⋅仪 器有________________________ __ _ 。⋅
(3)配制450 0.1 1的过氧化脲溶液,需称取________ 过氧化脲固体。
−
(4)如图为“ 溶 液 配 制 ” ⋅的 部分过程,操作 应重复3次,目的是 __________________
(5)性质检测Ⅰ和Ⅱ分别说明过氧化脲具有的性质是___________、__________。
(6)下列操作可能导致所配溶液浓度偏低的是____________(填字母)。
A.溶解后未经冷却就移液 B.移液时,有少量液体溅出
.定容时,俯视刻度线 D.容量瓶用蒸馏水洗净后,没烘干就直接使用
晋江侨声中学、南安侨光中学 2025 秋季高一年两校联考二
化学参考答案(附评分细则)
一、单选题(每题3分,共42分)
题号 1 2 3 4 5 6 7 8 9 10
答案 B A D A C C B D C A
题号 11 12 13 14
答案 B C D A
二、填空题(58分)
15.(15分,除备注外各2分)
(1) 、 、 (本空 分,答对一个 分,答错不得分) ( )
− + −
(3) 3 1 (2 4 ) 0.02
− 2+ − 2−
(5)+2 3 3 +( 6 ) +02.2 =22N 2 + 3↓ + 3
A
16.(14分,除备注外各2分)
煅烧
(1)先通入NH 3 ,后通入CO 2 (2) 2NaHCO Na CO +H O+CO
3 2 3 2 2
(3)CO ,NaCl (答对一个给1分,答错不得分)
2
(4) ①. 氯化铵(1分) ②. 作化肥(合理即可)(1分)
(5)2Na O +2H O=4Na++4OH-+O ↑
2 2 2 2
(6) ①. 取少量步骤ⅱ上层清液于试管中,加入氯化钙溶液,若不产生沉淀,则已沉淀完
106b
全(合理即可) ②.
a
17.(15分,除备注外各2分)
分液漏斗(1分) ; 除去氯气中混有的氯化氢气体(1分)
(1) (3) 尾气处理,防止氯气污染空气(1分)
(2) 2 2+C2a O =H 2+22C l Ca ClO 1moClaCl (4)2H O
(5) 2 2 2 2 2
(6) ; 消毒液催化双氧水分解,生成了氧气
②双氧①水 与 +消 毒2 液2反=应 产2 ↑生+的 气 体 +的 体2 积是二氧84化锰与双氧水生成的气体体积的 倍
18.(14分)84 2
(1)(2分) ;(2)烧杯、漏斗、玻璃棒(3分,各1分)(3)(3分) ;
(4)(2分)保1 2证将溶质全部转移到容量瓶中;(5)还原性;氧化性(2分,4.7各1分)
(6)(2分)B
试卷第 8 页 共 9 页