文档内容
聊城市 2024 年普通高中学业水平等级考试模拟卷
化学试题(一)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号填写在答题卡和试卷的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上
无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H-1 C-12 O-16 CI-35.5 Se-79 Pd-106 Ce-140 Bi-209
一、选择题:本题共 10小题,每小题 2分,共 20分。每小题只有一个选项符合题目要求。
1.文物是历史的活化石,承载灿烂文明,是传承文化最好的物质载体。下列文物的主要成分属于有机高分子
化合物的是( )
文物
选项 A.四羊方尊 B.唐兽首玛瑙杯 C.人面鱼纹盆 D.素纱禪衣
A.A B.B C.C D.D
2.下列物质的性质与用途对应关系错误的是( )
A.氧化铝熔点高,可用作耐火材料
B.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
C.Na S具有还原性,可用于去除水体中的Hg2+
2
D.聚合硫酸铁铝能水解形成胶体,可用作净水剂
3.下列化学教材中的实验操作,主要不是从安全因素考虑的是( )
A.1-溴丁烧的消去反应:向烧瓶中加入几片碎瓷片
B.钠与水的反应:切取一块绿豆大的钠放入水中
C.焰色试验;将铂丝用盐酸清洗干净
D.乙酸乙酯的制备:边振荡试管边慢慢加入浓硫酸
4.关于有机物检测,下列说法正确的是( )
A.用浓溴水可鉴别溴乙烷、乙醛和苯酚
B.用现代元素分析仪可确定有机物分子式
C.质谱法测得某有机物的相对分子质量为72,可推断其分子式为C H
5 12
D.麦芽糖与稀硫酸共热后加NaOH溶液调至碱性,再加入新制氢氧化铜并加热,可判断麦芽糖是否水解
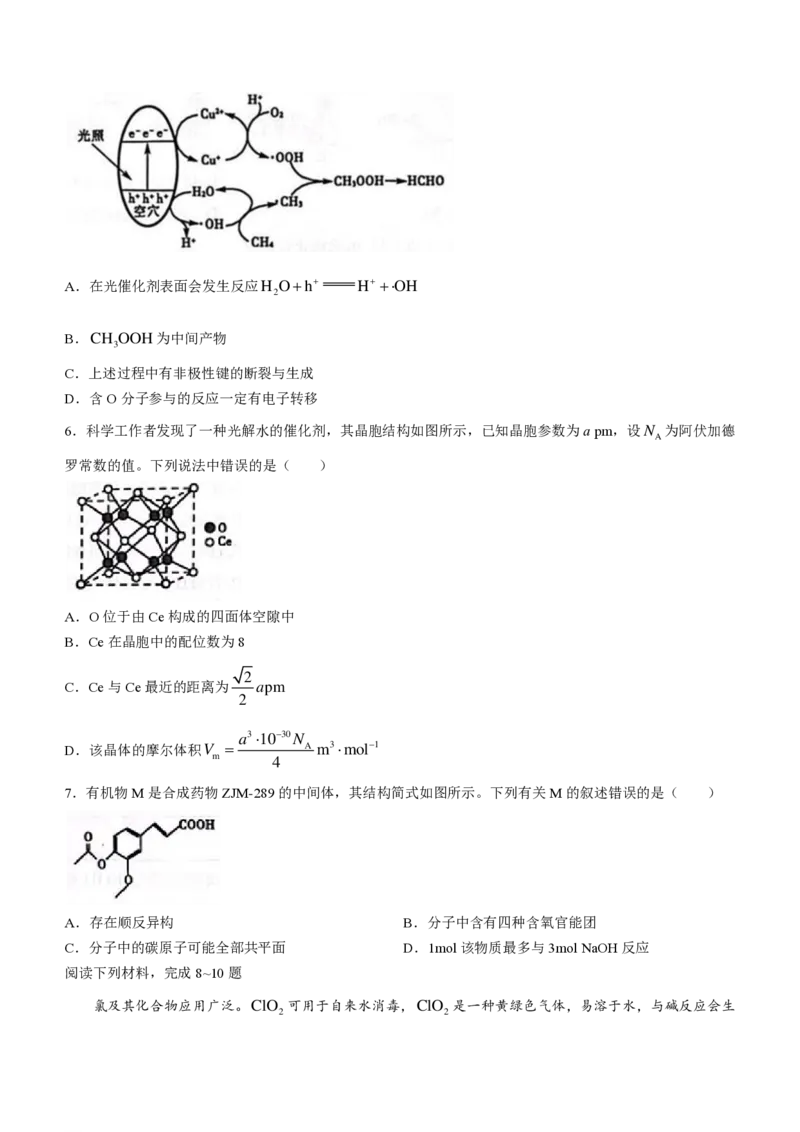
5.光催化氧化甲烷制甲醛的机理如图所示。下列说法不正确的是( )
学科网(北京)股份有限公司A.在光催化剂表面会发生反应H O+h+ H+ +OH
2
B.CH OOH为中间产物
3
C.上述过程中有非极性键的断裂与生成
D.含O分子参与的反应一定有电子转移
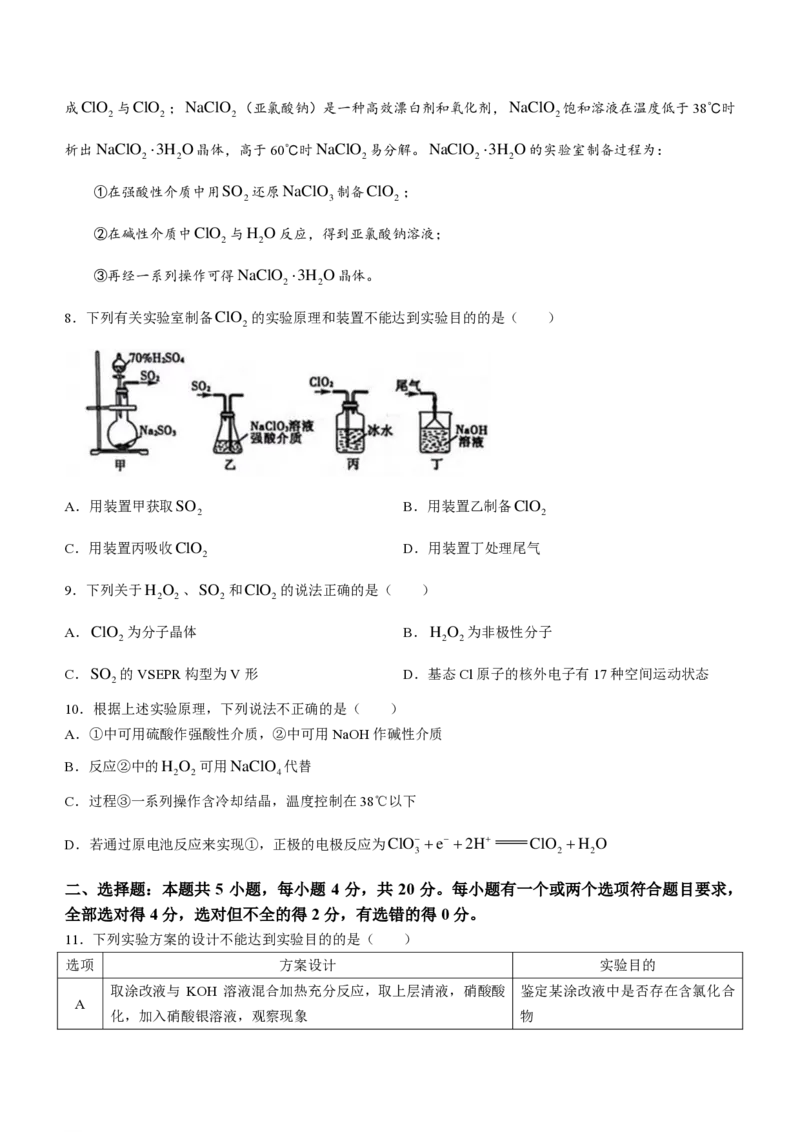
6.科学工作者发现了一种光解水的催化剂,其晶胞结构如图所示,已知晶胞参数为a pm,设N 为阿伏加德
A
罗常数的值。下列说法中错误的是( )
A.O位于由Ce构成的四面体空隙中
B.Ce在晶胞中的配位数为8
2
C.Ce与Ce最近的距离为 apm
2
a310−30N
D.该晶体的摩尔体积V = A m3mol−1
m 4
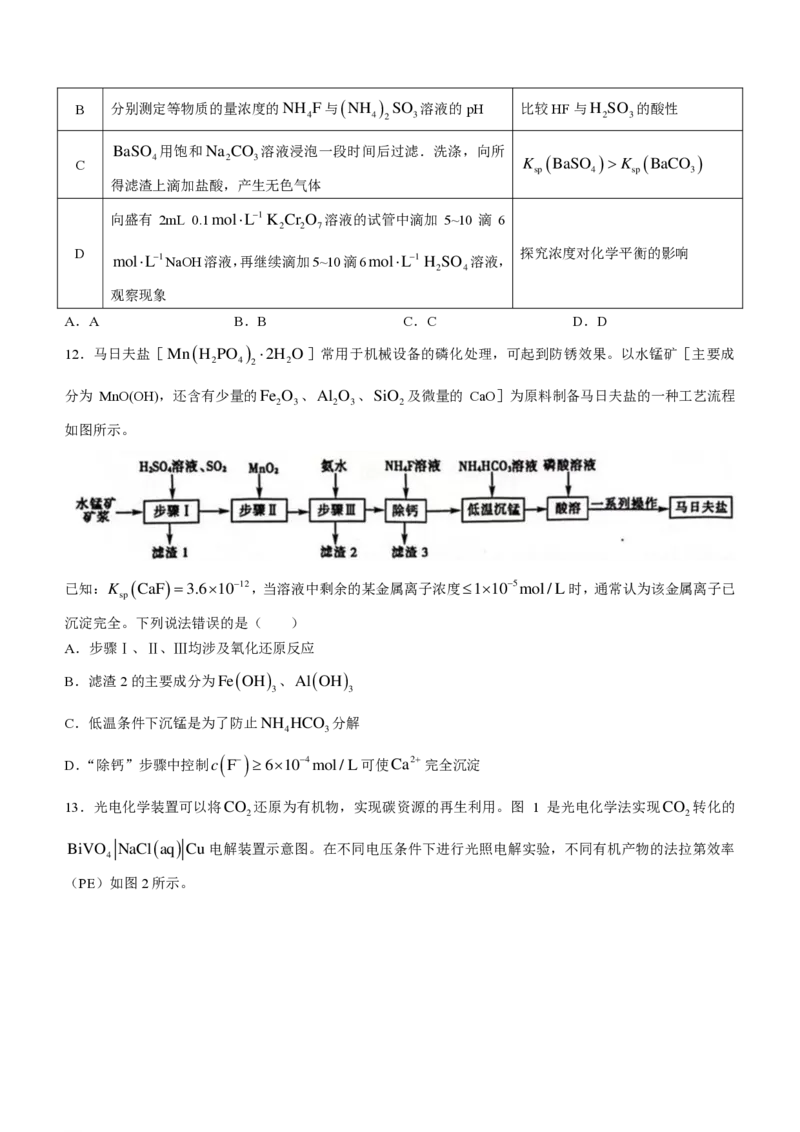
7.有机物M是合成药物ZJM-289的中间体,其结构简式如图所示。下列有关M的叙述错误的是( )
A.存在顺反异构 B.分子中含有四种含氧官能团
C.分子中的碳原子可能全部共平面 D.1mol该物质最多与3mol NaOH反应
阅读下列材料,完成8~10题
氯及其化合物应用广泛。ClO 可用于自来水消毒,ClO 是一种黄绿色气体,易溶于水,与碱反应会生
2 2
学科网(北京)股份有限公司成ClO 与ClO ;NaClO (亚氯酸钠)是一种高效漂白剂和氧化剂,NaClO 饱和溶液在温度低于38℃时
2 2 2 2
析出NaClO 3H O晶体,高于60℃时NaClO 易分解。NaClO 3H O的实验室制备过程为:
2 2 2 2 2
①在强酸性介质中用SO 还原NaClO 制备ClO ;
2 3 2
②在碱性介质中ClO 与H O反应,得到亚氯酸钠溶液;
2 2
③再经一系列操作可得NaClO 3H O晶体。
2 2
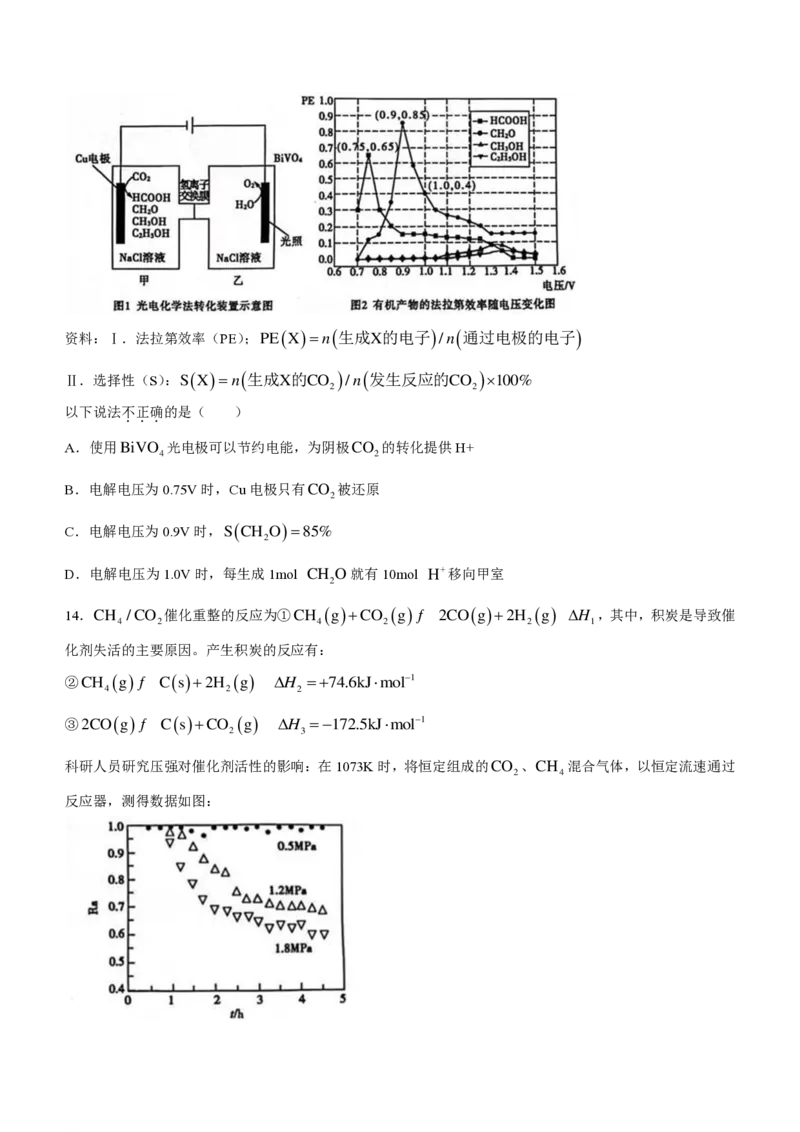
8.下列有关实验室制备ClO 的实验原理和装置不能达到实验目的的是( )
2
A.用装置甲获取SO B.用装置乙制备ClO
2 2
C.用装置丙吸收ClO D.用装置丁处理尾气
2
9.下列关于H O 、SO 和ClO 的说法正确的是( )
2 2 2 2
A.ClO 为分子晶体 B.H O 为非极性分子
2 2 2
C.SO 的VSEPR构型为V形 D.基态Cl原子的核外电子有17种空间运动状态
2
10.根据上述实验原理,下列说法不正确的是( )
A.①中可用硫酸作强酸性介质,②中可用NaOH作碱性介质
B.反应②中的H O 可用NaClO 代替
2 2 4
C.过程③一系列操作含冷却结晶,温度控制在38℃以下
D.若通过原电池反应来实现①,正极的电极反应为ClO− +e− +2H+ ClO +H O
3 2 2
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要求,
全部选对得 4分,选对但不全的得 2分,有选错的得 0分。
11.下列实验方案的设计不能达到实验目的的是( )
选项 方案设计 实验目的
取涂改液与 KOH 溶液混合加热充分反应,取上层清液,硝酸酸 鉴定某涂改液中是否存在含氯化合
A
化,加入硝酸银溶液,观察现象 物
学科网(北京)股份有限公司B 分别测定等物质的量浓度的NH F与(NH ) SO 溶液的pH 比较HF与H SO 的酸性
4 4 2 3 2 3
BaSO 用饱和Na CO 溶液浸泡一段时间后过滤.洗涤,向所
C 4 2 3 K (BaSO ) K (BaCO )
sp 4 sp 3
得滤渣上滴加盐酸,产生无色气体
向盛有 2mL 0.1molL−1 K Cr O 溶液的试管中滴加 5~10 滴 6
2 2 7
D 探究浓度对化学平衡的影响
molL−1NaOH溶液,再继续滴加5~10滴6molL−1 H SO 溶液,
2 4
观察现象
A.A B.B C.C D.D
12.马日夫盐[Mn(H PO ) 2H O]常用于机械设备的磷化处理,可起到防锈效果。以水锰矿[主要成
2 4 2 2
分为 MnO(OH),还含有少量的Fe O 、Al O 、SiO 及微量的 CaO]为原料制备马日夫盐的一种工艺流程
2 3 2 3 2
如图所示。
已知:K (CaF)=3.610−12,当溶液中剩余的某金属离子浓度110−5mol/L时,通常认为该金属离子已
sp
沉淀完全。下列说法错误的是( )
A.步骤Ⅰ、Ⅱ、Ⅲ均涉及氧化还原反应
B.滤渣2的主要成分为Fe(OH) 、Al(OH)
3 3
C.低温条件下沉锰是为了防止NH HCO 分解
4 3
D.“除钙”步骤中控制c ( F−) 610−4mol/L可使Ca2+完全沉淀
13.光电化学装置可以将CO 还原为有机物,实现碳资源的再生利用。图 1 是光电化学法实现CO 转化的
2 2
BiVO NaCl(aq) Cu电解装置示意图。在不同电压条件下进行光照电解实验,不同有机产物的法拉第效率
4
(PE)如图2所示。
学科网(北京)股份有限公司资料:Ⅰ.法拉第效率(PE);PE(X)=n(生成X的电子)/n(通过电极的电子)
Ⅱ.选择性(S):S(X)=n(生成X的CO )/n(发生反应的CO )100%
2 2
以下说法不正确的是( )
...
A.使用BiVO 光电极可以节约电能,为阴极CO 的转化提供H+
4 2
B.电解电压为0.75V时,Cu电极只有CO 被还原
2
C.电解电压为0.9V时,S(CH O)=85%
2
D.电解电压为1.0V时,每生成1mol CH O就有10mol H+移向甲室
2
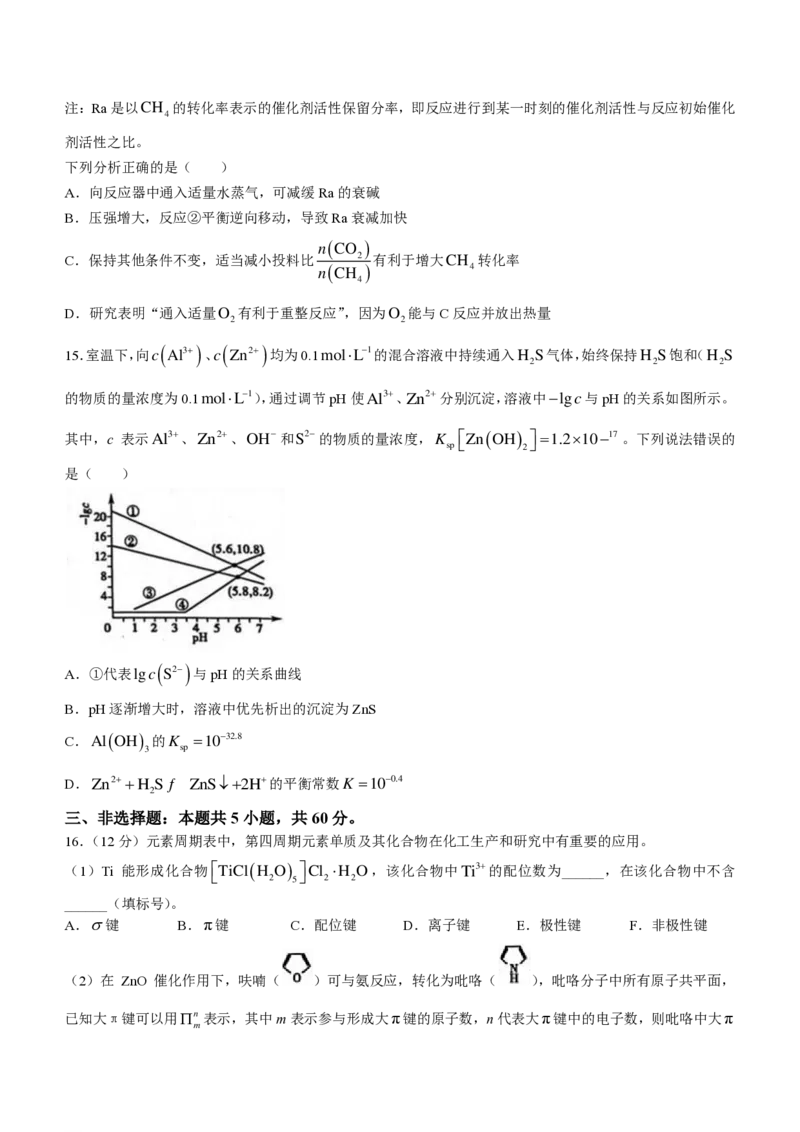
14.CH /CO 催化重整的反应为①CH (g)+CO (g)ƒ 2CO(g)+2H (g) H ,其中,积炭是导致催
4 2 4 2 2 1
化剂失活的主要原因。产生积炭的反应有:
②CH (g)ƒ C(s)+2H (g) H =+74.6kJmol−1
4 2 2
③2CO(g)ƒ C(s)+CO (g) H =−172.5kJmol−1
2 3
科研人员研究压强对催化剂活性的影响:在1073K时,将恒定组成的CO 、CH 混合气体,以恒定流速通过
2 4
反应器,测得数据如图:
学科网(北京)股份有限公司注:Ra是以CH 的转化率表示的催化剂活性保留分率,即反应进行到某一时刻的催化剂活性与反应初始催化
4
剂活性之比。
下列分析正确的是( )
A.向反应器中通入适量水蒸气,可减缓Ra的衰碱
B.压强增大,反应②平衡逆向移动,导致Ra衰减加快
n(CO )
C.保持其他条件不变,适当减小投料比 2 有利于增大CH 转化率
n(CH ) 4
4
D.研究表明“通入适量O 有利于重整反应”,因为O 能与C反应并放出热量
2 2
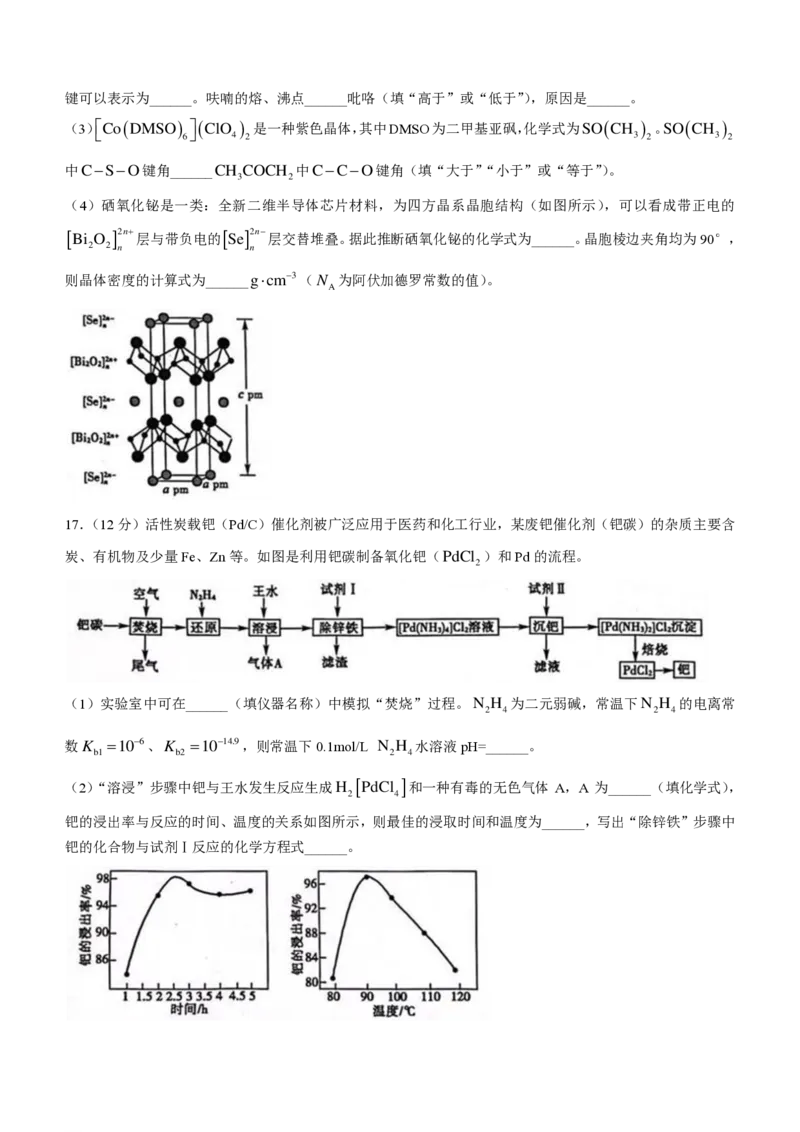
15.室温下,向c ( Al3+) 、c ( Zn2+) 均为0.1molL−1的混合溶液中持续通入H S气体,始终保持H S饱和(H S
2 2 2
的物质的量浓度为0.1molL−1),通过调节pH使Al3+、Zn2+分别沉淀,溶液中−lgc与pH的关系如图所示。
其中,c 表示Al3+、Zn2+、OH−和S2−的物质的量浓度,K Zn(OH) =1.210−17。下列说法错误的
sp 2
是( )
A.①代表lgc
( S2−)
与pH的关系曲线
B.pH逐渐增大时,溶液中优先析出的沉淀为ZnS
C.Al(OH) 的K =10−32.8
3 sp
D.Zn2++H Sƒ ZnS+2H+的平衡常数K =10−0.4
2
三、非选择题:本题共 5小题,共 60 分。
16.(12分)元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(1)Ti 能形成化合物TiCl(H O) Cl H O,该化合物中Ti3+的配位数为______,在该化合物中不含
2 5 2 2
______(填标号)。
A.键 B.π键 C.配位键 D.离子键 E.极性键 F.非极性键
(2)在 ZnO 催化作用下,呋喃( )可与氨反应,转化为吡咯( ),吡咯分子中所有原子共平面,
已知大π键可以用n 表示,其中m表示参与形成大π键的原子数,n代表大π键中的电子数,则吡咯中大π
m
学科网(北京)股份有限公司键可以表示为______。呋喃的熔、沸点______吡咯(填“高于”或“低于”),原因是______。
(3)Co(DMSO) (ClO ) 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为SO(CH ) 。SO(CH )
6 4 2 3 2 3 2
中C−S−O键角______CH COCH 中C−C−O键角(填“大于”“小于”或“等于”)。
3 2
(4)硒氧化铋是一类:全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
Bi O 2n+ 层与带负电的Se2n− 层交替堆叠。据此推断硒氧化铋的化学式为______。晶胞棱边夹角均为90°,
2 2 n n
则晶体密度的计算式为______gcm−3(N 为阿伏加德罗常数的值)。
A
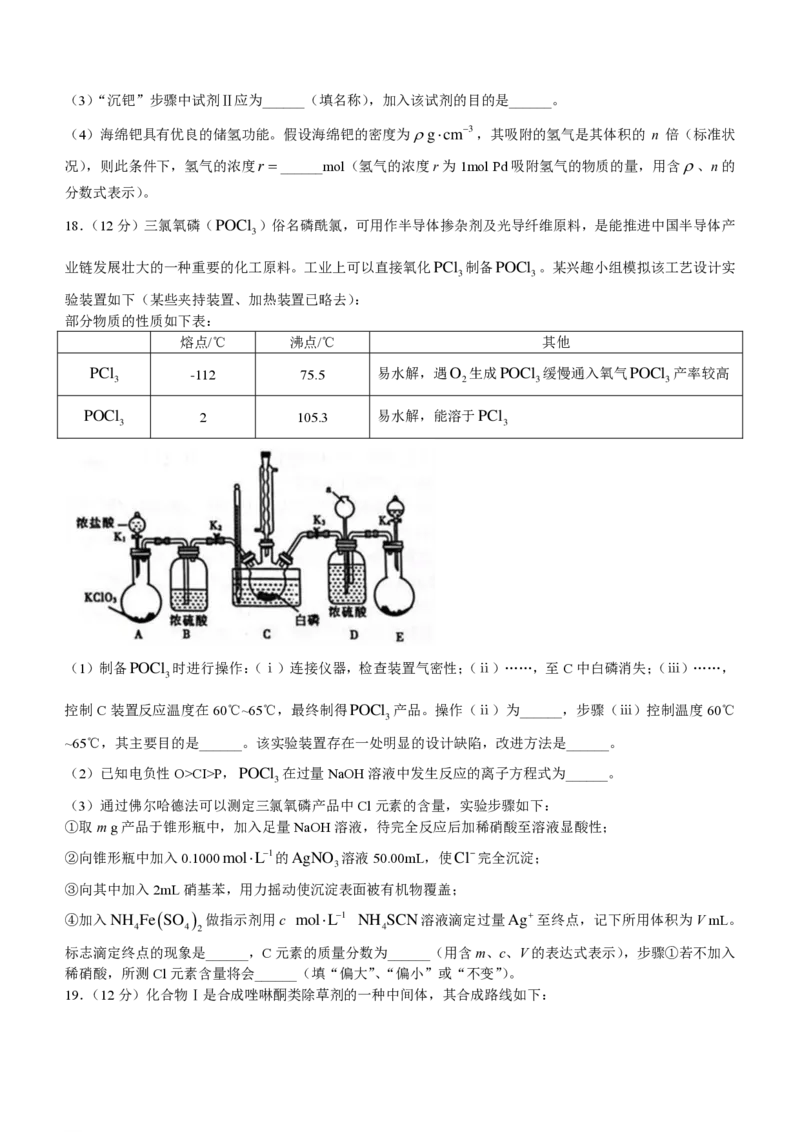
17.(12分)活性炭载钯(Pd/C)催化剂被广泛应用于医药和化工行业,某废钯催化剂(钯碳)的杂质主要含
炭、有机物及少量Fe、Zn等。如图是利用钯碳制备氧化钯(PdCl )和Pd的流程。
2
(1)实验室中可在______(填仪器名称)中模拟“焚烧”过程。N H 为二元弱碱,常温下N H 的电离常
2 4 2 4
数K =10−6、K =10−14.9,则常温下0.1mol/L N H 水溶液pH=______。
b1 b2 2 4
(2)“溶浸”步骤中钯与王水发生反应生成H PdCl 和一种有毒的无色气体 A,A 为______(填化学式),
2 4
钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为______,写出“除锌铁”步骤中
钯的化合物与试剂Ⅰ反应的化学方程式______。
学科网(北京)股份有限公司(3)“沉钯”步骤中试剂Ⅱ应为______(填名称),加入该试剂的目的是______。
(4)海绵钯具有优良的储氢功能。假设海绵钯的密度为gcm−3,其吸附的氢气是其体积的 n 倍(标准状
况),则此条件下,氢气的浓度r =______mol(氢气的浓度r为1mol Pd吸附氢气的物质的量,用含、n的
分数式表示)。
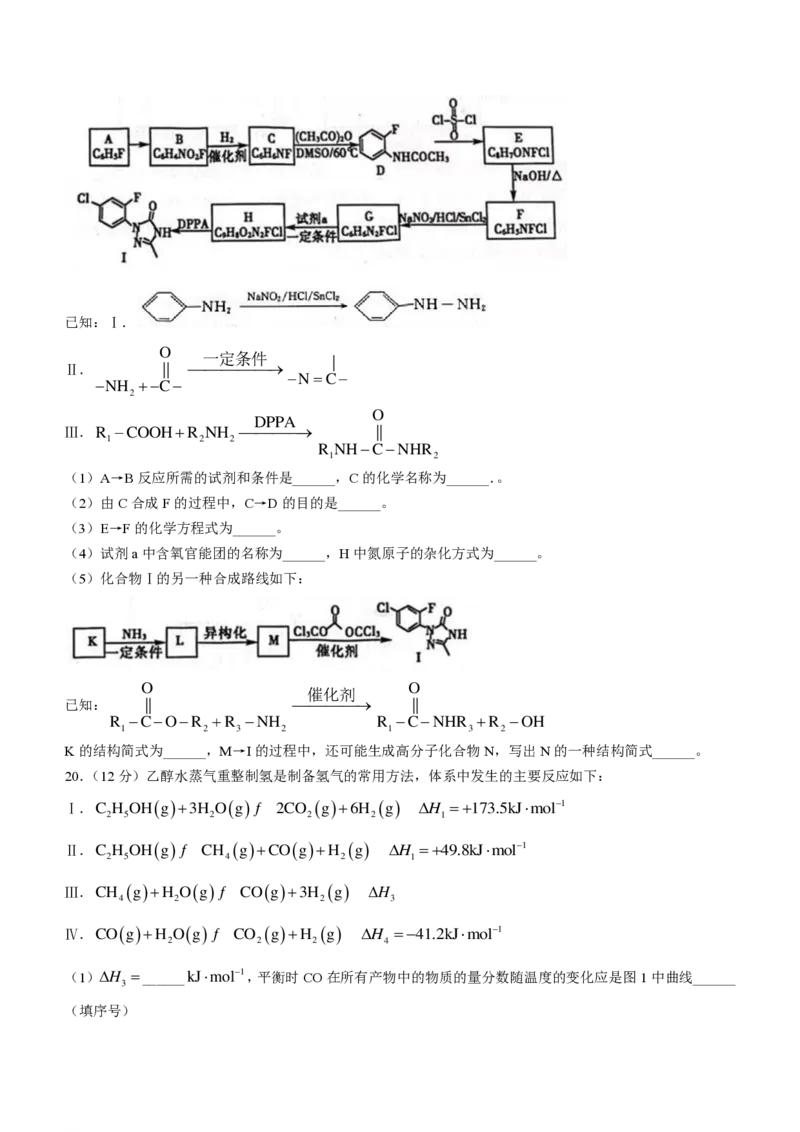
18.(12分)三氯氧磷(POCl )俗名磷酰氯,可用作半导体掺杂剂及光导纤维原料,是能推进中国半导体产
3
业链发展壮大的一种重要的化工原料。工业上可以直接氧化PCl 制备POCl 。某兴趣小组模拟该工艺设计实
3 3
验装置如下(某些夹持装置、加热装置已略去):
部分物质的性质如下表:
熔点/℃ 沸点/℃ 其他
PCl -112 75.5 易水解,遇O 生成POCl 缓慢通入氧气POCl 产率较高
3 2 3 3
POCl 2 105.3 易水解,能溶于PCl
3 3
(1)制备POCl 时进行操作:(ⅰ)连接仪器,检查装置气密性;(ⅱ)……,至C中白磷消失;(ⅲ)……,
3
控制C装置反应温度在60℃~65℃,最终制得POCl 产品。操作(ⅱ)为______,步骤(ⅲ)控制温度60℃
3
~65℃,其主要目的是______。该实验装置存在一处明显的设计缺陷,改进方法是______。
(2)已知电负性O>CI>P,POCl 在过量NaOH溶液中发生反应的离子方程式为______。
3
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素的含量,实验步骤如下:
①取m g产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
②向锥形瓶中加入0.1000molL−1的AgNO 溶液50.00mL,使Cl−完全沉淀;
3
③向其中加入2mL硝基苯,用力摇动使沉淀表面被有机物覆盖;
④加入NH Fe(SO ) 做指示剂用c molL−1 NH SCN溶液滴定过量Ag+至终点,记下所用体积为V mL。
4 4 2 4
标志滴定终点的现象是______,C元素的质量分数为______(用含m、c、V的表达式表示),步骤①若不加入
稀硝酸,所测Cl元素含量将会______(填“偏大”、“偏小”或“不变”)。
19.(12分)化合物Ⅰ是合成唑啉酮类除草剂的一种中间体,其合成路线如下:
学科网(北京)股份有限公司已知:Ⅰ.
O
一定条件 |
Ⅱ. || ⎯⎯⎯⎯⎯→
−N=C−
−NH +−C−
2
O
DPPA
Ⅲ.R −COOH+R NH ⎯⎯⎯⎯→ ||
1 2 2
R NH−C−NHR
1 2
(1)A→B反应所需的试剂和条件是______,C的化学名称为______.。
(2)由C合成F的过程中,C→D的目的是______。
(3)E→F的化学方程式为______。
(4)试剂a中含氧官能团的名称为______,H中氮原子的杂化方式为______。
(5)化合物Ⅰ的另一种合成路线如下:
O O
催化剂
已知: || ⎯⎯⎯⎯→ ||
R −C−O−R +R −NH R −C−NHR +R −OH
1 2 3 2 1 3 2
K的结构简式为______,M→I的过程中,还可能生成高分子化合物N,写出N的一种结构简式______。
20.(12分)乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应如下:
Ⅰ.C H OH(g)+3H O(g)ƒ 2CO (g)+6H (g) H =+173.5kJmol−1
2 5 2 2 2 1
Ⅱ.C H OH(g)ƒ CH (g)+CO(g)+H (g) H =+49.8kJmol−1
2 5 4 2 1
Ⅲ.CH (g)+H O(g)ƒ CO(g)+3H (g) H
4 2 2 3
Ⅳ.CO(g)+H O(g)ƒ CO (g)+H (g) H =−41.2kJmol−1
2 2 2 4
(1)H =______kJmol−1,平衡时CO在所有产物中的物质的量分数随温度的变化应是图1中曲线______
3
(填序号)
学科网(北京)股份有限公司(2)为研究上述反应体系中的平衡关系,向某恒温恒容反应容器中按n(C H OH):n(H O)=1:7投料,初
2 5 2
始压强为 p kPa。充分反应,平衡时,乙醇转化率为 80%,测得H 体积分数为 18%,CO 体积分数为4%,
2 2
则反应Ⅳ的平衡常数K =______(K 为以物质的量分数表示的平衡常数),到达平衡时体系中CO的分压为
x x
______kPa,H 的产率为______。
2
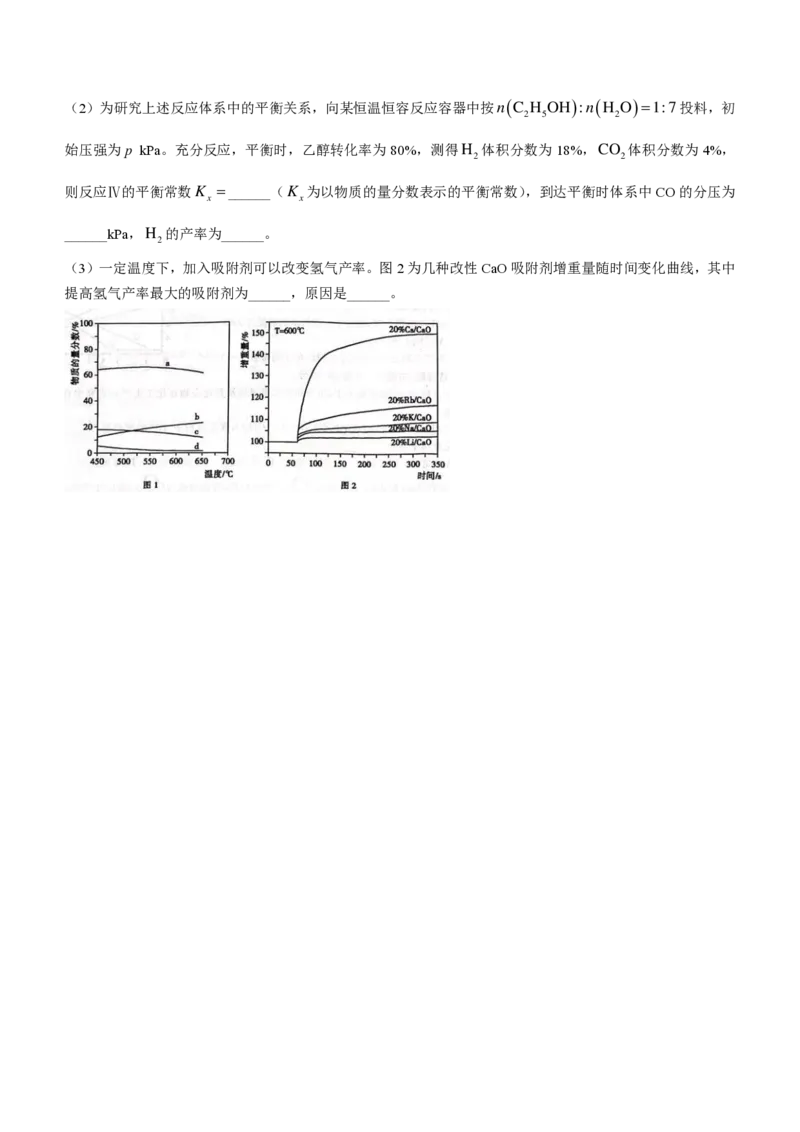
(3)一定温度下,加入吸附剂可以改变氢气产率。图2为几种改性CaO吸附剂增重量随时间变化曲线,其中
提高氢气产率最大的吸附剂为______,原因是______。
学科网(北京)股份有限公司