文档内容
邵阳市二中2024年高三(5月)模拟考试
化 学
考试用时:75分钟 试卷满分:100分
命题人:高三化学备课组 审题人:夏仲华 张柔
可能用到的相对原子量:H-1 C-12 N-14 O-16 S-32 Se-79
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一项是符合题目要求的。)
1、化学与生产、生活和社会密切相关。下列说法错误的是
A.天然氨基酸一般能溶于水,而难溶于乙醇、乙醚等有机溶剂
B.O 分子中的共价键是极性键,中心氧原子呈正电性
3
C.加工馒头,面包时,可加入一些膨松剂如NH HCO ,使面团疏松多孔
4 3
D.核酸是生物体遗传信息的载体,通过红外光谱仪可检测其结构中存在单键、双键、
氢键等化学键
2.下列化学用语不正确的是
A.聚乙炔的结构简式: ,相同质量的乙炔和聚乙炔完全燃烧耗氧
量相同
B.基态镍离子(Ni2+)的核外最外层电子排布式是3s23p63d8
C.基态 的价电子轨道表示式:
D.HCl分子中 键的形成:
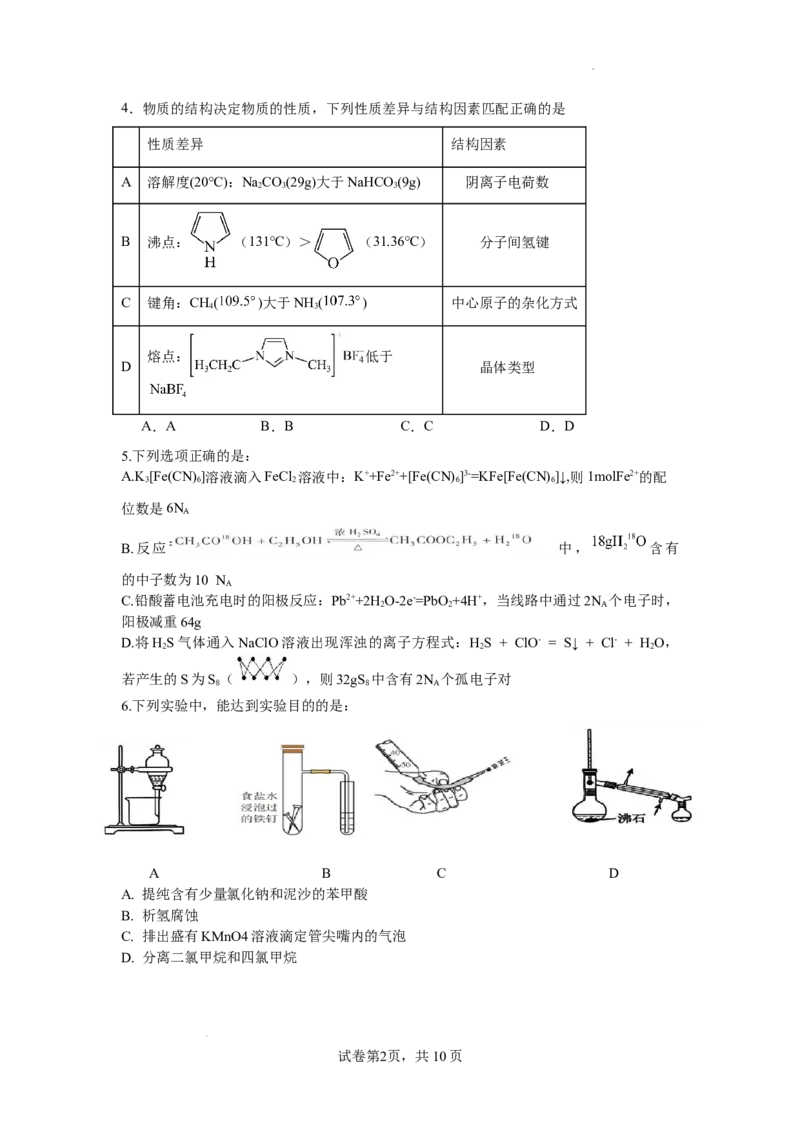
3.关于下列仪器使用的说法错误的是
A.仪器①使用前,需要检查两处是否漏水
B.仪器②可用于测定硫酸铜晶体中的结晶水含量
C.仪器③和④可用于配制一定质量分数的CuSO₄溶液
D.仪器⑤可用于移取0.1mol⋅L⁻¹Na₂Cr₂O₇溶液
试卷第1页,共10页
学科网(北京)股份有限公司4.物质的结构决定物质的性质,下列性质差异与结构因素匹配正确的是
性质差异 结构因素
A 溶解度(20℃):NaCO(29g)大于NaHCO (9g) 阴离子电荷数
2 3 3
B 沸点: (131℃)> (31.36℃) 分子间氢键
C 键角:CH( )大于NH ( ) 中心原子的杂化方式
4 3
熔点: 低于
D 晶体类型
A.A B.B C.C D.D
5.下列选项正确的是:
A.K[Fe(CN) ]溶液滴入FeCl 溶液中:K++Fe2++[Fe(CN)]3-=KFe[Fe(CN) ]↓,则1molFe2+的配
3 6 2 6 6
位数是6N
A
B.反应 中, 含有
的中子数为10 N
A
C.铅酸蓄电池充电时的阳极反应:Pb2++2H O-2e-=PbO+4H+,当线路中通过2N 个电子时,
2 2 A
阳极减重64g
D.将HS气体通入NaClO溶液出现浑浊的离子方程式:HS + ClO- = S↓ + Cl- + HO,
2 2 2
若产生的S为S( ),则32gS 中含有2N 个孤电子对
8 8 A
6.下列实验中,能达到实验目的的是:
A B C D
A. 提纯含有少量氯化钠和泥沙的苯甲酸
B. 析氢腐蚀
C. 排出盛有KMnO4溶液滴定管尖嘴内的气泡
D. 分离二氯甲烷和四氯甲烷
试卷第2页,共10页
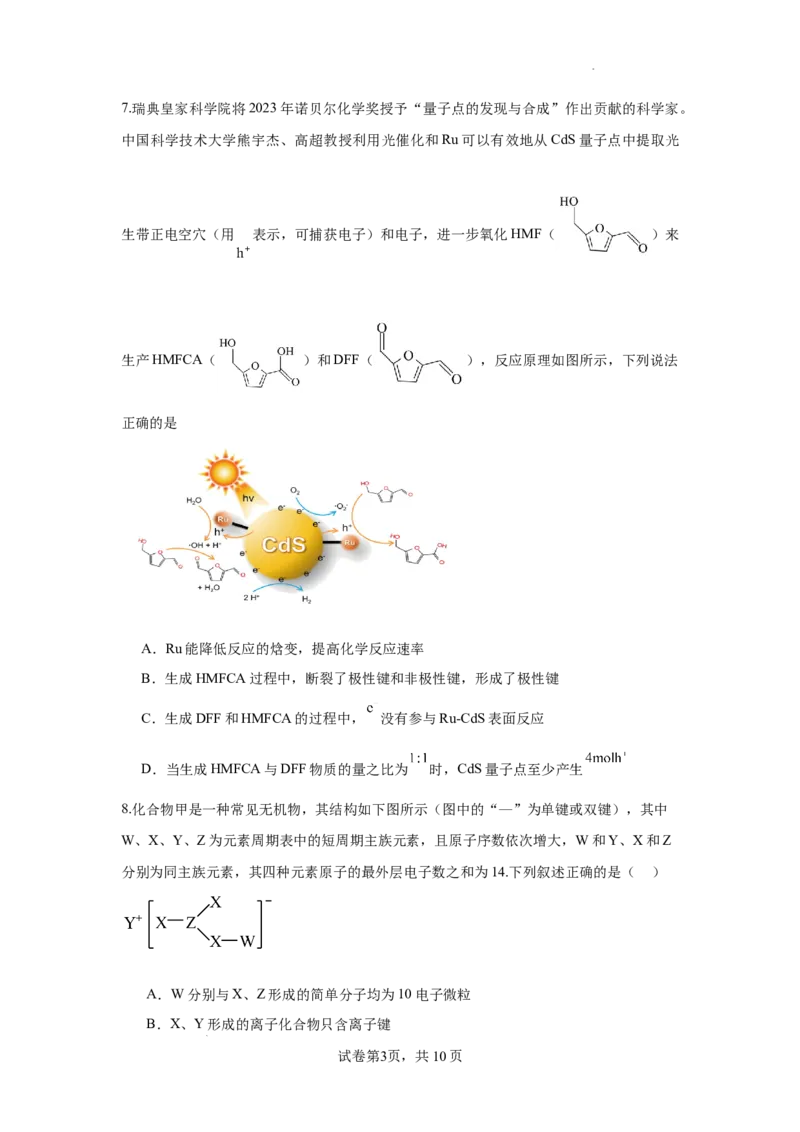
学科网(北京)股份有限公司7.瑞典皇家科学院将2023年诺贝尔化学奖授予“量子点的发现与合成”作出贡献的科学家。
中国科学技术大学熊宇杰、高超教授利用光催化和Ru可以有效地从CdS量子点中提取光
生带正电空穴(用 表示,可捕获电子)和电子,进一步氧化HMF( )来
生产HMFCA( )和DFF( ),反应原理如图所示,下列说法
正确的是
A.Ru能降低反应的焓变,提高化学反应速率
B.生成HMFCA过程中,断裂了极性键和非极性键,形成了极性键
C.生成DFF和HMFCA的过程中, 没有参与Ru-CdS表面反应
D.当生成HMFCA与DFF物质的量之比为 时,CdS量子点至少产生
8.化合物甲是一种常见无机物,其结构如下图所示(图中的“—”为单键或双键),其中
W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X和Z
分别为同主族元素,其四种元素原子的最外层电子数之和为14.下列叙述正确的是( )
A.W分别与X、Z形成的简单分子均为10电子微粒
B.X、Y形成的离子化合物只含离子键
试卷第3页,共10页
学科网(北京)股份有限公司C.ZX 的键角小于ZX 的键角
2 3
D.等物质的量Y和Z的最高价氧化物对应的水化物反应生成甲
9. 卡维地洛类药物(丁)可用于治疗原发性高血压、有症状的充血性心力衰竭。以甲为原料
合成丁的方法如下图所示。下列说法正确的是( )
A.试剂X可以是足量 溶液
B.丙、丁都不含手性碳,它们互为同系物
C.乙、丙、丁均能与NaOH溶液和盐酸反应
D.戊的同分异构体有3种(不考虑立体异构)
10.二苯铬[(C₆H₆) ₂Cr]可作烯烃聚合或异丙醇脱氢等反应的催化剂,工业上常用 Cr₂O₃
为原料按如下流程制备二苯铬
已知:①COCl₂、CCl₄沸点分别为8.2℃、77 ℃;②二苯铬不溶于水,微溶于乙醚和乙醇,
在真空中 160℃时升华,在潮湿空气中易被氧化;③苯分子作配体时可提供三个配位原子。
下列说法正确的是
A.为了向“转化”提供稳定的CCl₄气流,可用水浴加热 CCl₄并用氮气带出CCl₄
B.1mol[(C₆H₆) ₂Cr][AlCl₄]中含有6N
A
个配位键(N
A
表示阿伏加德罗常数的值)
C.“还原”中,还需通入一定量N₂,主要目的是防止Na₂S₂O₄被氧化
D.“还原”后,经过滤、蒸馏水洗涤可得到纯净的二苯铬
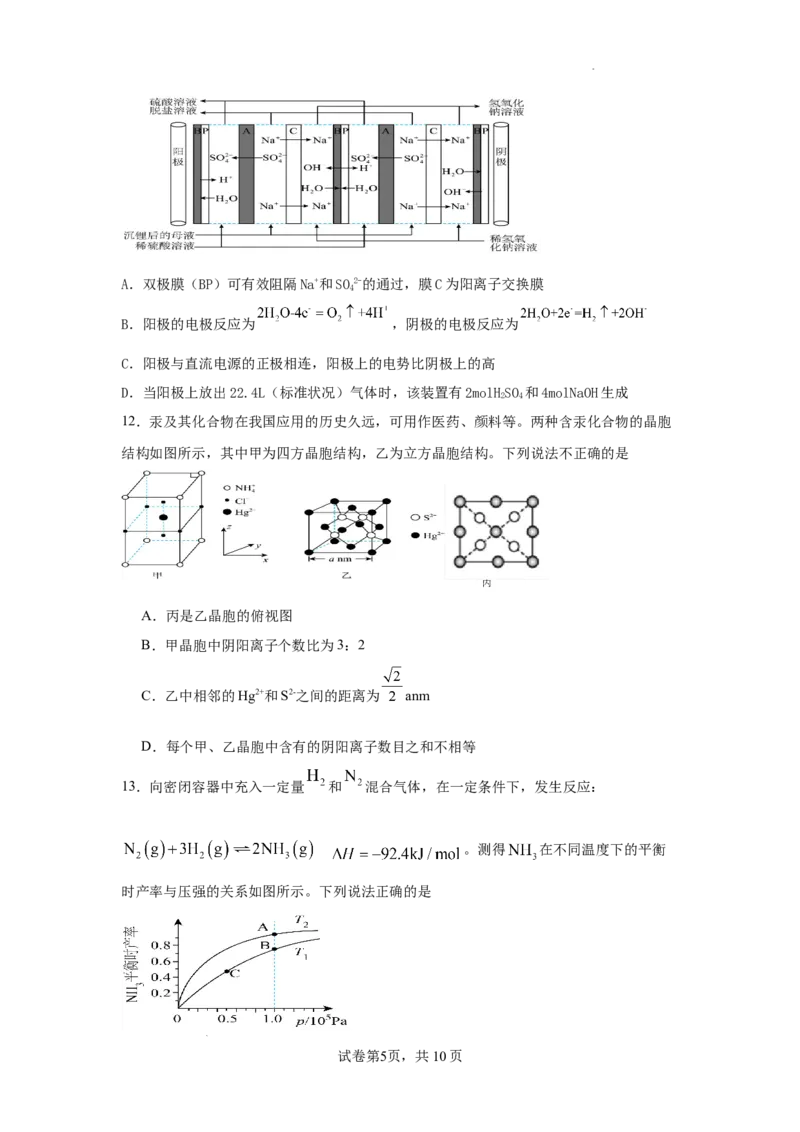
11.退役锂离子电池正极材料中有价金属的回收利用,是解决新能源汽车产业环境污染和
资源短缺的有效方法,也是该产业可持续发展的关键。回收过程中产生的沉锂后的母液中
的溶质主要是NaSO,可根据电化学原理采用双极膜(BP)与离子交换膜(A、C)组合技
2 4
术处理沉锂后的母液,实现废水的净化和资源回收(如图所示)。下列说法错误的是(
)
试卷第4页,共10页
学科网(北京)股份有限公司A.双极膜(BP)可有效阻隔Na+和SO2-的通过,膜C为阳离子交换膜
4
B.阳极的电极反应为 ,阴极的电极反应为
C.阳极与直流电源的正极相连,阳极上的电势比阴极上的高
D.当阳极上放出22.4L(标准状况)气体时,该装置有2molHSO 和4molNaOH生成
2 4
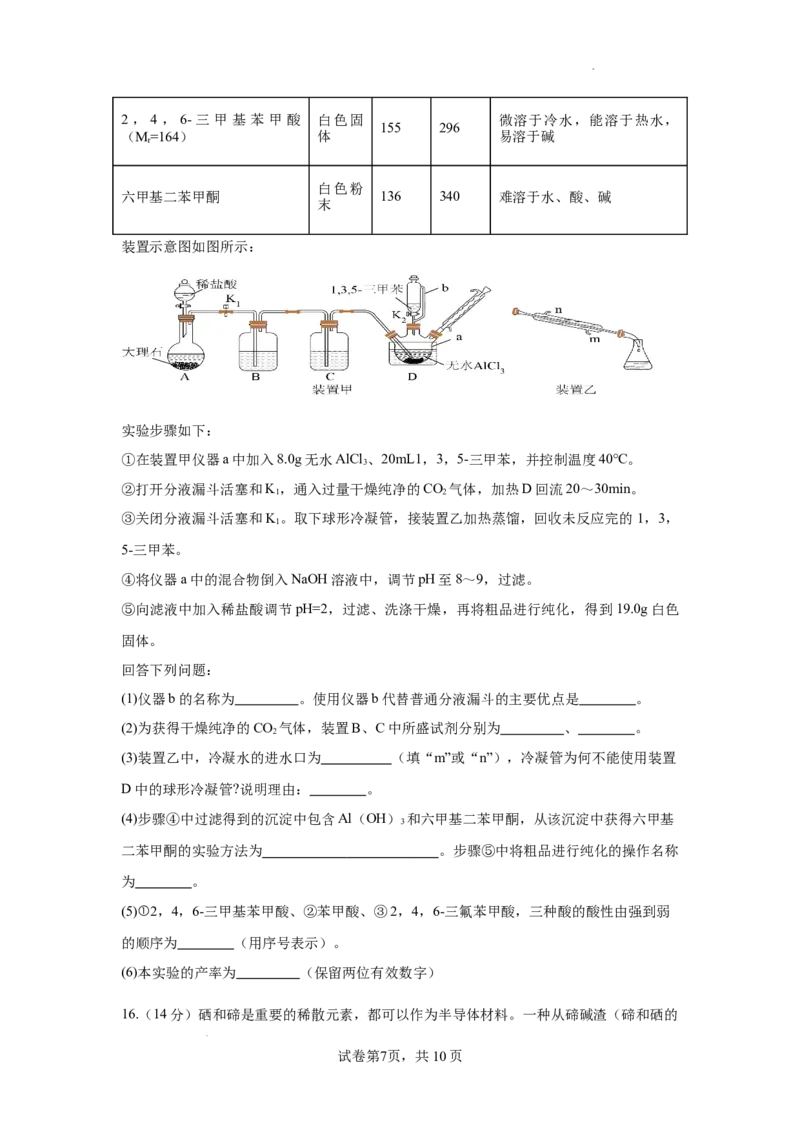
12.汞及其化合物在我国应用的历史久远,可用作医药、颜料等。两种含汞化合物的晶胞
结构如图所示,其中甲为四方晶胞结构,乙为立方晶胞结构。下列说法不正确的是
丙
A.丙是乙晶胞的俯视图
B.甲晶胞中阴阳离子个数比为3:2
C.乙中相邻的Hg2+和S2-之间的距离为 anm
D.每个甲、乙晶胞中含有的阴阳离子数目之和不相等
13.向密闭容器中充入一定量 和 混合气体,在一定条件下,发生反应:
。测得 在不同温度下的平衡
时产率与压强的关系如图所示。下列说法正确的是
试卷第5页,共10页
学科网(北京)股份有限公司A. 平衡常数: B. 逆反应速率:
C. 反应温度: D. 混合气体平均摩尔质量:
14.常温下,用0.1mol·L-1NaOH溶液滴定40mL0.1mol·L-1HSO 溶液,所得滴定曲线如图
2 3
所示(忽略混合时溶液体积的变化)。下列叙述错误的是
A.由W点可求出K (H SO ) =10-2
a1 2 3
B.图中X点对应的溶液中:c(Na+)>c(HSO )>c(SO )>c(OH-)
C.图中Y点对应的横坐标小于60mL
D.图中Z点对应的溶液中:c(H+)+ c(HSO )+2 c (H SO )=c(OH-)
2 3
二、非选择题:本题共四个小题,共58分。
15、(14分)实验室由1,3,5-三甲苯(密度为0.87gcm3)为主要有机原料制备2,4,6-
三甲基苯甲酸的反应原理为 相关信息如下表:
熔 沸
物质 性状 溶解性
点/℃ 点/℃
无色液
1,3,5-三甲苯(M=120) -44.8 164.7 难溶于水、酸、碱
r 体
试卷第6页,共10页
学科网(北京)股份有限公司2 , 4 , 6- 三 甲 基 苯 甲 酸 白色固 微溶于冷水,能溶于热水,
155 296
(M=164) 体 易溶于碱
r
白色粉
六甲基二苯甲酮 136 340 难溶于水、酸、碱
末
装置示意图如图所示:
实验步骤如下:
①在装置甲仪器a中加入8.0g无水AlCl 、20mL1,3,5-三甲苯,并控制温度40℃。
3
②打开分液漏斗活塞和K,通入过量干燥纯净的CO 气体,加热D回流20~30min。
1 2
③关闭分液漏斗活塞和K。取下球形冷凝管,接装置乙加热蒸馏,回收未反应完的 1,3,
1
5-三甲苯。
④将仪器a中的混合物倒入NaOH溶液中,调节pH至8~9,过滤。
⑤向滤液中加入稀盐酸调节pH=2,过滤、洗涤干燥,再将粗品进行纯化,得到19.0g白色
固体。
回答下列问题:
(1)仪器b的名称为 。使用仪器b代替普通分液漏斗的主要优点是 。
(2)为获得干燥纯净的CO 气体,装置B、C中所盛试剂分别为 、 。
2
(3)装置乙中,冷凝水的进水口为 (填“m”或“n”),冷凝管为何不能使用装置
D中的球形冷凝管?说明理由: 。
(4)步骤④中过滤得到的沉淀中包含Al(OH) 和六甲基二苯甲酮,从该沉淀中获得六甲基
3
二苯甲酮的实验方法为 。步骤⑤中将粗品进行纯化的操作名称
为 。
(5)①2,4,6-三甲基苯甲酸、②苯甲酸、③2,4,6-三氟苯甲酸,三种酸的酸性由强到弱
的顺序为 (用序号表示)。
(6)本实验的产率为 (保留两位有效数字)
16.(14分)硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的
试卷第7页,共10页
学科网(北京)股份有限公司含量较高,还含有少量Cu、Pb等元素)分离硒回收碲的工艺流程如下:
已知:①水浸液的主要成分为 、 及少量可溶性的铜、铅化合物等。
② 为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,
回答下列问题:
为
(1)硒与氧同族,基态Se原子价电子排布式 ______。
(2)“除杂渣”的主要成分为______。
(3)“中和”时控制pH为4~5,生成 沉淀,若硫酸过量,将导致Te的回收率下降的
原因是______。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的pH为2,此时溶液中
______。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
______。
(6)碘量法测定“粗硒”中硒的含量,过程如下:
取0.1000g粗硒,加入足量硫酸和硝酸,充分反应生成 ,再加热至90℃使过量的
硝酸挥发;继续向 溶液中加入过量的KI溶液,生成Se和 ;然后滴入2滴淀粉
溶液,用0.4000mol/L 溶液滴定( )。重复上
述操作2次,消耗的 溶液的平均体积为12.50mL。①判断滴定至终点的方法是
试卷第8页,共10页
学科网(北京)股份有限公司______。
②该粗硒的纯度为______。
17.(15分)丙烯是重要的有机原料之一,可通过多种途径制备。回答下列问题:
Ⅰ.由丙烷直接脱氢法制备:
(1)已知键能: ;生成 碳碳 键放
出的能量为271 KJ,则 。
(2)在一定温度下,保持总压为 ,将 和 的混合气体分别按
为 和 向密闭容器中投料,发生脱氢反应,测得 的转化率与时间的关系如图1
所示(已知 时反应处于平衡状态)。
点对应的投料方式为 ,原因是__________________。 内,
曲线 (填“ ”“ ”)对应的平均反应速率最快。 点对应的平衡常数
(以分压表示,分压=总压×物质的量分数,保留一位小数)。
Ⅱ.由丙烷氧化脱氢法制备。主要涉及反应:
;
(3)在一定条件下,将物质的量之比为 的 和 匀速通入体积可变的反应容器中
发生上述反应,使总压强恒定为 。在不同温度下反应相同时间,测得丙烷和氧气的
转化率与温度倒数 的关系如图2所示。
试卷第9页,共10页
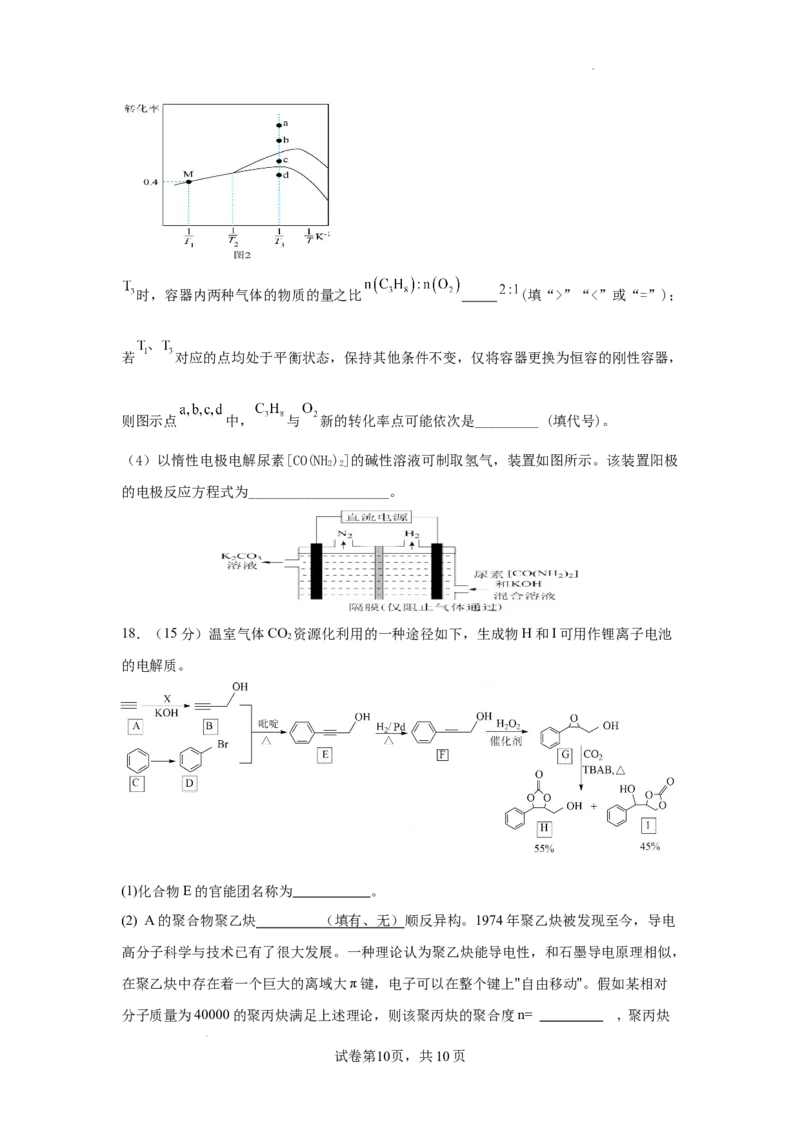
学科网(北京)股份有限公司时,容器内两种气体的物质的量之比 (填“>”“<”或“=”);
若 对应的点均处于平衡状态,保持其他条件不变,仅将容器更换为恒容的刚性容器,
则图示点 中, 与 新的转化率点可能依次是_________ (填代号)。
(4)以惰性电极电解尿素[CO(NH)]的碱性溶液可制取氢气,装置如图所示。该装置阳极
2 2
的电极反应方程式为____________________。
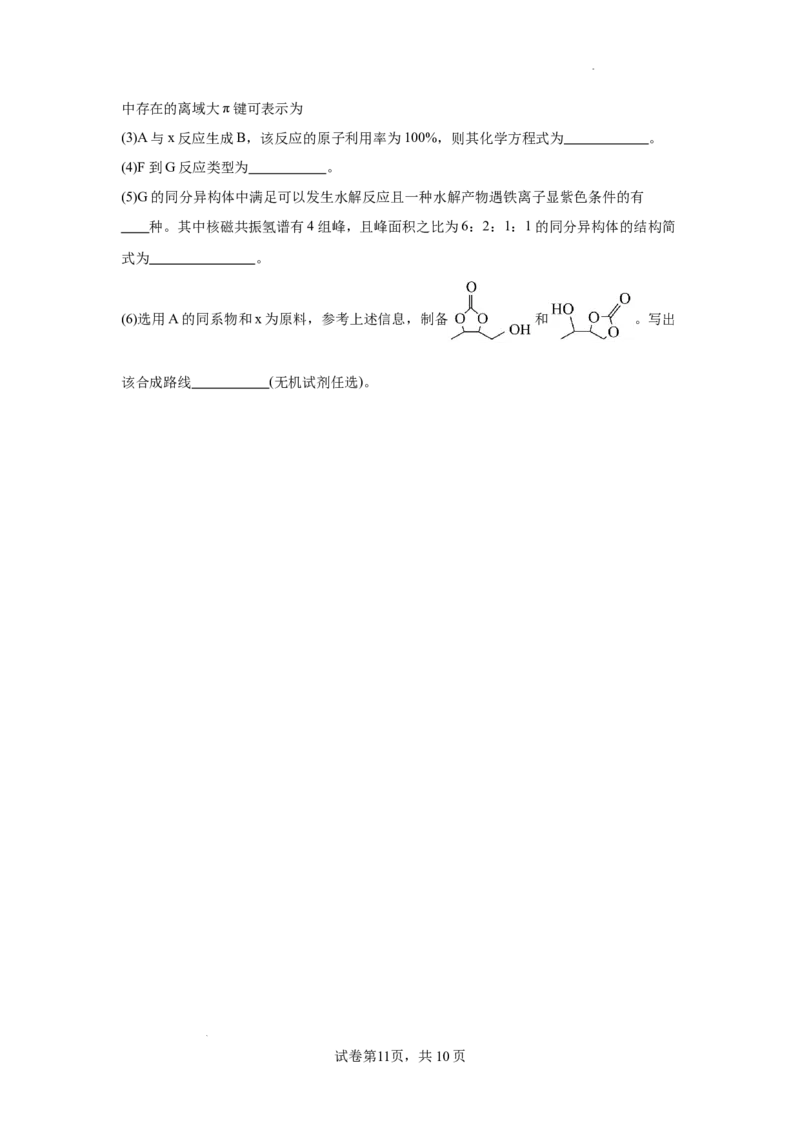
18.(15分)温室气体CO 资源化利用的一种途径如下,生成物H和I可用作锂离子电池
2
的电解质。
(1)化合物E的官能团名称为 。
(2) A的聚合物聚乙炔 (填有、无) 顺反异构。1974年聚乙炔被发现至今,导电
高分子科学与技术已有了很大发展。一种理论认为聚乙炔能导电性,和石墨导电原理相似,
在聚乙炔中存在着一个巨大的离域大π键,电子可以在整个键上"自由移动"。假如某相对
分子质量为40000的聚丙炔满足上述理论,则该聚丙炔的聚合度n= , 聚丙炔
试卷第10页,共10页
学科网(北京)股份有限公司中存在的离域大π键可表示为
(3)A与x反应生成B,该反应的原子利用率为100%,则其化学方程式为 。
(4)F到G反应类型为 。
(5)G的同分异构体中满足可以发生水解反应且一种水解产物遇铁离子显紫色条件的有
种。其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的同分异构体的结构简
式为 。
(6)选用A的同系物和x为原料,参考上述信息,制备 和 。写出
该合成路线 (无机试剂任选)。
试卷第11页,共10页
学科网(北京)股份有限公司